经内镜切除或手术治疗后早期结直肠癌的病理分析和疗效评价*
2014-09-08宋洁莹朱凌音李晓波
宋洁莹 朱凌音 李晓波#
上海交通大学医学院附属仁济医院消化内科 上海市消化疾病研究所1(200001) 武警上海市总队医院急诊科2
早期结直肠癌是指病变局限于黏膜和黏膜下层的结直肠癌,不论病变大小以及是否有淋巴结转移[1]。结直肠癌局限于早期阶段,患者的5年生存率可高达90%;一旦发生转移,5年生存率降至10%[2]。因此,进一步提高早期结直肠癌的检出率、制定更为合理的治疗方案,可改善结直肠癌患者的预后。本研究通过回顾性分析早期结直肠癌患者接受内镜切除或外科手术后的病理资料,旨在为今后提高早期结直肠癌的疗效提供一定依据。
对象与方法
一、研究对象
回顾性分析2009年1月-2013年12月于上海仁济医院行内镜切除或外科手术治疗的4 714例结直肠癌病灶,其中早期结直肠癌病灶503例。按治疗方法分为:①内镜切除组,包括内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)和内镜下黏膜切除术(endoscopic mucosal resection, EMR);②外科手术组。内镜切除组患者术前行内镜和影像学检查,均未发现淋巴结转移,并经术前病理活检初步判断肿瘤的组织学类型;术后按照“术后3个月-6个月-12个月-随后每年1次”的时间间隔进行随访。外科手术组患者在排除肠梗阻后于术前行内镜检查,判断肿瘤的组织学类型,并行影像学检查排除其他脏器转移;术后按照“每6个月-随后每年1次”的时间间隔进行随访,对于低分化或存在淋巴结转移的患者考虑行胸/腹/盆腔CT每年1次。依据NCCN(2008版)结肠癌临床实践指南和NCCN(2008版)直肠癌临床实践指南行结直肠切除术和淋巴结清扫,术后病理确诊为早期结直肠癌。本研究方案经上海仁济医院伦理委员会批准,入选者在接受治疗前均签署知情同意书。
二、病理学诊断依据和危险因素
根据Vienna分型(修订版)[3]将早期结直肠癌分为:①黏膜高级别瘤变(mucosal high-grade neoplasia),包括高级别腺瘤/异型增生(high-grade adenoma/dysplasia)、非浸润性癌(原位癌)(non-invasive carcinoma)(carcinomainsitu)、可疑浸润癌(suspicious for invasive carcinoma)和黏膜内癌(intramucosal carcinoma);②黏膜下浸润癌,根据浸润深度[4]分为黏膜下浅层癌(距黏膜肌层<1 000 μm)和黏膜下深层癌(距黏膜肌层≥1 000 μm)。
纳入分析的病理因素包括肿瘤位置、肿瘤直径、大体分型、浸润深度、组织学分型、是否存在淋巴结转移和脉管癌栓。
三、内镜切除的适应证和疗效评价
局限于黏膜内层或黏膜下浅层的结直肠肿瘤因淋巴结转移率极低,可选用ESD或EMR进行内镜切除。但对平坦凹陷型病灶,尤其是直径>2 cm者,EMR难以实现整块切除,宜行ESD治疗。目前常用的肠ESD适应证参考Tanaka等[5]的研究。
整块切除(enblocresection)是指将病灶一次性完整大块切除。完全切除(complete resection/R0 resection)指病灶整块切除且水平切缘和基底部均无癌细胞累及;若病灶属分块切除或水平切缘/基底部有癌细胞残留,则称不完全切除。治愈性切除须满足以下条件:癌变局限于黏膜内层或仅浸润至黏膜下浅层,分化良好,整块切除且水平切缘和基底均无癌细胞累及,脉管无癌栓浸润。
四、统计学分析
采用SPSS 20.0统计软件,单因素分析采用χ2检验,多因素分析采用二元Logistic回归分析,P<0.05为差异有统计学意义。
结 果
一、早期结直肠癌浸润深度的危险因素
本组早期结直肠癌病灶503例[共479例患者入选,其中男291例,女188例;年龄26~92岁,平均(63.8±10.6)岁],检出率为10.7%。黏膜高级别瘤变247例,黏膜下层癌256例;肿瘤以位于左半结肠和直肠为主;肿瘤直径0.2~9 cm,平均(2.0±1.2) cm,其中338例肿瘤直径≤2 cm;隆起型病灶455例(90.5%),48例(9.5%)为平坦凹陷型;6例(1.2%)病灶发生淋巴结转移,均为黏膜下层癌;4例低分化癌均已浸润至黏膜下层;内镜切除组274例病灶,外科手术组为229例病灶(表1)。单因素分析显示,肿瘤位置(P<0.001)、肿瘤直径(P=0.013)、淋巴结转移(P=0.015)和组织学分型(P=0.049)对早期结直肠癌的浸润深度均有明显影响。多因素分析结果提示,病灶位于直肠(P<0.001)、直径>2 cm(P=0.028)时,早期结直肠癌浸润越深。
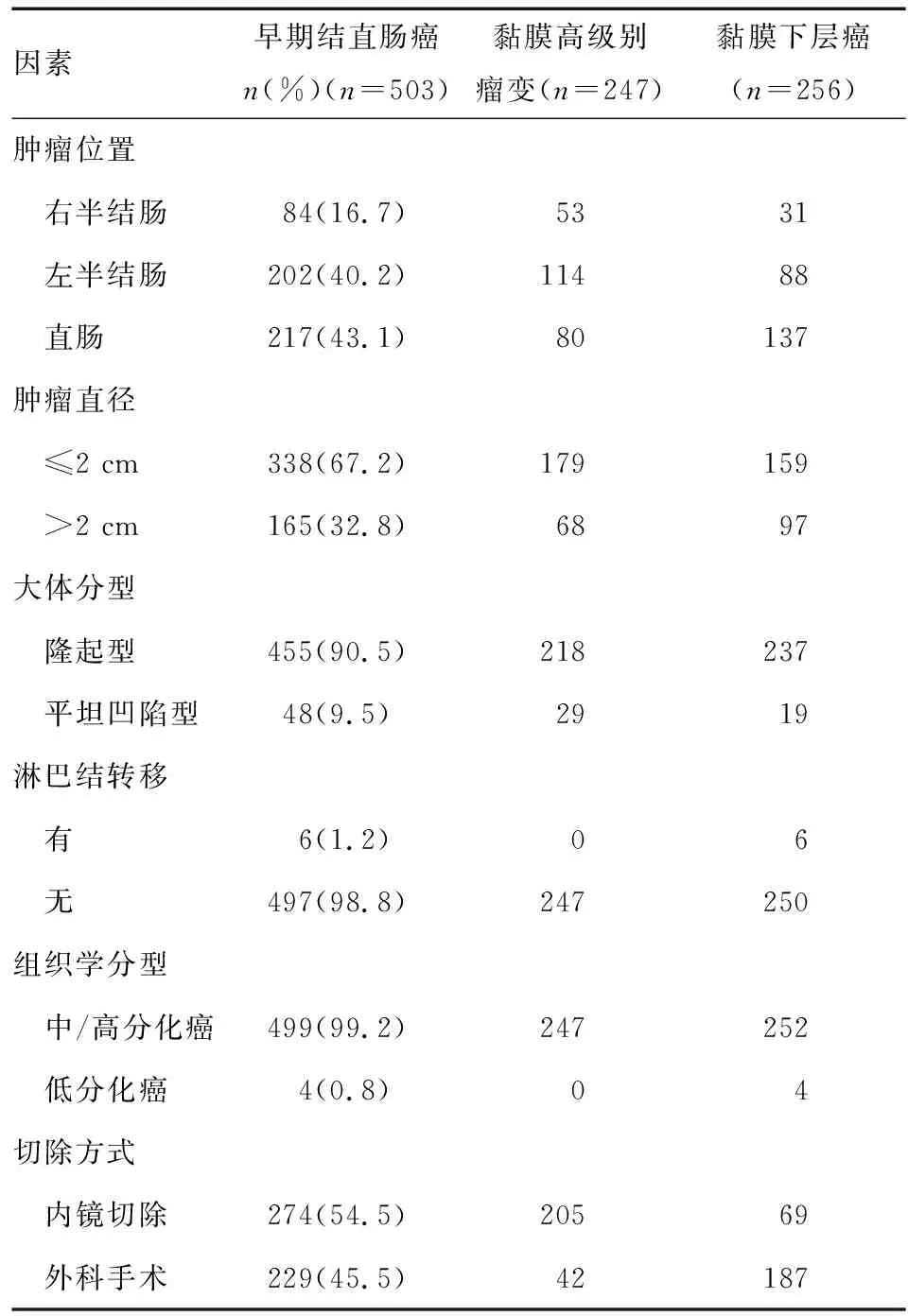
表1 不同浸润深度的早期结直肠癌的病理特征
二、外科手术组早期结直肠癌淋巴结转移的危险因素
6例(2.6%)外科手术组病灶发生了淋巴结转移。外科手术组229例病灶[共229例患者入选,其中男130例,女99例;年龄32~92岁,平均(65.6±11.6)岁]中,肿瘤直径0.2~9 cm,平均(2.5±1.4)cm;肿瘤大体分型以隆起型为主(93.9%);黏膜高级别瘤变42例,黏膜下层癌187例;2例低分化癌均已浸润至黏膜下深层(表2)。1例直肠黏膜下癌术后病理发现切缘残留,未追加手术。单因素和多因素分析均显示肿瘤位置、直径、大体分型、浸润深度和组织学分型与淋巴结转移均无关(P>0.05)。随访期间,复发8例,原发灶均为直肠管状腺癌,其中原位复发4例,平均间隔21.3个月,均为女性,平均年龄59.5岁;肠道异位复发4例(升结肠2例;降结肠2例),原发灶浸润至黏膜下层,平均间隔34.3个月,男女比例1∶1,平均年龄 61.5岁。8例病灶均再次接受外科手术切除,病理结果为管状腺癌,无切缘残留、未见淋巴结转移。
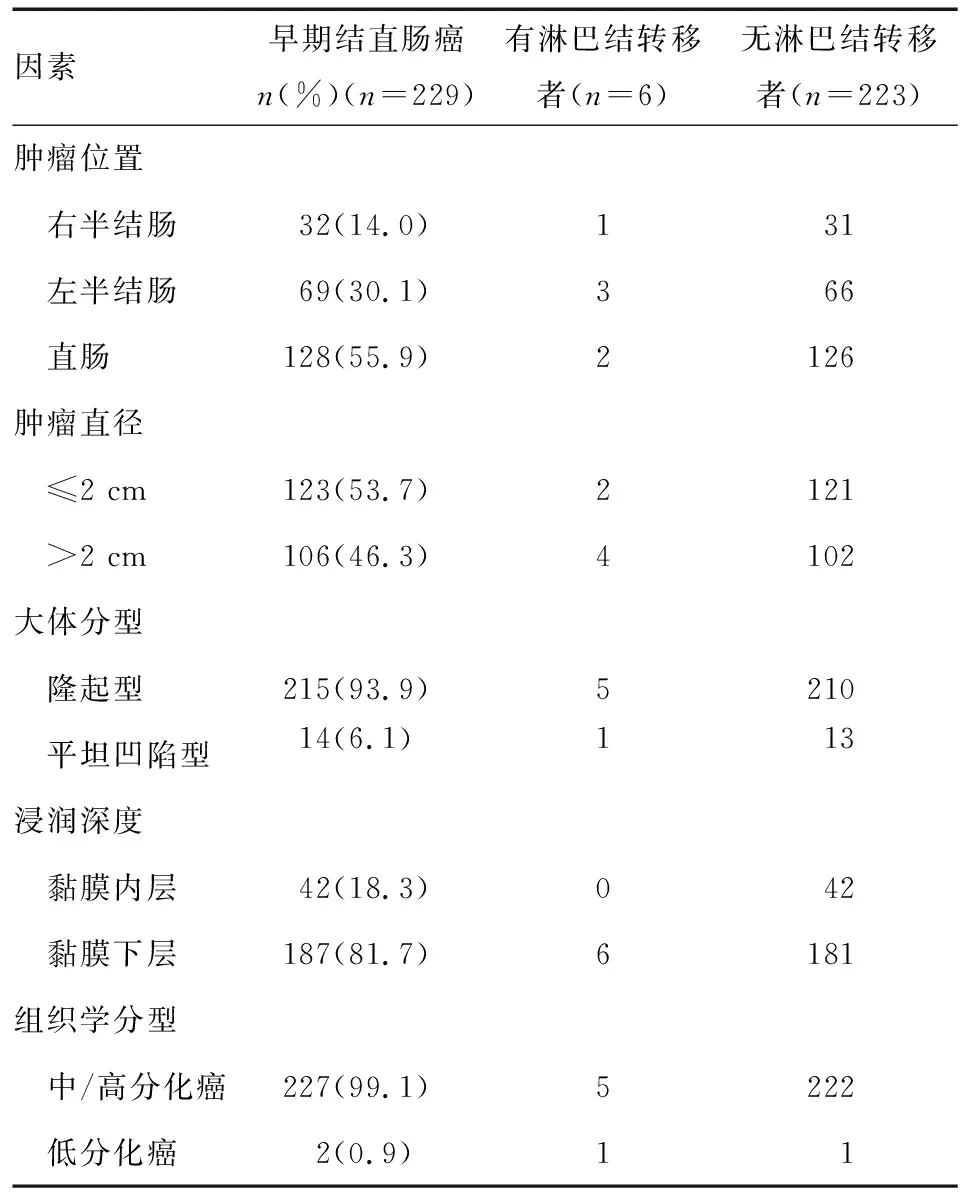
表2 外科手术组早期结直肠癌的病理特征与淋巴结转移情况
三、早期结直肠癌经内镜切除的疗效评价
内镜切除组共274例病灶[250例患者,其中男161例,女89例;年龄26~85岁,平均(62.6±10.1)岁],无一例发生淋巴结转移。肿瘤直径0.2~5 cm,平均(1.7±0.9)cm;263例病灶为整块切除,11例为分块切除。258例病灶为完全切除,11例分块切除以及5例切缘和(或)基底残留癌细胞的病灶为不完全切除。225例病灶为治愈性切除,导致病灶非治愈性切除的原因为黏膜下深层癌、低分化癌、分块切除、切缘和(或)基底残瘤和脉管癌栓,其中水平切缘和(或)基底残留癌细胞的病灶包括3例仅有切缘残留,1例仅有基底残留以及1例切缘和基底均有残留;脉管癌栓均已浸润至黏膜下深层,并均行EMR;2例低分化病灶中1例浸润至黏膜下浅层,另1例浸润至深层。非治愈性切除的7例黏膜高级别瘤变中,6例为分块切除,1例切缘残留癌细胞。非治愈性切除的4例黏膜下浅层癌中,2例为分块切除,2例切缘残留癌细胞。术后随访未发现肿瘤残留或原位复发。为实现完全切除,有切缘和(或)基底残留癌细胞的5例病灶均再次进行了内镜治疗;其余分块切除或非治愈性切除患者均未追加内镜治疗或外科手术。
单因素分析显示,显著影响整块切除的因素为肿瘤位置(P<0.001);显著影响完全切除的因素为肿瘤位置(P<0.001)和浸润深度(P=0.008);显著影响治愈性切除的因素为肿瘤位置(P=0.035)和浸润深度(P<0.001)。多因素分析显示,浸润深度对整块切除(P=0.030)和完全切除(P=0.018)均有显著影响(表3)。
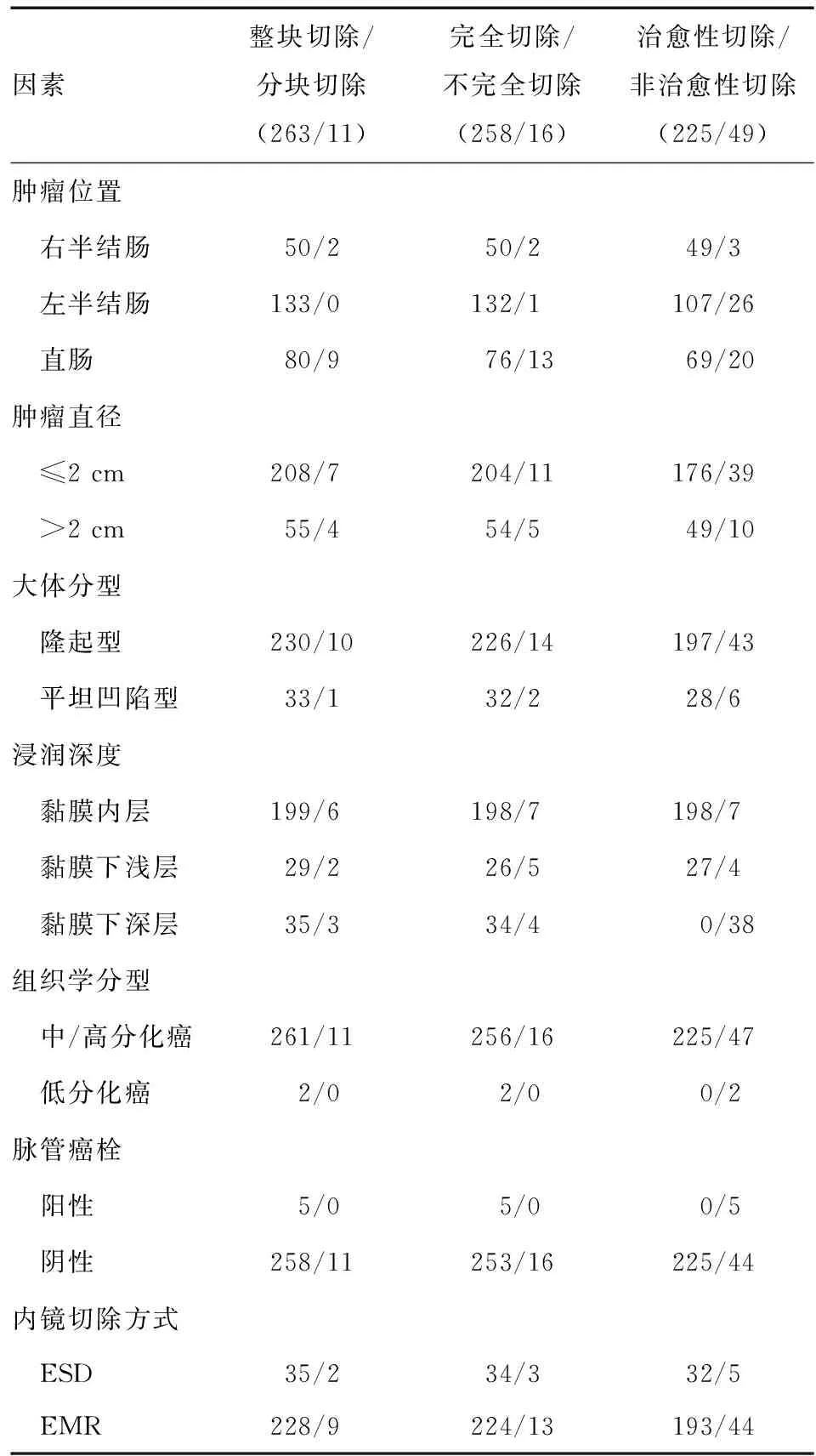
表3 影响内镜切除早期结直肠癌疗效的危险因素分析(n/n)
四、内镜切除组与外科手术组疗效比较
随访期间,内镜切除组均未发现原位复发或新发肿瘤;外科手术组8例黏膜下层癌病灶发生复发,其中4例原位复发,4例异位复发。内镜切除组淋巴结转移、异位复发、原位复发和肿瘤残留发生率均低于外科手术组(P<0.05)(表4)。
讨 论
结直肠肿瘤的癌变过程为经典的“腺瘤-黏膜内癌-浸润癌”模式,摘除早期结直肠肿瘤可降低76%~90%的癌症发病率和53%的死亡率[6]。目前结肠镜对腺瘤的检出率为7%~44%[7];微小腺瘤(≤5 mm)的漏检率为27%,小腺瘤(6~9 mm)为13%,大腺瘤(≥10 mm)为11%[7],结直肠癌为4%[8]。本研究早期结直肠癌的检出率仅10.7%。为进一步提高早期结直肠癌和腺瘤的检出率、降低漏检率,各种新的内镜成像技术正在兴起,如窄带成像(NBI)、放大色素内镜、超声内镜、智能分光比色内镜(FICE)、红外荧光内镜(IRFE)和共聚焦激光显微内镜(CLE)等。
当结直肠癌局限于黏膜内层或仅浸润至黏膜下浅层时,极少发生淋巴结转移;一旦浸润至黏膜下层超过1 000 μm时,淋巴结转移率可达6%~12%[4,9]。正是基于结直肠癌浸润和转移的特点,内镜切除可安全有效地治愈黏膜内和黏膜下浅层病灶,而黏膜下深层癌应接受外科手术根除。本研究早期结直肠癌的淋巴结转移率仅1.2%,其中黏膜高级别瘤变均未发生淋巴结转移,黏膜下层癌的转移率为2.3%。外科手术组42例(18.3%)黏膜高级别瘤变均无淋巴结转移,即有近1/5的患者本有机会选择内镜切除,在一定程度上预示着内镜切除治疗的发展潜力。单因素和多因素分析显示,外科手术组肿瘤位置、直径、大体分型、浸润深度和组织学分型与淋巴结转移均无关,原因可能为发生淋巴结转移的病灶数量较少,未能进一步区分黏膜下浅层与深层有关。值得注意的是,外科手术组出现复发病灶共8例,原发病灶均位于直肠且浸润至黏膜下层,再次手术切除后病理证实管状腺癌,浸润至黏膜下层。已有报道指出, 直肠癌的预后较结肠癌差[10],复发率约为5%~20%[11],其原因可能为盆腔狭窄使手术操作受到限制未能彻底清除,而直肠黏膜较其他肠黏膜更易受致癌因子的作用而癌变所致[12]。因此,应高度重视直肠病灶,必须保证切除足够的原发灶且清除足够的淋巴结。此外,据统计95%的结直肠癌于术后3年内复发[13],本研究的复发病灶均发生于术后3年内。因此,术后第一个3年内选择有效的随访方式可提高检出率、降低漏诊率。Machida等[14]报道NBI根据棕色血管网鉴别结直肠肿瘤性、非肿瘤性病灶的准确性达93.4%,显著高于普通内镜的79.1%。此外,可在肿瘤复发的高危时间段适当缩短内镜检查间隔以期提高早期发现的可能。
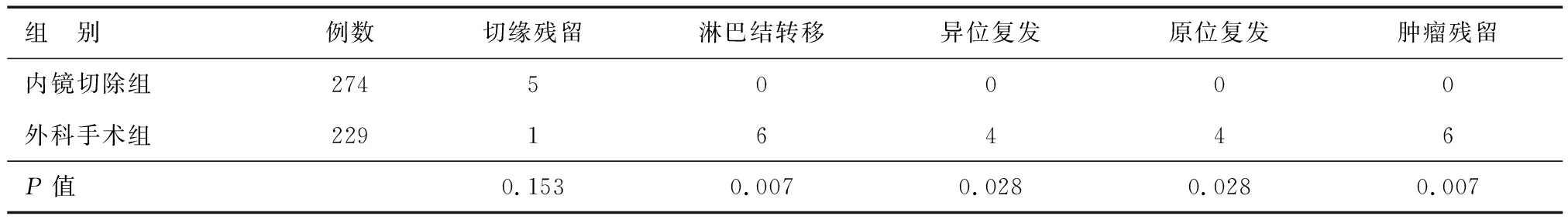
表4 内镜切除组与外科手术组疗效比较(n)
本研究多数内镜切除组患者采用NBI行术前评估,初步判断了病灶性质和浸润深度。新近两篇meta分析[15-16]均肯定了NBI诊断结直肠病灶的精确性。放大内镜结合窄带成像技术(ME-NBI)可有效区分肿瘤性与非肿瘤性病灶(准确性95.3%,敏感性96.4%,特异性92.3%)[17]、浅层与深层浸润的黏膜下癌(准确性87.7%,敏感性84.8%,特异性88.7%)[18]。本研究单因素和多因素分析均显示,当病灶位于直肠、直径>2 cm时,早期结直肠癌的浸润越深(P<0.05);说明术前判断此类病灶需警惕其浸润至黏膜下层的可能。
直径<2 cm并局限于黏膜内的病灶是传统EMR切除的适应证。然而,对于直径较大、平坦型或伴随纤维化的病灶,EMR往往难以实现整块切除[5,19];分块切除将大大增加肿瘤残留或复发的风险;ESD由此应运而生。一项纳入13个临床中心共计2 719例病灶的研究[20]结果显示,肠ESD的完全切除率可达82.8%(61%~98.2%)。对310例早期结直肠肿瘤(包括146例腺瘤和164例腺癌)的ESD术后随访研究[21]表明,3年、5年总体生存率和疾病特异性生存率分别为97.1%、100%和95.3%、100%。另有研究[22]证实,结直肠肿瘤ESD的整块切除率显著高于EMR(84%对33%,P<0.000 1),且术后原位复发率显著低于EMR(2%对14%,P<0.000 1)。本研究早期结直肠癌的内镜切除疗效比较理想,病灶的整块切除率为 96.0%,完全切除率为94.2%,治愈性切除率为 82.1%。单因素分析显示,病灶位于直肠是降低整块切除率和完全切除率的危险因素(P<0.05),提示内镜切除直肠病灶时应更为慎重。导致非治愈性切除的主要原因为癌变浸润至黏膜下深层和分块切除。单因素或多因素分析均显示,癌变浸润至黏膜下层是降低整块切除率、完全切除率以及治愈性切除率的危险因素(P<0.05)。由此可见,浸润深度不仅是早期结直肠癌术前选择治疗方式的重要依据,亦是影响内镜切除疗效的关键原因。
本研究中,内镜切除组淋巴结转移、肠道复发和肿瘤残留发生率均低于外科手术组(P<0.05)。肿瘤复发是降低生存率的关键因素,日本的回顾性研究指出结直肠癌ESD和EMR的局部复发率分别为2%和14%[22];而早期直肠癌外科手术5年复发率可达16.8%[23]。一项涉及887例病灶的研究[24]显示外科手术后原位复发与手术过程中原发灶癌细胞种植和肿瘤残留有关;术后肠道其他部位的复发肿瘤可能是由于切除范围外的淋巴结跳跃转移或肠腔播散造成。由此可见,外科手术对肠道正常生理结构的破坏是无法避免的,导致术后复发率升高且生存质量降低。日本一项最新的大样本回顾性分析[25]显示,早期结直肠癌内镜切除的安全性和低创性给患者带来更高的生存质量;对于直肠癌,即使是创伤较小的腹腔镜手术的复发率亦高于ESD且耗时更长。说明内镜切除是无淋巴结转移的结直肠癌治疗首选,与本研究结果一致。
综上所述,由于早期结直肠癌的淋巴结转移率极低,术前运用NBI等技术充分判断病灶的性质和浸润深度,有助于使患者接受更为合理的内镜切除方式(ESD或EMR)或外科手术。对可能浸润至黏膜下层的病灶行内镜切除应更为重视且谨慎,以期提高内镜切除的疗效。
1 中华医学会消化内镜学分会肠道学组. 中国早期大肠癌内镜诊治共识意见[J]. 中华消化内镜杂志, 2008, 25 (12): 617-620.
2 Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2009[J]. CA Cancer J Clin, 2009, 59 (4): 225-249.
3 Dixon MF. Gastrointestinal epithelial neoplasia: Vienna revisited[J]. Gut, 2002, 51 (1): 130-131.
4 The Paris endoscopic classification of superficial neoplastic lesions: esophagus, stomach, and colon: November 30 to December 1, 2002[J]. Gastrointest Endosc, 2003, 58 (6 Suppl): S3-S43.
5 Tanaka S, Oka S, Chayama K. Colorectal endoscopic submucosal dissection: present status and future perspective, including its differentiation from endoscopic mucosal resection[J]. J Gastroenterol, 2008, 43 (9): 641-651.
6 Zauber AG, Winawer SJ, O’Brien MJ, et al. Colonoscopic polypectomy and long-term prevention of colorectal-cancer deaths[J]. N Engl J Med, 2012, 366 (8): 687-696.
7 Nass JP, Connolly SE. Current status of chromoendoscopy and narrow band imaging in colonoscopy[J]. Clin Colon Rectal Surg, 2010, 23 (1): 21-30.
8 Bressler B, Paszat LF, Vinden C, et al. Colonoscopic miss rates for right-sided colon cancer: a population-based analysis[J]. Gastroenterology, 2004, 127 (2): 452-456.
9 Morson BC, Whiteway JE, Jones EA, et al. Histopathology and prognosis of malignant colorectal polyps treated by endoscopic polypectomy[J]. Gut, 1984, 25 (5): 437-444.
10 Roncucci L, Fante R, Losi L, et al. Survival for colon and rectal cancer in a population-based cancer registry[J]. Eur J Cancer, 1996, 32A (2): 295-302.
11 Huguier M, Houry S, Barrier A. Local recurrence of cancer of the rectum[J]. Am J Surg, 2001, 182 (5): 437-439.
12 Killingback M, Barron P, Dent OF. Local recurrence after curative resection of cancer of the rectum without total mesorectal excision[J]. Dis Colon Rectum, 2001, 44 (4): 473-483.
13 Park YJ, Park KJ, Park JG, et al. Prognostic factors in 2230 Korean colorectal cancer patients: analysis of consecutively operated cases[J]. World J Surg, 1999, 23 (7): 721-726.
14 Machida H, Sano Y, Hamamoto Y, et al. Narrow-band imaging in the diagnosis of colorectal mucosal lesions: a pilot study[J]. Endoscopy, 2004, 36 (12): 1094-1098.
15 Wu L, Li Y, Li Z, et al. Diagnostic accuracy of narrow-band imaging for the differentiation of neoplastic from non-neoplastic colorectal polyps: a meta-analysis[J]. Colorectal Dis, 2013, 15 (1): 3-11.
16 McGill SK, Evangelou E, Ioannidis JP, et al. Narrow band imaging to differentiate neoplastic and non-neoplastic colorectal polyps in real time: a meta-analysis of diagnostic operating characteristics[J]. Gut, 2013, 62 (12): 1704-1713.
17 Sano Y, Ikematsu H, Fu KI, et al. Meshed capillary vessels by use of narrow-band imaging for differential diagnosis of small colorectal polyps[J]. Gastrointest Endosc, 2009, 69 (2): 278-283.
18 Ikematsu H, Matsuda T, Emura F, et al. Efficacy of capillary pattern type ⅢA/ⅢB by magnifying narrow band imaging for estimating depth of invasion of early colorectal neoplasms[J]. BMC Gastroenterol, 2010, 10: 33.
19 Bourke M. Current status of colonic endoscopic mucosal resection in the west and the interface with endoscopic submucosal dissection[J]. Dig Endosc, 2009, 21 Suppl 1: S22-S27.
20 Tanaka S, Terasaki M, Kanao H, et al. Current status and future perspectives of endoscopic submucosal dissection for colorectal tumors[J]. Dig Endosc, 2012, 24 Suppl 1: 73-79.
21 Niimi K, Fujishiro M, Kodashima S, et al. Long-term outcomes of endoscopic submucosal dissection for colorectal epithelial neoplasms[J]. Endoscopy, 2010, 42 (9): 723-729.
22 Saito Y, Fukuzawa M, Matsuda T, et al. Clinical outcome of endoscopic submucosal dissection versus endoscopic mucosal resection of large colorectal tumors as determined by curative resection[J]. Surg Endosc, 2010, 24 (2): 343-352.
23 Patel SA, Chen YH, Hornick JL, et ak. Early-stage rectal cancer: clinical and pathologic prognostic markers of time to local recurrence and overall survival after resection[J]. Dis Colon Rectum, 2014, 57 (4): 449-459.
24 Thomson WH, Foy CJ, Longman RJ. The nature of local recurrence after colorectal cancer resection[J]. Colorectal Dis, 2008, 10 (1): 69-74.
25 Saito Y, Yamada M, So E, et al. Colorectal endoscopic submucosal dissection: Technical advantages compared to endoscopic mucosal resection and minimally invasive surgery[J]. Dig Endosc, 2014, 26 Suppl 1: 52-61.
