电刺激迷走神经对感染性休克大鼠钙结合蛋白S100A8表达的影响
2014-09-07雷鸣许开亮赵龙姝姚玉龙陈秀妹
雷鸣 许开亮 赵龙姝 姚玉龙 陈秀妹
(上海市第七人民医院重症医学科,上海 200137)
细菌内毒素及其诱导生成的大量炎性细胞因子是感染性休克时持续低血压的重要原因之一。这些炎性细胞因子中,以对肿瘤坏死因子α(TNF-α)研究居多[1],与之作用相似的另一细胞因子——钙结合蛋白S100A8近来逐渐受到关注。S100A8 是S100 蛋白家族成员,又称MRP8 (migration inhibitory factor related protein-8)。S100A8是一个多功能分子,可参与诱导细胞凋亡、抑制细胞增殖,并在髓系细胞分化以及动物的胚胎发育和免疫炎性反应过程中起重要作用。行使功能时,S100A8通常与S100蛋白家族的另一个成员S100A9(MRP14)形成异二聚体,介导完成生物学功能[2]。越来越多的研究[3-4]表明,在机体受到强烈刺激或在应激状态下,胆碱能抗炎通路被激活,通过神经及其递质乙酰胆碱的相互作用,对抗炎性反应因子,降低生物毒素的致死率,调节或对抗全身炎性反应,提示胆碱能抗炎通路对感染性休克导致的过度全身性炎性反应有一定的预防和拮抗作用。本研究采用盲肠结扎穿孔法(cecal ligation and puncture,CLP)制作大鼠感染性休克模型,进而检测电刺激感染性休克大鼠的迷走神经时血压、血浆钙结合蛋白S100A8含量的变化,探究在抗感染性休克中迷走神经兴奋所起的作用与相关机制。
1 资料与方法
1.1 实验所用动物和分组实验 选取体质量250~300 g的健康雄性Wistar大鼠(SPF级)30只,将大鼠随机分为6组,每组5只。分组如下:①假电针正常组:假电针刺激迷走神经干;②电针正常组:电针刺激迷走神经干;③假电针CLP组:行CLP术+假电针刺激迷走神经干;④电针CLP组:行CLP术+电针刺激迷走神经干;⑤迷切假电针CLP组:行CLP术+双颈部迷走神经干离断术+假电针刺激迷走神经干;⑥迷切电针CLP组:行CLP术+双颈部迷走神经干离断术+电针刺激迷走神经干。
1.2 CLP模型建立 大鼠腹腔注射乌拉坦(浓度为200 g/L,剂量为1 g/kg体质量),麻醉后,行颈总动脉和迷走神经的分离手术;并且对颈总动脉进行置管连接,连续监测直接动脉压。在大鼠前腹正中作一长2~3 cm的切口,切开后,游离肠系膜和盲肠,用3-0丝线环绕盲肠根部并结扎,再用9号针头在盲肠端部行两处穿刺,两处穿刺位置相距3 mm左右,穿刺后将盲肠还纳回肠管,然后逐层缝合,关腹。手术完成后,皮下注射0.9%氯化钠液(30 mL/kg),以补充手术过程中丢失的体液。碘附消毒大鼠,包扎伤口。对假CLP组实验动物不进行结扎手术,亦不进行盲肠穿刺,其余与CLP组操作一致。
1.3 迷走神经离断和电刺激 麻醉完成后,仰卧位放置大鼠。备皮并进行固定,沿颈腹正中线(喉头与胸骨之间位置)作2.5~4 cm长的切口,用止血钳分离胸骨甲状肌和骨舌骨肌,分离后寻找颈动脉鞘(其内含有颈动脉和颈部神经)。实验操作者用左手拇指和食指抓住大鼠颈皮和颈肌,用中指指尖顶起颈皮和颈肌使其外翻,右手持玻璃分针或蚊式止血钳沿着血管走向慢慢将迷走神经和颈总动脉分离3~4 cm,用4-0丝线结扎迷走神经,然后将其剪断,在远端将其与双铂电极连接。CLP术后立即以5V、2 ms和l Hz强度的电能,持续刺激迷走神经远端20 min。
1.4 主要试剂及仪器 大鼠钙结合蛋白S100A8 ELISA试剂盒(南京建成生物技术研究所),瑞士TECAN公司Infinite 200酶标仪,日本光电公司Nihon kohdensEN-7103电生理刺激仪。
1.5 观察指标及样本采集
1.5.1 大鼠的一般状况及血流动力学指标 CLP术后观察动物有无寒颤、竖毛、萎靡、脓尿、眼角分泌物增加及腹泻等表现。平均动脉压的检测由颈总动脉连接管进行连续监测。12 h后处死大鼠,解剖并用肉眼观察不同器官的形态。
1.5.2 血浆钙结合蛋白S100A8含量的测定 分别在电刺激迷走神经后6 h和12 h,于颈总动脉处采0.8 mL血,置于含EDTA抗凝剂的无菌离心管中,离心(4℃,3500 g)15 min后,吸取上清,保存于-70℃待用。采用酶联免疫吸附试验(ELISA)法检测血浆钙结合蛋白S100A8蛋白水平,按试剂盒说明书进行实验操作。
2 结 果
2.1 大鼠机体状况和形态学变化 CLP手术后,大鼠活动度减少,出现嗜睡、竖毛,不饮水或饮水减少,呼吸不正常(有时急促),并伴有有脓尿、腹泻和眼睛分泌渗出物等。解剖大鼠发现,CLP组和迷切组大鼠出现腹腔渗出液伴血,恶臭;盲肠粘连,有坏疽,肿胀变黑;空肠肠管胀气;肝脏、肺脏、肾脏等器官水肿并充血,产生瘀点甚至瘀斑等。电刺激组上述变化不明显。
2.2 大鼠平均动脉压改变 见表1。

表1 各组大鼠平均动脉压的变化(mmHg)
2.3 血浆钙结合蛋白S100A8表达水平变化 模型建立成功后,采用ELISA法检测血浆钙结合蛋白S100A8,结果显示,血浆钙结合蛋白S100A8含量显著升高,相比正常组,各相应时间点差异均有统计学意义。切断迷走神经后,血浆钙结合蛋白S100A8表达水平上升更明显,与CLP组相比,各时间点差异均有统计学意义。迷走神经受电刺激后,血浆钙结合蛋白S100A8表达水平显著降低;在CLP手术后6 h和12 h均低于迷切假电针CLP组各个时间点的钙结合蛋白S100A8表达水平,差异有统计学意义。见图1。
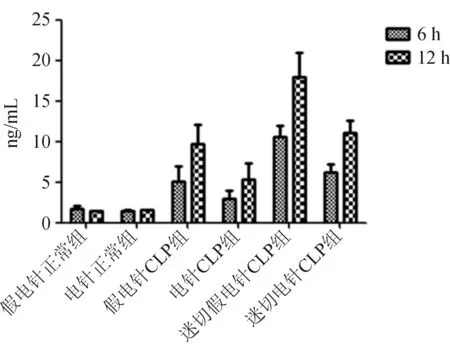
图1 不同组大鼠CLP术后不同时间点血浆S100A8水平的比较(ng/mL)
3 讨 论
发生炎性反应时,中性粒细胞会分泌产生大量炎性因子,包括S100A8。研究[5]表明,S100A8参与了急、慢性炎性反应,炎性反应病灶周围存在的大量白细胞会被S100A8的趋化作用吸引,进而产生抗炎效应。一方面,促炎物质肿瘤坏死因子(TNF) 以及白细胞介素1(IL-1)、γ- 干扰素(IFN-γ)等均可诱导巨噬细胞或内皮细胞高表达S100A8;另一方面,在特定生理状态下,S100A8可直接刺激炎性细胞分泌炎性反应分子,参与拮抗炎性反应疾病的过程[6]。另有研究[7]表明,S100A8 作为炎性反应标志分子,比C反应蛋白(C-reactive protein,CRP)更可靠。然而,目前对于S100A8在炎性反应中与迷走神经胆碱能抗炎通路的关系的研究极少。本试验结果显示,大鼠接受CLP术后,平均动脉压进行性下降,血浆中S100A8显著升高;而电刺激迷走神经后,平均动脉压下降趋势减缓,血浆中S100A8水平显著降低,表明电刺激迷走神经可减轻全身性炎性反应;其机制可能是迷走神经兴奋后释放大量乙酰胆碱;后者与存在于多形核白细胞上的乙酰胆碱受体结合,通过一系列途径抑制白细胞释放S100A8,从而拮抗炎性反应。
目前,临床试验中用于治疗感染性休克的炎性反应因子的抗体和炎性反应介质的拮抗剂等抗炎效果均不理想[7]。最近研究[8]发现,当病菌侵袭机体时,迷走神经可快速作用于巨噬细胞,抑制炎性反应因子的释放,而达到拮抗炎性反应、保护机体免受损害的目的。因此,迷走神经胆碱能抗炎通路,可以在治疗感染或炎性反应性休克中发挥重要作用,为临床治疗休克提供新的思路。胆碱能通路在抗炎性反应中的作用逐渐被揭示并备受关注[9]。S100A8 是一种Ca2+结合蛋白,该蛋白具有促炎性反应活性。目前认为,S100A8 可以调节炎性反应,主要通过参与相应的信号通路实现,而关于S100A8蛋白与胆碱能通路相互作用的研究甚少,这二者是否在抗炎性反应中形成一个反馈是一个值得探讨的问题[10]。本试验研究结果提示,在全身性炎性反应中,迷走神经胆碱能通路会下调S100A8的表达,从而起到抗炎性反应的作用,S100A8在感染性休克抗炎性反应治疗中用重要应用价值,有望成为炎性反应预测和治疗的新选择。
[1]TeohNC, Farrell GC.Hepatic ischemia reperfusion injury: pathogenic mechanisms and basis for hepatoprotection[J].J Gastroenterol Hepatol.2003, 18(8):891-902.
[2]Donato R, Cannon BR, Sorci G,et al.Functions of S100 Proteins[J]. CurrMol Med, 2013, 13(1):24-57.
[3]Pavlov VA, Wang H, Czura CJ,et al.The cholinergic anti-inflammatory pathway: a missing link in neuroimmunomodulation[J].Mol Med, 2003, 9(5-8):125-134.
[4]Picq CA, Clarencon D, Sinniger VE, et al. Impact of Anesthetics on Immune Functions in a Rat Model of Vagus Nerve Stimulation[J]. PLoS One, 2013, 8(6):e67086.
[5]饶亚岚, 陈肖华, 王琳, 等. 7Gyγ射线照射后4h小鼠骨髓差异表达基因的初步研究[J].国际放射医学核医学杂志,2007, 31: 245-247
[6]Koy M1, Hambruch N, Hussen J, et al.Recombinant bovine S100A8 and A9 enhance IL-1β secretion of interferon-gamma primed monocytes[J].Vet ImmunolImmunopathol, 2013,155(3):162-170.
[7]Simard JC, Cesaro A, Chapeton-Montes J,et al. S100A8 and S100A9 induce cytokine expression and regulate the NLRP3 inflammasome via ROS-dependent activation of NF-κB(1.)[J].PLoS One, 2013,8(8):e72138.
[8]Martelli D, Yao ST, Mancera J,et al. Reflex control of inflammation by the splanchnic anti-inflammatory pathway is sustained and independent of anesthesia[J].Am J PhysiolRegulIntegr Comp Physiol, 2014, pii: ajpregw.00259.2014 [Epub ahead of print]
[9]胡正芳,李建国,杜朝晖,等. 电刺激迷走神经对感染性休克大鼠肝脏炎性反应的影响[J]. 武汉大学学报(医学版),2004,25(4):368-372.
[10]Pavlov VA, Wang H, Czura CJ, et al.The cholinergic anti-inflammatory pathway: a missing link in neuroimmunomodulation[J].Mol Med, 2003,9(5-8):125-134.
