鸡肠道枯草芽孢杆菌的分离鉴定及生物特性研究
2014-09-05曹允考魏亚松常淑伟温建新
王 彬,曹允考,魏亚松,常淑伟,胡 倩,温建新
(东北农业大学动物医学学院,哈尔滨 150030)
近年来,养殖业已成为我国重要的支柱产业,与人们的生活息息相关。然而,一些动物肠道性疾病频繁发生,养殖业大量滥用抗生素来防治动物疾病,从而导致动物体内药物残留、细菌耐药性不断增强等问题。抗生素类药物既可以抑制病原菌,也对动物体内的益生菌有抑制作用,破坏动物肠道内的微生态平衡,增加幼龄动物对于病原菌的易感性,使得养殖场内幼龄动物腹泻致死现象经常出现。而含有益生菌的微生态制剂能够改善因长期使用抗生素药物所带来的副作用。微生态制剂能够调节肠道微生态环境,具有无毒副作用、无药物残留、细菌不产生耐药性等特点,从而防治动物肠道疾病,提高动物的生产性能和抗病能力,以获得较大的经济效益,所以微生态制剂的研究在养殖行业、科研方面具有广阔的应用前景[1-3]。
微生态制剂的研究和应用已成为当今微生物学、饲料学、食品科学与安全、微生态学等领域的研究热点,日益受到人们的高度关注。我国农业部于2003年公布15个可直接用于生产动物饲料添加剂菌种,包括干酪乳杆菌、枯草芽孢杆菌、地衣芽孢杆菌等;2005年版的饲料添加剂品种目录允许使用微生物菌种增加了3种[4-5]。
本文从健康的鸡肠道中分离出芽孢杆菌,并对该菌株进行形态观察、生理生化鉴定和16S rRNA序列分析及同源性比较检测该菌株对抗菌药物的敏感性和对所饲喂动物生长的影响,为今后开发安全、有效的微生态制剂奠定基础。
1 试验材料
1.1 试验动物
试验动物为青岛农业大学预防实验室饲喂的健康鸡。
1.2 试验仪器
超净工作台(苏净集团安泰公司生产),TDL80-2号型飞鸽牌台式离心机(上海安亭科学仪器厂生产),电子调温万用电炉(山东龙口市先科仪器公司生产),YY0027-90型电热恒温培养箱(山东龙口市先科仪器公司生产),YXQ-LS-18SI型手提式不锈钢蒸汽灭菌器(上海博讯实业有限公司医疗设备厂生产),HZQ-C空气浴振荡器(哈尔滨市东明医疗仪器厂生产),显微镜等。
1.3 试验试剂
普通营养琼脂培养基和营养肉汤培养基(购自北京陆桥技术有限责任公司),葡萄糖蛋白胨水培养基,半固体培养基,西蒙氏培养基,糖醇苷生化反应试剂和药敏纸片(购自杭州天和微生物制剂有限公司),革兰氏染液(购自青岛高科园海博生物技术有限公司),0.5%沙黄溶液,5%孔雀绿染液,革兰氏碘液,甲基红指示剂,戊醇,吲哚指示剂,TE缓冲液,溶菌酶,蛋白酶K,十二烷基酸钠(SDS),70% 乙醇,氯仿/异戊醇,酚/氯仿/异戊醇,无水乙醇,Premixed Taq(incl dye)、DL 2000 DNA Marker、电泳级琼脂糖Agarose Regular(购自大连宝生物工程有限公司)等。
2 试验方法
2.1 样品的采集与处理
无菌条件下剖杀健康育成鸡取肠道,剪碎肠组织置于含有无菌生理盐水的试管中,并充分震荡混匀30 min,制成匀浆后离心,取上清液得到菌悬液,在70℃水浴中孵育20 min。
2.2 菌株的分离纯化
用微量移液器吸取菌悬液100 μL,无菌条件下,涂布普通营养琼脂平板,置于37℃恒温培养箱培养24 h;无菌挑取涂布平板上的单菌落,在普通营养琼脂平板上分区划线,进行纯化,以获得纯化菌种。
2.3 菌株的形态学观察
2.3.1 菌落特征的观察
取纯培养物,划线接种在普通营养培养基上,置于37℃恒温箱中培养24 h,观察菌落形态。
2.3.2 革兰氏染色
取干净的载玻片进行抹片,干燥、固定;滴加结晶紫溶液,染色1 min,水洗;滴加碘液1 min,水洗;滴加脱色溶液,脱色30 s,水洗;滴加复染溶液,复染30 s,水洗;用干净的吸水纸吸干,置于油镜下观察。
2.3.3 芽孢染色
取干净的载玻片抹片,干燥固定后,滴加5%孔雀绿染液,加热,产生蒸汽4次,水洗;以复染溶液复染30 s,水洗,吸干,置于显微镜下观察。
2.4 细菌的生化试验
根据芽孢杆菌的形态学、生理生化指标等特点,对分离到的芽孢杆菌进行枸橼酸盐利用试验、糖醇苷发酵试验、维培二氏(VP)试验、甲基红(MR)试验、明胶液化试验等[6]。
2.4.1 枸橼酸盐利用试验
无菌操作条件下,用灭菌的接种针取待检菌株,将枸橼酸盐试管放平,进行斜面划线后穿刺到培养基内,置于37℃恒温环境下,培养24 h,观察颜色变化,若培养基的颜色由草绿色变为蓝色则为阳性,以“+”表示,反之为阴性,以“-”表示。
2.4.2 糖醇类发酵试验
无菌操作条件下,用灭菌的接种环挑取待检菌株,接种于微量生化反应管的培养基中,置于37℃恒温箱中培养,24 h后观察结果,若培养液由紫色变为黄色,表示糖类发酵产酸,以“+”表示;若管内培养液由紫色变为黄色且反应管内有气泡出现,则表示产酸产气,以“⊕”表示;若颜色未改变,则表示对糖类不发酵,以“-”表示。
2.4.3 七叶苷水解试验
无菌操作条件下,将待检菌接种到七叶苷的微量反应管内的培养基上,置于37℃恒温箱中培养24 h后,观察试验结果,若管内的培养液变黑者为阳性,以“+”表示,反之为阴性,以“-”表示。
2.4.4 维培二氏试验
无菌操作条件下,将待检菌接种到葡萄糖蛋白胨水培养基中,置于37℃恒温箱内,培养48 h后,加入6%α-萘酚酒精溶液和40%氢氧化钾数滴,振荡混合,观察结果,若在5 min内出现粉红色反应则为阳性,以“+”表示;若长时间无反应,且置于37℃培养4 h后,颜色仍不变者为阴性,以“-”表示。
2.4.5 甲基红试验
无菌操作条件下,将待检菌接种于葡萄糖蛋白胨培养基中,置于37℃恒温箱内培养48 h后,加入甲基红指示剂,观察颜色变化,若无颜色变化可继续培养2~3 d再进行试验。若培养液呈红色,则为阳性,以“+”表示;若呈黄色,则为阴性,以“-”表示。
2.4.6 吲哚试验
无菌操作条件下,将待检菌接种到含蛋白胨水的生化反应管内的培养基中,置于37℃环境中培养24 h,然后先加戊醇1滴,沿管壁加入吲哚试剂2滴。培养液表层出现玫瑰红则为阳性,以“+”表示;不变色为阴性,以“-”表示。
2.4.7 明胶液化试验
无菌操作条件下,用接种针取待检菌穿刺接种于明胶约为2/3深度培养基内,置于28℃恒温培养,每天观察结果。明胶被液化则为阳性,以“+”表示;否则为阴性,以“-”表示。
2.4.8 淀粉水解试验
无菌操作条件下,将待检菌接种于含淀粉的营养琼脂培养基中,分区划线,置于37℃培养24 h,形成单菌落后,在菌落处滴加革兰氏碘液,铺满菌落,观察颜色变化。若培养基出现蓝色,菌落周围出现无色透明圈,则能水解淀粉为阳性,以“+”表示;反之为阴性,以“-”表示。
2.4.9 硫化氢试验
无菌操作条件下,用灭菌的接种环取待检菌,接种到微量反应管内的培养基中,置于37℃恒温箱中培养24 h,观察试验现象。培养基变黑则产硫化氢为阳性,以“+”表示;否则为阴性,以“-”表示。
2.4.10 触酶试验
无菌操作条件下,取3%过氧化氢溶液2 mL,加入到干净的小试管中,用细玻璃棒蘸取菌液,插入过氧化氢液面下,观察反应。有气泡产生为阳性,以“+”表示;否则为阴性,以“-”表示。
2.5 16S rRNA的PCR扩增与序列分析
2.5.1 细菌DNA的提取
无菌操作挑取待检单菌落,接种到营养肉汤培养基后,震荡摇匀,过夜培养,取菌悬液3 mL放入离心管中,5 000 rpm离心10 min,弃上清,取沉淀物,加50 mg·mL-1溶菌酶75 μL和TE缓冲液0.5 mL悬浮沉淀,置于40℃的恒温水浴锅中温育0.5 h,然后加20 μg · mL-1蛋白质酶K 5 μL,再加10%SDS 50 μL,混匀,置于37℃温育0.5 h;加5 mol· L-1Nacl 750 μL,混匀,加入等体积的酚/氯仿/异戊醇,混匀,5 000 rpm离心10 min,转上清液至新的离心管,加入等体积的氯仿/异戊醇,混匀,静止10 min,5 000 rpm离心10 min,转上清液至新的离心管;加入2倍体积的无水乙醇沉淀DNA,轻微混匀,室温下沉淀静止30 min,然后7 000 rpm离心10 min;加入70%乙醇1 mL漂洗DNA,混匀,再5 000 rpm离心5 min,弃上清液,37℃恒温箱干燥,30 min后溶于40 μL的TE溶液,保存在-20℃冰箱中备用[6-7]。
2.5.2 PCR扩增
芽孢杆菌的正向引物序列为:5'-AgAgTTT⁃gATCCTggCTCAg-3',反向引物序列为:5'-AAgg AggTgATCC AgCCgCA-3'[8-9]。
PCR 扩增体系(25 μL):Premixed Taq 12.5 μL,正反向引物各加 0.5 μL,DNA 模板 1μL,ddH2O 9.5 μL。PCR扩增程序为:94℃5 min,预变性;94℃30 s,变性,58℃30 s,退火,72℃1 min,延伸,循环30次;72℃7 min,延伸。得到的PCR产物置于4℃保存备用。
制备1.0%的琼脂糖凝胶:称取琼脂糖0.2 g,加入1×TAE的电泳缓冲液20 mL,加热溶解后待琼脂糖凝胶液冷却至65℃,加入6×Gold View 1 μL。待琼脂糖凝胶凝固后,拔出梳子放入加有1×TAE的电泳槽。吸取PCR产物5.0 μL与Loading Buffer 1.0 μL混合,加样于琼脂糖凝胶点样孔中进行电泳,30 min后,取出胶块,置于凝胶成像系统中,拍照,观察结果。
2.5.3 16S rRNA序列测定与分析
将PCR产物(编号命为W)送至北京六合华大基因科技股份有限公司青岛测序部进行测序;测序结果使用DNAStar 7.1软件包中的SeqMan进行序列拼接;采用NCBI的BLAST功能将测得的基因序列与数据库中已收录的芽孢杆菌属16S rRNA的序列进行比对,并使用MegAlian中的Clustal X Method进行同源性比较。
2.6 药敏试验
采用纸片扩散试验法(K-B法),根据抑菌环大小,判断分离到的菌株对18种常见的抗菌药物是否敏感[6]。
无菌条件下,用已灭菌的接种环挑取单菌落,接种于营养肉汤培养基中,置于37℃空气浴振荡器震荡,过夜培养。
微量移液器吸取菌液,每个平板涂布菌液100 μL,滴于普通营养琼脂表面,均匀涂布后,盖好平皿,置于室温干燥5 min,待平皿表面干后,用灭菌的镊子以无菌操作取出含药纸片贴于培养基表面,静止一段时间后放于37℃恒温箱中培养16 h,观察抑菌结果并用游标卡尺量取各药片组的抑菌圈直径大小,运用EXCEL软件计算其平均值,同时根据《抗微生物药物敏感性实验规范》,判断药敏效果[10]。
2.7 动物安全性试验
用分离到的菌悬液对小鼠进行灌喂试验。无菌条件下,挑取单菌落接种到5 mL营养肉汤培养基上,震荡摇匀过夜培养,吸取菌悬液灌喂小鼠0.3 mL·只-1,连续灌喂7 d,设空白组为对照组,每组3只,每天观察试验组与对照组小鼠的生长情况[11]。
2.8 数据分析
药敏试验各组数据采用EXCEL软件进行处理,试验结果以平均值表示,并与药敏判断标准值进行比较,判断药敏性大小。
3 结果与分析
3.1 菌株形态特征及染色结果
试验分离到1株菌株,编号为W。接种在普通营养琼脂平板上,经37℃培养24 h后,菌落白色,不透明,边缘不光滑不规则,大致为圆形,中央呈花状,花状中央半透明;革兰氏染色为蓝紫色,杆菌;芽孢染色菌体呈红色,芽孢呈绿色,芽孢近中生,椭圆形或圆形,初步断定为芽孢杆菌。W菌的形态特征、革兰氏染色和芽孢染色图见图1。分别编号为A、B、C。
3.2 生化鉴定结果
试验分离到的1株芽孢杆菌,通过细菌培养、革兰氏染色、芽孢染色和生化试验,参照《常见细菌系统鉴定手册》,初步鉴定W为枯草芽孢杆菌[12]。菌株生理生化试验结果见表1。
3.3 16S rRNA序列分析
3.3.1 琼脂糖凝胶电泳检测PCR产物的结果
通过凝胶成像系统照相并观察发现,有明显均匀的目的条带且无明显拖尾的现象,W菌株PCR产物的凝胶电脉图谱见图2。

图1 W菌株形态特征、革兰氏染色和芽孢染色图

表1 菌株生理生化试验结果
3.3.2 16S rRNA测序及分析
将该编号为W的序列与数据库中已收录的芽孢杆菌属16S rRNA的序列进行比对,并使用Me⁃gAlian中的Clustal X Method进行同源性比较。结果表明,比对的几个菌株的同源性均为98.2%~99.5%。W与其他菌株核酸序列的同源性比较结果见图3。
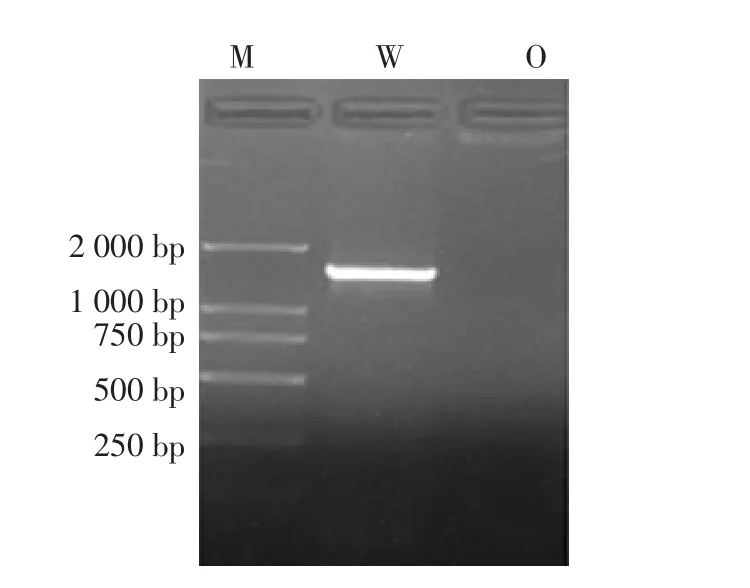
图2 W菌株PCR产物的凝胶电泳图谱
由图3可知,编号为W菌株的核酸序列与Ba⁃cillus subtilis strain CICC 10023(GU980947.1)的同源性达到99.5%,因此,W被鉴定为枯草芽孢杆菌。
3.4 药敏试验结果
根据药敏试验抑菌环直径判断标准对试验结果进行判断。药敏试验结果见表2。

图3 W与其他菌株的核酸序列的同源性比较结果
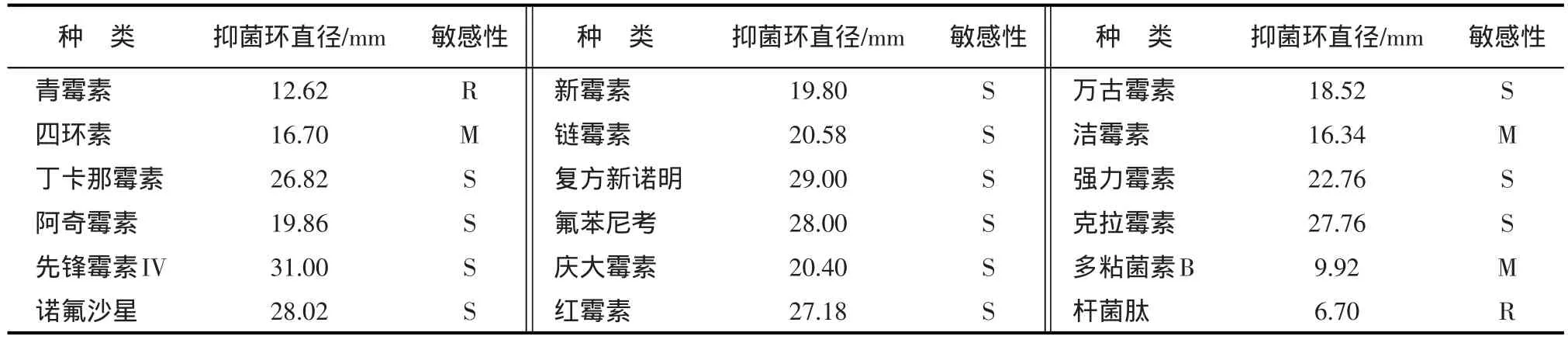
表2 药敏试验结果
通过与标准表对比可知,该菌株对青霉素、杆菌肽耐药,对四环素、洁霉素、多粘菌素B中度敏感,对其他抗菌药物敏感。
3.5 动物安全性试验结果
在连续灌喂7 d内,小鼠采食正常、饮水正常、粪便正常、精神状态良好;剖检后,与对照组相比,试验组的小鼠内脏器官无显著的病理组织学变化。说明本试验分离到的芽孢杆菌对小鼠没有毒性作用,可确定该菌株为无毒菌株。小鼠剖检结果见图4。
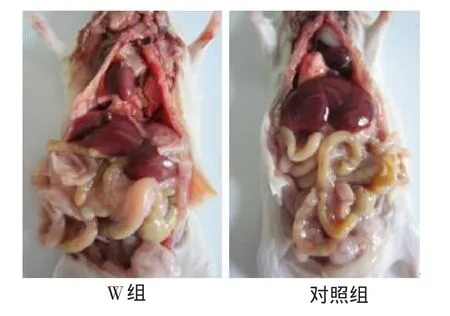
图4 小鼠剖检结果
4 讨 论
4.1 菌株鉴定
传统的鉴定方法是从菌落形状、大小、染色结果等方面判断,通过设计一系列的生化实验,来粗略鉴定,具有耗时长、易干扰、误差大等缺点。而分子生物学鉴定技术从基因水平对本菌株进行鉴定,具有精确、及时、灵敏度高的优点。本试验菌株是从鸡肠道中采样,经过70℃水浴孵育20 min的筛选、细菌的形态学鉴定、生理生化实验和16S rRNA序列分析及同源性比较,结果表明,W菌株与Bacillus subtilis strain CICC 10023(GU980947.1)的同源性达到99.5%,因此确定W菌株为枯草芽孢杆菌。
4.2 药敏试验
药敏试验结果表明,枯草芽孢杆菌对青霉素、杆菌肽耐药,对四环素、洁霉素、多粘菌素B中度敏感,对其他抗菌药物敏感。所以在临床应用时可配合含青霉素、杆菌肽的饲料饲喂患病动物,尽量避免微生态制剂与含对该菌中度敏感和敏感抗菌药物的饲料同时使用,特别注意含敏感抗菌药物饲料的使用,既可提高动物的抵抗力,又可增强微生态制剂与饲料的应用效果。
4.3 对动物安全性
将分离到的悬液对小鼠进灌喂试验结果表明,试验分离到的枯草芽孢杆菌对小鼠没有毒副作用,可确定该菌种对小鼠为无毒菌株,为进一步确定该菌株是否能作为微生态制剂的菌种奠定基础,也为枯草芽孢杆菌在微生态制剂的应用研究提供依据。
5 结论
本试验通过传统鉴定方法和分子生物学鉴定技术,从鸡的肠道中分离鉴定出一株枯草芽孢杆菌,通过药敏试验和动物安全性试验表明,该菌株对青霉素、杆菌肽耐药,对小鼠无致病性,为枯草芽孢杆菌在微生态制剂的研制和临床应用奠定基础。
[1]王冬梅,耿晓娜,赵宝华.饲用微生态制剂的应用研究进展[J].畜牧与饲料科学,2010,31(2):54-56.
[2]郭兴华.益生菌基础与应用[M].北京:北京科学技术出版社,2002.
[3]张董燕,季海峰,徐炜玲.益生菌对动物肠道微生物生态学影响的研究进展[J].中国畜牧兽医,2007,34(3):15-18.
[4]李研东,韩雪,王颖,等.动物微生态制剂的研究进展[J].饲料研究,2008(2):22-24.
[5]陈祈磊,胡又佳.动物微生态制剂研究应用进展[J].中国微生态学杂志,2009,21(9):857-859.
[6]苏波,康建平,黄静,等.16S rDNA序列分析鉴定一株芽孢杆菌[J].食品与发酵科技,2010,46(5):1-3.
[7]韩廷义,刁富花.一株鸡源地衣芽孢杆菌的分离鉴定及其益生作用的初步研究[J].中国畜牧兽医,2012,39(6):189-191.
[8]Shin E C,Choi B R,Lim W J,et al.Phylogenntic analysis of ar⁃chaea in three fractions of cow rumen based on the 16S rDNA Se⁃quence[J].Anaerobe,2004,10(6):313-319.
[9]周宏路,李玉秋,李倬琳,等.一株枯草芽孢杆菌的分离鉴定及其益生潜质分析[J].中国酿造,2010,225(12):137-139.
[10]倪语星,徐英春,孙自镛.抗微生物药物敏感性实验规范(第2版)[M].上海:上海科学技术出版社,2009.
[11]夏芳,罗满林,陈瑞爱.仔猪益生乳酸菌的分离及其抗逆性筛选[J].中国动物保健,2010(2):39-41.
[12]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科技出版社,2001.
