犬瘟热病毒SYBR Green I实时荧光定量PCR检测方法的建立
2014-09-02李菊梅
李菊梅
(青海省大通县桥头镇新城畜牧兽医站, 青海 大通 810100)
犬瘟热病毒SYBR Green I实时荧光定量PCR检测方法的建立
李菊梅
(青海省大通县桥头镇新城畜牧兽医站, 青海 大通 810100)
为建立犬瘟热病毒(CDV)SYBR Green I实时荧光定量PCR检测方法,采用RT-PCR扩增CDV F基因269 bp片段,并克隆入pMD18-T载体中,以纯化的重组质粒为模板作荧光定量PCR扩增,建立了CDV荧光定量PCR检测方法。该方法检测灵敏度可达1.6×101拷贝/μL,与犬细小病毒(CPV)、犬腺病毒(CAV-1)、犬冠状病毒(CCV)、犬副流感病毒(CPIV)均不发生交叉反应,具有很好的特异性和重复性。结果表明:建立的CDV实时荧光定量PCR具有特异、敏感、快速、定量、重复性好等优点,可用于临床犬瘟热(CD)的检测。
犬瘟热病毒;F基因;SYBR Green I;荧光定量PCR
犬瘟热(Canin Disteroper,CD)是由犬瘟热病毒(Canine distemper virus,CDV)引起的犬科、鼬科、灵猫科及部分浣熊科动物的一种急性、亚急性、高度接触性传染病[1],是当前对全世界养犬业、毛皮动物养殖业和野生动物保护业危害最大的疫病之一。CDV是负链单股不分节的RNA病毒,属于副黏病毒科麻、疹病毒属成员。CDV基因组全长15 690 bp,编码6种结构蛋白,分别为核衣壳蛋白(N)、膜蛋白(M)、磷蛋白(P)、融合蛋白(F)、血凝素蛋白(H)、大蛋白(L),其中融合蛋白(F)是CDV的主要的结构蛋白之一,在机体免疫原性与致病性上发挥着重要作用[2]。
快速检测CDV是有效预防CD的前提,目前CD诊断方法有病毒的分离和鉴定[2]、间接免疫荧光 (IFA)[3]、胶体金检测技术(GIA)、酶联免疫吸附试验(ELISA)[4]和RT-PCR[5]等,但上述各种方法均存在一定的缺陷,如GIA不能检测出感染早期及亚临床感染状态下的CDV,ELISA无法鉴别自然感染与疫苗免疫动物,常规RT-PCR易污染、不易标准化,通量较低。随着分子生物学的发展,荧光定量PCR有效克服了上述缺陷,具有重复性好、灵敏度高、定量准确、工作效率高等优点,已应用于多种动物疾病诊断中[6-7]。陈琼等[8]、邵四海等[9]根据GenBank发表的CDV的F基因序列设计合成一对引物,建立了SYBR Green I荧光RT-PCR检测CDV的方法,可以实现对临床发病和疑似发病的犬病料中CDV的定性检测,但并不能检测出犬病料中CDV的含量。本文建立了SYBR Green I实时荧光定量PCR检测犬瘟热病毒的方法,应用于临床样品的检测,并与常规RT-PCR方法作了比较,为犬瘟热病毒的检测提供理论依据。
1 材料与方法
1.1 材 料
1.1.1 毒株、病料和细胞 犬瘟热病毒(CDV)、犬细小病毒(CPV)、犬冠状病毒(CCV)均由青海省果洛州动物疫病预防控制中心实验室保存,腺病毒(CAV-1)、犬副流感病毒(CPIV)购自中国兽医药品监察所。犬瘟热临床疑似病料均采自青海、陕西某宠物医院。
1.1.2 载体、主要试剂及仪器 PCR相关试剂、pMD18-T载体、限制性内切酶、反转录试剂盒、DNA Marker、DNA凝胶回收试剂盒、SYBR Green Ⅰ购自大连宝生物公司;TRIzol试剂购自上海生工生物工程股份有限公司;PCR仪购自BIO-RAD公司,RT-PCR仪购自罗氏公司(LightCycler480型)。
1.2 方 法
1.2.1 RT-PCR引物设计以及合成 参照GenBank发表的登录号为AF378705基因序列,采用Premier 5.0引物设计软件分析,设计1对引物,扩增CDV F基因部分片段,长度为269 bp,269 bp F基因片段在犬瘟热病毒基因组中的位置为5 947 bp-6 215 bp。引物在上海生工生物工程股份有限公司合成。上游引物:5′-GACCCTATTTCAGCCGAG-3′,下游引物:5′-TACCACTCTTGTGATCCT-3′。
1.2.2 病毒RNA的制备 采用上海生工生物工程股份有限公司的Triol试剂提取RNA。取300 μL犬瘟热病毒液加入600 μLTrizo1,振荡1 min,静置5 min,加入200 μL氯仿,混匀后静置5 min,4 ℃12 000 r/min离心10 min;取出上清转移至一个新的离心管中,加入等体积的异丙醇,颠倒混匀,于-20 ℃沉淀20 min,于4 ℃以12 000 r/min离15 min,其沉淀溶于20 μLDEPC处理过的水中。
1.2.3 RT-PCR反应
1.2.3.1 反转录(RT) 20 μL反转录体系中,上游引物1 μL,下游引物1 μL模板7 μL,70 ℃,10 min,冰浴10 min;再加入5×Reverse transcriptase buffer 5 μL;2.5 mmo1/L dNTP 4 μL,Rnase inhibitor 1 μL,AMV反转录酶1 μL,充分混合后离心,42 ℃60 min,70 ℃15 min灭活反转录酶,冰浴2 min,以-20 ℃保存。1.2.3.2 PCR Premix Taq 12.5 μL,上、下游引物各1 μL(15 μmol/L),cDNA 3 μL,加去离子水至25 μL。反应程序为:95 ℃预变性3 min;94 ℃变性30 S,45 ℃退火30 S,72 ℃延伸30 S,30个循环后,72 ℃延伸10 min。2.0%琼脂糖凝胶电泳检测其扩增结果。
1.2.4 重组质粒标准品的制备 PCR产物用凝胶回收试剂盒回收后,与pMD18-T载体连接,连接产物转化感受态细胞DH5α,涂布Amp抗性固体LB琼脂平板,置37 ℃培养箱过夜培养,挑取疑似阳性菌落接种液体LB培养基,摇菌,培养过夜,提取重组质粒,重组质粒经PCR和酶切方法进行鉴定,将初步鉴定正确的阳性重组质粒送上海生工生物工程股份有限公司测序。
用紫外分光光度计测定测序正确的重组质粒(命名为pMD18-F)在260,280 nm处的吸光度,得到重组质粒的浓度和纯度,进行10倍梯度倍比稀释,作为模板,用于荧光定量PCR标准曲线的建立。
1.2.5 荧光定量PCR标准曲线的建立 以已知拷贝的重组质粒(10倍梯度倍比稀释)为模板进行荧光定量PCR,通过预试验对CDV F基因的SYBR Green I荧光定量PCR扩增条件优化,最终确定的最佳反应体系为Premix Taq 12.5 μL,上、下游引物各1 μL(15 μmol/L),cDNA 3 μL,加去离子水至25 μL。最佳反应参数为95 ℃,3 min:94 ℃,30 s;45 ℃,30 s;72 ℃,30 s;共40个循环。采用软件进行分析,得到动力学曲线及标准曲线。
1.2.6 荧光定量PCR的特异性、敏感性和重复性试验 用建立的CDV F基因荧光定量PCR方法对犬细小病毒(CPV)、犬腺病毒(CAV-1)、犬冠状病毒(CCV)、犬副流感病毒(CPIV)核酸提取物进行检测,选取pMD18-F质粒作阳性对照,采用灭菌水作阴性对照。将重组质粒做10倍梯度连续倍比稀释,将稀释物作为模板,采用荧光定量PCR方法扩增,计算荧光定量PCR方法能检出的最少的模板的拷贝,并与常用的RT-PCR方法比较。为评价标准品的稳定性,分别选取同一批次和不同批次的3种不同浓度的重组质粒标准品作为模板,在同一批次和不同批次试验中进行测定,同时增设无模板扩增对照品(NTC)。
1.2.7 临床样品的检测 从青海、陕西多家宠物医院收集CD临床疑似病料35份,用建立的CDV实时荧光定量PCR法进行检测,同时也用常规RT-PCR法检测,对两种方法的检测结果比较分析。
2 结果与分析
2.1 CDV F基因RT-PCR扩增和克隆
提取CDV细胞毒总RNA,作为模板进行反转录,再以反转录产物为模板进行PCR扩增反应,扩增产物2.0%琼脂糖凝胶电泳检测,结果得到269bp的特异性条带(图1)。将F基因的PCR产物纯化回收后,克隆到pMD18-T载体中,构建重组质粒pMD18-F,将扩增的F基因测序结果与GenBank中CDV F基因进行比对,结果显示扩增产物与CDV F基因为100%。
2.2 荧光定量
PCR标准曲线的建立:将标准样品10倍倍比稀释,取为2.7×107、2.7×106、2.7×105、2.7×104、2.7×103、2.7×102、2.7×101拷贝/μL等7种不同浓度重组质粒作为模板做荧光定量PCR扩增反应,得到扩增反应的标准曲线(图2),线性回归方程为Ct=-3.322×lgcopies+12.398(R2=0.9998)。
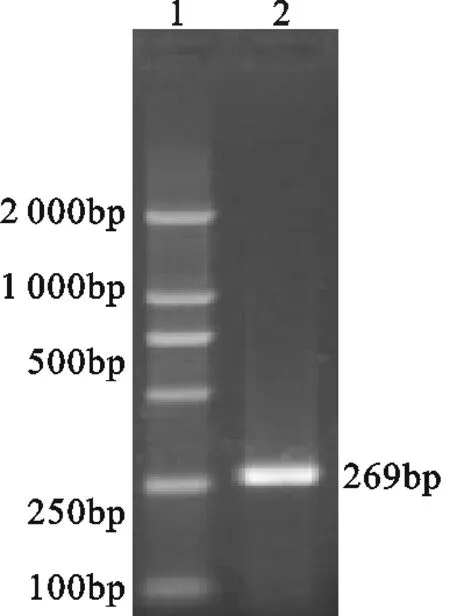
图1 CDVF基因PCR扩增结果1.DNA marker DL 2 000;2.RT-PCR产物Fig.1 PCR result of F gene of CDV1.DNA marker DL 2 000;2.RT-PCR product

浓度的对数 Log Concentration
2.3 溶解曲线分析
在SYBR Green I实时荧光定量PCR结束后对扩增反应熔解曲线分析,结果如图3。扩增产物的溶解温度Tm为87.5~87.9 ℃,没有引物二聚体和非特异性产物等其它峰值出现。
2.4 特异性试验
采用已经建立的CDV F基因SYBR Green I实时荧光定量扩增反应,对CDV、CPV、CAV-1、CCV和CPIV等检测,只有CDV的样品孔出现了单一的s型扩增曲线(图 4),表明建立的CDV的实时荧光定量PCR检测方法具有较强的特异性。
2.5 敏感性试验
将制备的质粒模板10倍倍比稀释,并分别以此为模板进行荧光定量PCR扩增,得到不同浓度的质粒标准模板的real-time PCR扩增曲线,编号1-6所对应的重组质粒模板浓度分别为1.6×105、1.6×104、1.6×103、1.6×102、1.6×101、1.6×100拷贝/μL,结果显示其灵敏度为1.6×101拷贝/μL,与常规PCR结果的对比,荧光定量PCR的灵敏度比常规PCR高100倍。

温度Temperature/℃
2.6 重复性检验
为了验证荧光PCR检测结果的重复性,选取3个标准品,A、B、C测定批内和批间重复性。结果显示,样品的Ct值及Tm值批内和批间重复性试验CV值均小于1.0%,说明该种方法的重复性好(表1、2),阴性对照组(D组)没有检测到荧光信号。
2.7 临床样品检测
采用试验建立的CDV F基因SYBR Green I荧光定量PCR和普通RT-PCR方法,对临床采集的35份疑似CDV样品检测。结果显示:SYBR Green I荧光定量PCR检测到20份阳性样品、15份阴性样品,而普通RT-PCR检测到16份阳性样品、19份阴性样品。表明该方法对于CDV的检测比普通RT-PCR方法灵敏度高,能检测出普通RT-PCR不能检测出的病料。

循环数Cycle number

表1 SYBR GreenⅠ荧光定量PCR的重复性(Ct值)Table 1 Repeatability (Ct value) of SYBR GreenⅠquantitative real time PCR

表2 SYBR GreenⅠ荧光定量RT-PCR的重复性(Tm值)Table 2 Repeatability (Tm value) of SYBR GreenⅠquantitative real time PCR
3 讨 论
陈琼等[8]、邵四海等[9]根据GenBank发表的CDV的F基因序列,设计合成一对引物,建立了SYBR Green I荧光RT-PCR检测CDV的方法,没有建立标准曲线,可以实现对临床发病和疑似发病的犬病料中CDV的定性检测,但并不能检测出犬病料中CDV的含量。黄国君等[10]根据GenBank发表的CDV核衣壳蛋白(NP)基因序列,设计合成一对引物,建立了基于SYBR Green I Real-timeRT-PCR检测CDV核酸,对CDV阳性标准品的检测下限为52拷贝,扩增效率为96.80%。本试验根据CDV F基因部分保守序列设计一对特异性引物,建立了检测CDV的SYBR Green I实时定量PCR方法,该方法只对CDV cDNA有阳性扩增信号,对CPV、CAV-1、CCV、CPIV的基因样品均无特异性反应,表明该方法特异性强,分析熔解曲线得出反应过程中未产生引物二聚体和非特异性扩增,特异性产物的Tm值在理论值1 ℃左右波动,属于正常范围[11]。该方法的表达公式Ct=-3.322×lgcopies+12.398(R2=0.9998),扩增效率为100%,对质粒标准品最低检测限为1.6×101拷贝/μL,比常规PCR敏感性强100倍,批内和批间重复性试验变异系数均小于1.0%,符合统计学规律。可见建立的SYBR Green I实时定量PCR方法的稳定性和重复性较好,且标准曲线良好,具备一定的实用性。
将建立的CDV F荧光定量PCR方法用于临床病料检测,并与常规RT-PCR方法比较,结果表明:4份常规RT-PCR检测呈阴性的病料荧光定量PCR检测为阳性,16份常规RT-PCR检测阳性的病料荧光定量PCR检测仍为阳性,15份常规RT-PCR检测呈阴性的病料荧光定量PCR检测仍为阴性,因此,荧光定量方法对CDV的检出率明显高于常规RT-PCR的检出率,该方法的建立将为CDV冻干苗的抗原准确定量及种毒研究带很大方便,为CD的诊断提供一种快速、可靠的方法,并为大规模的CD分子流行病学调查、疫情监测工作的开展提供技术依据。
[1]Harder T C,Kenter M,Vos H,et a1.Canine distemper virus from diseased large felids:biological properties and phylogenetic relationships[J].J Gen Virol,1996,77(3):397-405.
[2]常国权,杨盛华,刘畅.应用免疫吸附电镜技术检测粪便中犬瘟热病毒[J].中国畜禽传染病,1995(6):42-43.
[3]杨百亮,张娟娟,段县平,等.荧光抗体技术诊断犬癌热的研究[J].中国动物检疫,2004,21(5):23-25.
[4]付少才.检测犬瘟热病毒(CDV)lgG抗体酶联免疫吸附实验方法的建立[J].养犬,2003,4(1):5-6.
[5]修占伍,张颖,胡日新,等.犬瘟热病毒RT-PCR检测方法的建立及应用[J].吉林农业,2011(11):195-195.
[6]郭泗虎 ,王文华 ,张亮权,等.H3亚型猪流感病毒SYBR Green I实时荧光定量PCR检测方法的建立[J].中国预防兽医学报,2012,34(2):124-127.
[7]卢体康,秦智锋,陈兵,等.H7亚型禽流感病毒实时荧光定量RT-PCR检测方法的建立[J].动物医学进展,2012,33(3):9 -13.
[8]陈 琼,邵四海,孔繁德,等.荧光定量RT-PCR检测犬瘟热方法的建立和应用[J].经济动物学报,2008,12(1):24-29.
[9]邵四海,孔繁德,吴德峰,等.SYBR Green I荧光RT-PCR检测犬瘟热方法的建立和应用[J].生物技术通报,2008(1):181-183.
[10]黄国君,岳华,杨发龙,等.SYBR Green Ⅰ荧光定量RT-PCR检测犬瘟热病毒方法的建立及应用[J].中国预防兽医学报,2008,30(6):450-454.
[11]Arun K Dhar,Michelle M,Kurt R Klimpel,et a1.Detection and quantification of infectious hypodermal and hematopoietic Fecrosis virus and white spot virus in shrimp using real-time quantitative PCR and SYBR green chemistry[J].J Clini Microbio,2001,8 (1):2836-2845.
Keywords:Canine Distemper Virus;F gene;SYBR Green I;real-time quantitative PCR Assay
DevelopmentofSYBRGreenIReal-timeQuantitativePCRAssayforDetectionofCanineDistemperVirus
LI Ju-mei
(XinchengAnimalHusbandryandVeterinaryStationofQiaotouTown,Datong,Qinghai810100,China)
To develop the SYBR Green I real-time quantitative PCR assay for detection of F gene of Canine Distemper Virus(CDV),a 269bp conservative region from CDV F gene was amplified by RT-PCR and cloned into pMD18-T vector to construct recombinant plasmid of pMD18-VP60,which served as a template to establish the standard curve of the SYBR Green I rea1time PCR.The results showed that the SYBR Green I real-time PCR was specifically detected by CDV with a limited detection of 1.6×101copy/μL and no amplification for Canine parvovirus,hepatitis infectiosa canis virus,Canine coronavirus and Canine was detected and a good specificity and repeatability was observed.There data suggested that the SYBR Green I real-time PCR which has the merits of specificity,sensitivity,rapidity,fixed quantity and good repeatability could be applied to clinical diagnosis and epidemiological investigation for CDV.
2013-07-04;
2013-09-08
李菊梅(1981-),女,青海乐都人,助理兽医师,研究方向:临床兽医。E-mail: lijumei1981@126.com
S811.6
A
1005-5228(2014)02-0058-05
