转Bt基因抗虫作物对鳞翅目非靶标昆虫生态影响的研究进展
2014-08-30李云河曹凤勤程立生彭于发
杨 艳, 李云河, 曹凤勤, 程立生, 彭于发
1中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193; 2海南大学环境与植物保护学院,海南 海口 570228; 3琼台师范高等专科学校,海南 海口 571127
转基因植物主要利用基因工程技术将其他生物如苏云金杆菌(Bacillusthuringiensis,Bt)的遗传物质转入靶标植物的基因组中,使其获得新的性状(如抗虫等),或者将植物基因组中的不良基因敲除,得到品质更好的植物新品系。自世界上第1例转基因植物——烟草于1983年问世以来,转基因植物的研究和应用得到了迅猛的发展。1996年,转基因作物在美国开始商业化种植,随后越来越多的国家开始种植转基因作物,2013年,全球种植转基因作物的国家为27个,种植面积达到1.75亿hm2。我国于1997年开始商业化种植转基因Bt棉花,到2013年我国转基因棉花的种植面积达到420万hm2,占我国棉花总种植面积的90%;2006年开始商业化种植转基因抗病番木瓜,目前,转基因番木瓜只在我国广东和海南2个省份种植,2013年总种植面积达58万hm2(James,2014)。
转基因作物的广泛种植带给人类巨大的经济和环境效益,如抗病虫转基因作物的种植,有效减少了广谱化学农药的施用,增加了农民收入,改善了生态环境,提高了农产品质量等(Brookes & Barfoot,2013)。同时,转基因作物的应用为解决粮食短缺和能源匮乏等问题带来了曙光(胡笑形,2012)。然而,转基因作物的应用也可能给人类和环境带来潜在的风险(Yuetal.,2011)。因此,伴随着转基因生物的产生,其安全问题一直备受关注,争论持续不断。为有效预防和控制转基因作物可能带来的安全风险,在任何转基因作物商业化应用前,都必须通过严格的安全性评价(EFSA,2010; Lietal.,2014)。
在转基因植物环境风险评价中,转基因抗虫作物对非靶标有益节肢动物(如经济昆虫、天敌昆虫和观赏昆虫等)的潜在影响一直是科学界关注的一个焦点问题。目前,国际上已制定了相对完善的评价程序和方法,可以对转基因作物进行系统、科学的环境安全风险评估(王园园等,2011; Lietal.,2014; Romeisetal.,2008a、2012);在转基因抗虫作物如Bt棉花、玉米和水稻对非靶标生物影响评价方面积累了大量的数据(Chenetal.,2011; Romeisetal.,2006、2008b)。目前种植的转基因抗虫作物主要表达对鳞翅目昆虫具有杀虫活性的Cry1和Cry2类蛋白,因此,评价其对鳞翅目蝶类和蚕类等非靶标节肢动物的潜在影响是当前转基因抗虫作物环境安全评价的一个重要方面(Yuetal.,2011)。本文在归纳总结国内外相关研究进展的基础上,系统分析当前种植的转基因抗虫作物对鳞翅目非靶标蝶类和蚕类昆虫的潜在影响,以期为相关科研工作者及我国转基因植物的安全应用和管理提供参考。
1 非靶标指示性物种的选择
由于农田有益节肢动物种类繁多,不可能对每个物种逐一评价,需要选择合适的、具有代表性的节肢动物物种作为指示生物进行评价(李云河和吴孔明,2013; 王园园等,2011; EFSA,2010; Romeisetal.,2008a、2013)。一般情况下,选择指示性生物应遵循4个标准(李云河和吴孔明,2013; Romeisetal.,2008a、2013)。(1)在作物田中发挥重要生态功能的节肢动物种,如捕食性天敌草蛉和瓢虫等。(2)在转基因抗虫作物田,较容易暴露于外源杀虫化合物,最有可能受到影响的节肢动物种。由于当前的转基因作物表达的外源杀虫蛋白全部为胃毒性杀虫化合物,只有那些有机会取食到(暴露于)转基因杀虫蛋白的物种才有可能受到负面影响。(3)与转基因抗虫植物靶标昆虫亲缘关系较近,最有可能对植物所表达杀虫蛋白敏感的节肢动物种,如当评价以鳞翅目害虫为靶标的转基因抗虫作物环境风险时,应该将鳞翅目非靶标昆虫作为重点评价对象。(4)在试验操作上具有便利性和可行性。一般来说,易于在实验室饲养、易于在试验中处理和观察的非靶标节肢动物应优先选择为指示性物种。
当前,全世界种植的转基因抗虫作物可分为2类:(1)表达一种或多种cry1、cry2类和vips类基因的转基因作物,以鳞翅目害虫为靶标;(2)表达cry3类基因的转基因作物,以鞘翅目害虫为靶标(Yuetal.,2011)。蝶类和蚕类均属于鳞翅目昆虫,其幼虫对转基因抗虫作物表达的杀虫蛋白可能具有一定的敏感性。蝶类作为重要的传粉昆虫,大多具有美学观赏价值,其中部分蝶类昆虫被鉴定为稀有濒危的生物物种;而蚕类则为重要的经济昆虫。蝶类和蚕类幼虫分别喜食马利筋草AsclepiascurassavicaL.和桑树MorusalbaL.叶片,如果其取食的叶片上飘落有转基因抗虫作物的花粉,2种昆虫就会受到杀虫蛋白的威胁。因此,转基因抗虫作物对蝶类和蚕类昆虫的潜在影响备受关注,一度成为转基因抗虫作物环境风险的研究热点(Chenetal.,2011; Hellmichetal.,2001、2008; Loseyetal.,1999; Stanley-Hornetal.,2001)。
2 转基因抗虫作物对蝶类昆虫的影响
2.1 风险评价的一般原理
风险由危险和产生这种危险的可能性组成。风险评估就是鉴定“危险”是否存在和“危险”发生可能性的过程。评价转基因抗虫作物对非靶标生物的潜在影响,不但要鉴定其所表达的外源杀虫蛋白对受试生物的毒性(toxicity),而且要明确受试昆虫暴露(exposure)于杀虫化合物的途径和程度,然后根据2个方面的研究数据综合分析转基因抗虫作物对受试生物的影响。只注重毒性评价,而忽视暴露水平的鉴定将可能导致错误的研究结论。例如,Loseyetal.(1999)指出,帝王斑蝶DanausplexippusL.取食人工撒在马利筋草叶片上的转cry1Ab基因玉米花粉后,其幼虫的存活率显著下降。该报道引起了公众的广泛关注,美国国家环境保护局和美国农业部及时组织了相关科学家开展了为期2年的深入研究。结果表明:虽然帝王斑蝶幼虫对转Bt玉米表达的Cry1Ab蛋白敏感,但在田间自然条件下,其幼虫暴露于Bt蛋白的剂量十分低,远未达到影响帝王斑蝶种群密度的程度。因此,该转基因抗虫玉米对美国帝王斑蝶的种群密度不会造成显著的负面影响(Hellmichetal.,2008)。
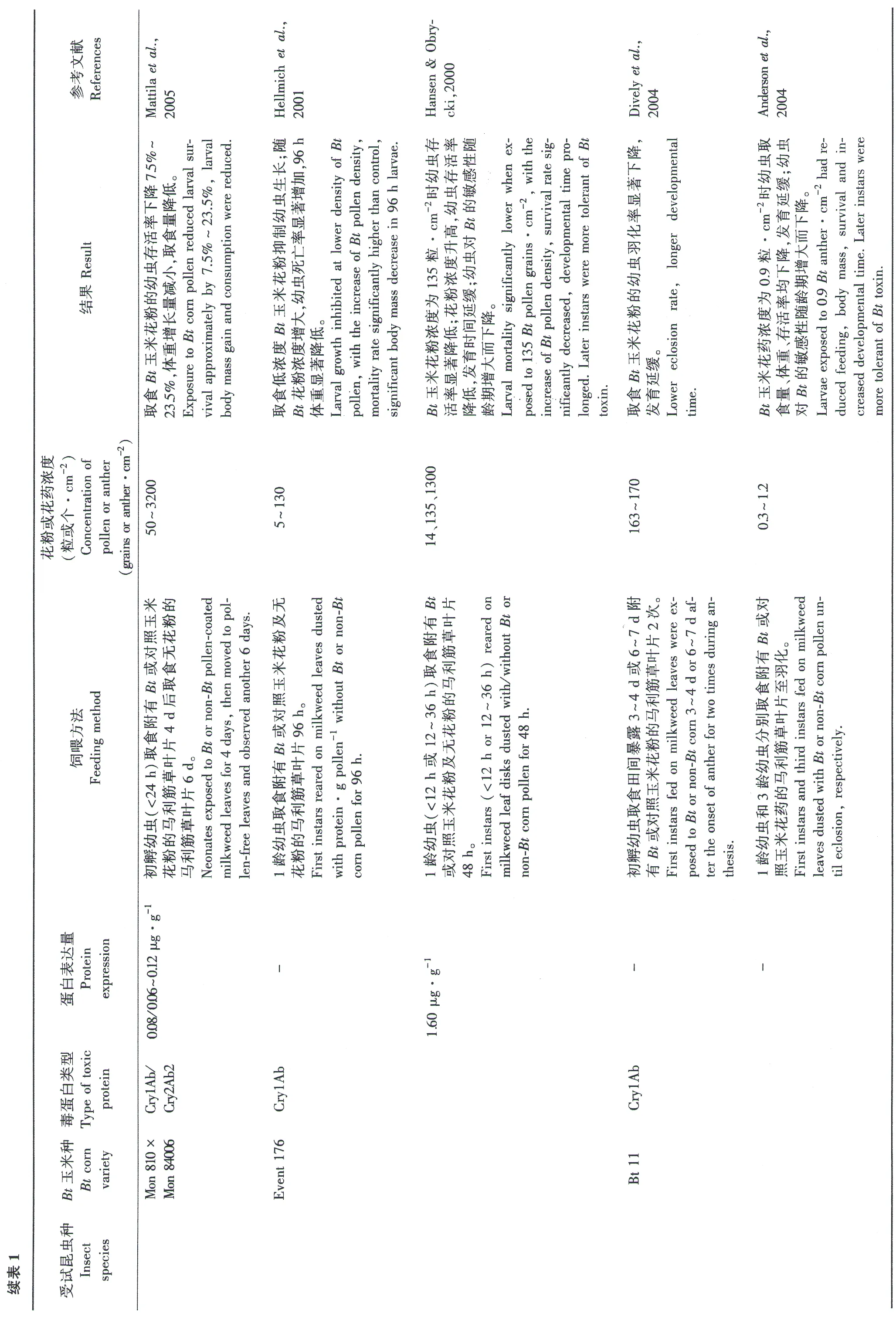
除美国帝王斑蝶,其他蝶类昆虫也引起了相关研究者的关注,如北美黑凤蝶PapiliopolyxenesFabr.、欧洲粉蝶PierisbrassicaeL.、孔雀蛱蝶InachisioL.、蓝灰蝶PseudozizeeriamahaKollar、金凤蝶PapiliomachaonL.和荨麻蛱蝶AglaisurticaeL.等。研究工作主要集中在2个方面:(1)实验室条件下评价取食不同剂量Bt作物花粉或纯Bt杀虫蛋白对蝶类昆虫生长发育的影响(表1);(2)田间调查不同蝶类昆虫暴露于Bt杀虫蛋白的途径和程度。
2.2 毒性评价
大量的研究数据显示,由于蝶类昆虫属鳞翅目,对以鳞翅目害虫为靶标的转Bt基因作物表达的Cry1Ab等杀虫蛋白同样敏感。因此,表达这类Bt蛋白的转基因作物花粉可能对蝶类昆虫幼虫的存活率和生长发育具有负面影响,然而不同蝶类昆虫对同一Bt蛋白的敏感程度存在差异(表1)。例如,帝王斑蝶初孵幼虫取食附有转基因玉米Event 176花粉(表达Cry1Ab蛋白)的马利筋草48 h,即使花粉浓度仅为5~10粒·cm-2,生长发育也会受到抑制,且死亡率随着花粉浓度的升高而增大,体质量显著降低(Hasen & Obrycki,2000; Hellmichetal.,2001)。同样,取食附有转基因玉米Event 176花粉的叶片对北美黑凤蝶、欧洲粉蝶、孔雀蛱蝶、蓝灰蝶和金凤蝶幼虫的生长发育均产生不利影响,且随着花粉浓度的增大,幼虫体质量和存活率均显著降低(Felkeetal.,2002、2010; Lang & Vojtech,2006;
Shirai & Takahashi,2005; Wraightetal.,2000; Zangerletal.,2001)。由于转基因玉米Event 176花粉对多数蝶类昆虫幼虫表现出较高的毒性,该转基因品种已不再商业化种植(Flipse & Dsseweijer,2013; Meissle,2013)。但是,同样表达Cry1Ab蛋白的转基因玉米Mon 810及Bt 11的花粉对蝶类昆虫的影响较低。例如,帝王斑蝶幼虫取食附有高浓度转基因玉米Mon 810花粉(601~1000粒·cm-2)的马利筋草叶片后,生长发育未受负面影响,体质量反而增长。取食附有转基因玉米Bt 11花粉(浓度大于1600粒·cm-2)的马利筋草叶片,与取食非转基因玉米花粉相比,帝王斑蝶幼虫生长发育无显著差异(Hellmichetal.,2001)。其他蝶类昆虫如北美黑凤蝶取食附有高浓度(10000粒·cm-2)转基因玉米Mon 810花粉的叶片后,各项生理指标均未受到显著不良影响(Wraightetal.,2000)。虽然有一些研究表明,取食转基因玉米Mon 810和Bt 11花粉或/和花药对帝王斑蝶生命参数产生了一定的影响,如取食量下降、羽化率下降、发育迟缓等,但影响程度明显低于转基因玉米Event 176花粉(Andersonetal.,2004、2005; Divelyetal.,2004; Mülleretal.,2012; Prasifkaetal.,2007)。
不同转基因玉米花粉对蝶类昆虫的影响程度不同,主要是由于Cry1Ab蛋白在不同转基因玉米花粉中的表达量存在差异,如Cry1Ab蛋白在Event 176玉米花粉中的表达量为90.5 ng·g-1~29.3 μg·g-1(Lang & Vojtech,2006; Shirai & Takahashi,2005; Wraightetal.,2000),而在Bt 11和Mon 810玉米花粉中的表达量仅为2.1 ng·g-1~0.9 μg·g-1(EPA,1999; Hansen & Obrycki,2000; Hellmichetal.,2001; Mülleretal.,2012; Wraightetal.,2000)。相关研究表明,蝶类昆虫对Bt蛋白的敏感性随着龄期的增大而降低,如帝王斑蝶幼虫取食附有相同浓度Bt玉米花药的马利筋草叶片,初孵幼虫死亡率显著高于3龄幼虫(Andersonetal.,2004; Hansen & Obrycki,2000)。除了研究表达Cry1Ab蛋白的转基因玉米花粉外,还涉及表达Cry1Ac、Cry1F和Cry9C蛋白的转基因玉米花粉。总体来说,帝王斑蝶对Cry1Ab和Cry1Ac蛋白较为敏感,但对Cry1F和Cry9C蛋白不太敏感(Hellmichetal.,2001)。



2.3 暴露评价
研究者一般通过调查田间Bt玉米花粉飘落在蝶类昆虫寄主植物叶片的情况,分析不同蝶类昆虫暴露于Bt杀虫蛋白的途径和程度。研究表明,玉米花粉能飘落至距离玉米田60 m外的地方(Raynoretal.,1972),但花粉大多沉积在距离田边3 m的范围内。据报道,花粉在田间马利筋草叶片上的平均沉积量为0~217粒·cm-2,叶片上花粉沉积量超过300粒·cm-2的概率较低(Hansen & Obrycki,2000; Jesse & Obrycki,2003; Kochetal.,2003; Shirai & Takahashi,2005)。尽管Pleasantsetal.(2001)发现玉米田间马利筋草叶片上的玉米花粉最高沉积量达1449粒·cm-2,但这是特例,其平均沉积量仅170.6粒·cm-2。Hansen & Obrycki(2000)报道,田间转基因玉米Event 176花粉在田间马利筋草叶片上的沉积量平均为217粒·cm-2,而田间Bt 11花粉在马利筋草叶片上的平均沉积量则为74.2粒·cm-2。关于上述差异的原因需要进一步研究。也有研究发现,与玉米植株相同距离的不同植物叶片上的玉米花粉密度不同,这可能与植物的高度、叶面的性质等因素有关(Gathmannetal.,2006; Zangerletal.,2001)。总之,由于玉米花粉粒相对较重,其漂移距离有限,随着与玉米植株距离的增大,花粉飘落量将显著减少,如距离玉米田边0.5 m的欧洲防风草PastinacasativaL.叶片上飘落的玉米花粉平均密度为210粒·cm-2,而距离田边7 m处花粉密度迅速降低19倍,仅为11粒·cm-2(Wraightetal.,2000)。
综上所述,转基因Bt玉米的种植是否会给蝶类昆虫带来显著的负面影响,不仅取决于蝶类昆虫对花粉中表达的Bt蛋白的敏感性,而且取决于自然条件下这些昆虫取食的Bt玉米花粉量。从2个方面的研究数据分析,目前国际上的普遍共识是:虽然一些蝶类昆虫对抗鳞翅目转基因玉米花粉中的Cry1Ab、Cry1Ac等杀虫蛋白敏感,但在自然条件下,其暴露于Cry杀虫蛋白的水平很低,因此,转基因抗虫玉米的种植不会显著影响田间蝶类昆虫的种群密度。但是,为进一步确保转基因Bt玉米对蝶类昆虫的安全性,目前推荐种植的抗鳞翅目害虫转基因玉米品种花粉中不表达外源杀虫蛋白或表达量较低。
3 转基因抗虫作物对蚕类昆虫的影响
我国是世界蚕业的起源地(胡龙成,2000),栽桑养蚕、制丝织绸一直是我国的历史传统(方旭东等,2011)。我国除西藏、青海外,其他各省(市、自治区)均有蚕桑生产,其中以浙江、江苏和四川等地为主产省,而上述养蚕主产区均为我国重要水稻产区,并且桑稻间种的种植模式在这些地区比较流行(蒋彩英,2004; 王忠华等,2001)。因此,转基因抗虫水稻如Bt水稻在我国一旦商业化应用,其花粉将可能飘落到稻田附近的桑叶上,进而对蚕类昆虫产生影响。樊龙江等(2003)报道,稻田附近的桑叶上水稻花粉的沉积量为13.3~199.0粒·cm-2,平均沉积量为93粒·cm-2;Yaoetal.(2006)报道,稻田附近的桑叶上水稻花粉沉积浓度最高可达1635.9粒·cm-2,但发生概率仅为0.2%。所以,家蚕通过取食附有转Bt基因水稻花粉的桑叶而取食到Bt杀虫蛋白的可能性很高。另外,目前培育的转基因抗虫水稻大多数以鳞翅目害虫为靶标,而家蚕同属鳞翅目,其可能对转基因抗虫水稻表达的Bt蛋白也敏感(Yuetal.,2011; Romeisetal.,2008a、2013)。因此,在转基因抗虫水稻环境安全评价工作中,其对蚕类昆虫的潜在影响受到广泛关注(表2)。
评价转基因抗虫水稻对家蚕的潜在影响,主要通过室内生物测定比较家蚕取食Bt水稻花粉与非转基因水稻花粉后,生存率、发育历期、体质量等生命参数的差异(表2)。许多结果表明,取食表达同类Bt蛋白的不同转基因水稻花粉对家蚕的影响差异显著,这主要由Bt蛋白在不同水稻品种花粉中的含量不同所致。例如,转基因水稻KMD1和B1花粉中的Cry1Ab蛋白浓度是TT9-3花粉的3倍以上,从而造成KMD1和B1花粉对家蚕幼虫的毒性显著高于TT9-3(Yaoetal., 2008)。家蚕幼虫对Bt水稻花粉的敏感程度随龄期的增长而逐渐下降(表2)(袁志东等,2006; Yaoetal.,2008)。此外,不同品种家蚕对同种Bt水稻花粉敏感程度不同,其中以菁松幼虫对Cry1Ab蛋白最为敏感(袁志东等,2006a、2006b)。短期取食较低浓度的Bt水稻花粉对家蚕幼虫不会产生显著的负面影响(王忠华等,2001; Yangetal.,2014);但是,家蚕整个幼虫期取食表达cry1C和cry2A基因的水稻花粉后,发育延缓,且14 d体质量、羽化率均显著下降(Yangetal.,2014)。然而,田间调查表明,大田桑叶上沉积的花粉量非常有限,显著低于对家蚕有负面影响的剂量。因此,种植当前培育的转基因抗虫水稻对我国的蚕丝产业造成负面影响的可能性较小(Chenetal.,2011; Kimetal.,2008; Lietal.,2005; Yangetal.,2014; Yaoetal.,2008)。但是,为确保转基因水稻对环境的安全性,在未来转Bt基因水稻培育中,应尽量降低Bt蛋白在花粉中的表达量。
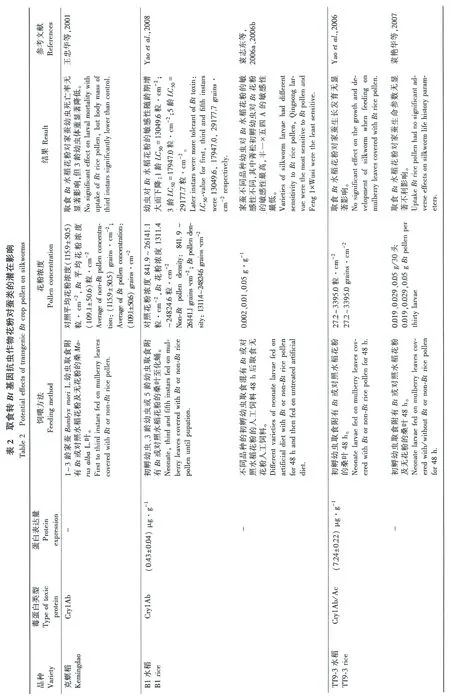
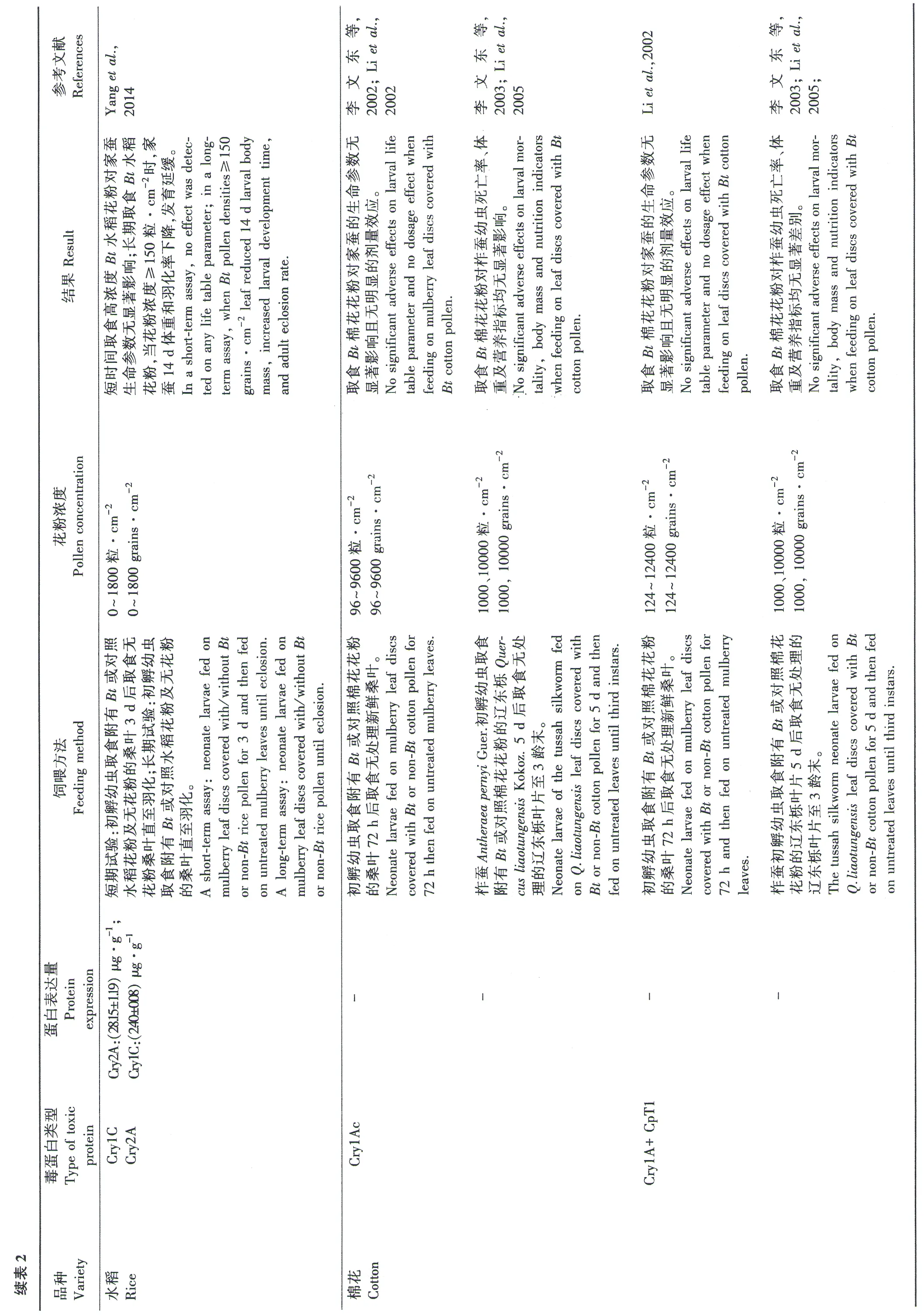

此外,在其他转基因抗虫作物如Bt棉花和玉米环境安全评价中,蚕类昆虫也受到许多研究者的关注(表2)。研究发现,取食Bt抗虫棉(转Cry1Ac或Cry1A+CpTI)花粉对家蚕或柞蚕的生长发育没有显著的负面影响,这可能是因为棉花花粉中的Bt蛋白含量远低于转Bt水稻花粉(李文东等,2002、2003; Lietal.,2002、2005)。Niuetal.(2013)也报道,长期取食表达Cry1Ac或Cry1Ac/Cry2Ab蛋白的棉花花粉对家蚕的生存率和体质量均无显著影响。此外,Lietal.(2002)报道,家蚕幼虫取食表达Cry1Ab蛋白的MON 810玉米花粉,即使取食较高花粉剂量,其生长发育均未受到显著负面影响,这可能也是因为Cry1Ab蛋白在MON 810玉米花粉中的含量极低(表1)。
4 结语
基因重组技术作为21世纪最有价值的生物技术,必将带来一场农业“绿色革命”。我国耕地资源相对贫乏,农业发展受到诸多因素的制约,采用转基因技术提高我国农业生产效率显得尤其重要。但是,基因重组技术的应用也可能对环境和人类健康带来潜在的风险,因此,加强转基因生物安全评价与管理是保障生物育种技术持续健康发展的基础。在转基因抗虫作物环境安全评价中,其对非靶标节肢动物的潜在影响是一项重要的评价内容。国内外大量研究结果表明,转Bt基因抗虫作物专一性强,仅对靶标害虫及与其亲缘关系十分近的非靶标昆虫具有毒杀作用(Romeisetal.,2008a)。但由于这类非靶标昆虫在自然条件下暴露于Cry杀虫蛋白的水平很低,抗鳞翅目害虫转基因作物的种植不可能显著影响田间蝶类昆虫的种群密度,也不会对蚕丝产业带来负面影响。
虽然大量的试验数据证实了当前培育的转Bt基因作物的安全性,但由于公众对转基因作物及其风险的认知不足,对转基因作物及其产品的安全性过于担忧,导致转基因作物的产业化步伐缓慢,这将严重影响这一新兴技术的发展。因此,我国相关科学家及政府部门应该在生物技术科普教育中发挥更积极的作用,使民众对转基因作物及其安全性有更全面和理性的认识,为我国生物技术健康发展和应用营造良好有序的环境。
樊龙江, 吴月友, 庞洪泉, 吴建国, 舒庆尧, 徐孟奎, 陆剑飞. 2003. 转基因Bt水稻花粉在桑叶上的自然飘落浓度. 生态学报, 23(4): 826-833.
方旭东, 张建华, 许冠钧. 2011. 论蚕桑产业发展趋势及对策. 科技和产业, (5): 4-9.
胡龙成. 2000. 一身是宝说家蚕. 绿化与生活, 11(5): 33-34.
胡笑形. 2012. 转基因作物与农药的关系和作用. 精细与专用化学品, 20(4): 1-10.
蒋彩英. 2004.Bt水稻花粉对家蚕安全性评价及对家蚕安全的Bt菌株生物学的研究. 杭州: 浙江大学.
李文东, 吴孔明, 王小奇, 郭予元. 2003. 转Cry1Ac和Cry1A+CpTI基因棉花粉对柞蚕生长发育影响的评价. 农业生物技术学报, 11(5): 488-493.
李文东, 叶恭银, 吴孔明, 王小奇, 郭予元. 2002. 转抗虫基因棉花和玉米花粉对家蚕生长发育影响的评价. 中国农业科学, 35(11): 1543-1549.
李云河, 吴孔明. 2013. 转基因作物商业化种植的生态效应∥李文华,等. 中国当代生态学研究: 可持续发展生态学. 北京: 科学出版社, 197-214.
王园园, 李云河, 陈秀萍, 武红巾, 彭于发. 2011. 抗虫转基因植物对非靶标节肢动物生态影响的研究进展. 生物安全学报, 20(2): 100-107.
王忠华, 倪新强, 徐孟奎, 舒庆尧, 夏英武. 2001.Bt水稻“克螟稻”花粉对家蚕生长发育的影响. 遗传, 23(5): 463-466.
袁艳华, 杨妮娜, 胡华伟, 董兆克, 张国安. 2007. 转Bt-cry1Ab/Ac水稻花粉对家蚕生长发育及体内酶活性的影响∥植物保护与现代农业——中国植物保护学会2007年学术年会论文集. 北京: 中国植物保护学会, 1.
袁志东. 2006a.Bt水稻花粉对家蚕不同品种的毒力测定和生物学影响研究. 杭州: 浙江大学.
袁志东, 姚洪渭, 叶恭银, 胡萃. 2006b. 转Bt基因水稻花粉对家蚕不同品种幼虫的生存分析. 蚕桑通报, 37(3): 23-27.
Anderson P L, Hellmich R L, Prasifka J R and Lewis L C. 2005. Effects on fitness and behavior of monarch butterfly larvae exposed to a combination ofCry1Ab-expressing corn anthers and pollen.EnvironmentalEntomology, 34: 944-952.
Anderson P L, Hellmich R L, Sears M K, Sumerford D V and Lewis L C. 2004. Effects ofCry1Ab-expressing corn anthers on monarch butterfly larvae.EnvironmentalEntomology, 33: 1109-1115.
Brookes G and Barfoot P. 2013. Key environmental impacts of
global genetically modified (GM) crop use 1996-2011.GMCropsandFood:BiotechnologyinAgricultureandtheFoodChain, 4: 109-119.
Chen M, Shelton A and Ye G Y. 2011. Insect-resistant genetically modified rice in China: from research to commercialization.AnnualReviewofEntomology, 56: 81-101.
Dively G P, Rose R, Sears M K, Hellmich R L, Stanley-Horn D E, Calvin D D, Russo J M and Anderson P L. 2004. Effects on monarch butterfly larvae (Lepidoptera: Danaidae) after continuous exposure to Cry1Ab-expressing corn during anthesis.EnvironmentalEntomology, 33: 1116-1125.
EPA. 1999. Biopesticide fact sheet:BacillusthuringiensisCryIA(b)Delta-endotoxinandtheGeneticMaterialNecessaryforItsProductioninCorn. http:∥www.epa. gov/pesticides/biopesticides /factsheets/ fs006430t.htm.
EFSA. 2010. Guidance on the environmental risk assessment of genetically modified plants.TheEFSAJournal, 8: 1879.
Felke M, Lorenz N and Langenbruch G A. 2002. Laboratory studies on the effects of pollen fromBt-maize on larvae of some butterfly species.JournalofAppliedEntomology, 126: 320-325.
Felke M, Lorenz N, Langenbruch G A, Feiertag S and Kassa A. 2010. Effect ofBt-176 maize pollen on first instar larvae of the Peacock butterfly (Inachisio)(Lepidoptera; Nymphalidae).EnvironmentalBiosafetyResearch, 9: 5-12.
Flipse S M and Osseweijer P. 2013. Media attention to GM food cases: an innovation perspective.PublicUnderstandingofScience, 22: 185-202.
Gathmann A, Wirooks L, Hothorn L A, Bartsch D and Schuphan I. 2006. Impact ofBtmaize pollen (MON810) on lepidopteran larvae living on accompanying weeds.MolecularEcology, 15: 2677-2685.
Hansen L C and Obrycki J J. 2000. Field deposition ofBttransgenic corn pollen: lethal effects on the monarch butterfly.Oecologia, 125: 241- 248.
Hellmich R L, Albajes R, Bergvinson D, Prasifka J R, Wang Z Y and Weiss M J. 2008. The present and future role of insect-resistant genetically modified maize∥Romeis J, Shelton A M and Kennedy G G.IntergationofInsect-resistantGeneticallyModifiedCropswithIPMSystems. Berlin: Springer, 119-158.
Hellmich R L, Siegfried B D, Sears M K, Stanley-Horn D E, Daniels M J, Mattila H R, Spencer T, Bidne K G and Lewis L C. 2001. Monarch larvae sensitivity toBacillusthuringiensis-purified proteins and pollen.ProceedingsoftheNationalAcademyofSciences, 98: 11925-11930.
James C. 2014.GlobalStatusofCommercializedBiotech/GMCropsin2013. Ithaca, NY, USA: International Service for the Acquisition of Agri-biotech Applications (ISAAA).
Jesse L C and Obrycki J J. 2003. Occurrence ofDanausplexippusL. (Lepidoptera: Danaidae) on milkweedsAsclepiassyriacain transgenicBtcorn agroecosystems.Agriculture,EcosystemsandEnvironment, 97: 225-233.
Kim Y H, Kim H, Lee S and Lee S H. 2008. Effects ofBttransgenic Chinese cabbage pollen expressingBacillusthuringiensisCry1Ac toxin on the non-target insectBombyxmori(Lepidoptera: Bombyxidae) larvae.JournalofAsia-PacificEntomology, 11: 107-110.
Koch R L, Hutchison W D and Venette R C. 2003. Survival of monarch butterfly,Danausplexippus(Nymphalidae), larvae on milkweed nearBtcornfields.Journal-lepidopteristsSociety, 57: 92-99.
Lang A and Vojtech E. 2006. The effects of pollen consumption of transgenicBtmaize on the common swallowtail,PapiliomachaonL. (Lepidoptera, Papilionidae).BasicandAppliedEcology, 7: 296-306.
Li Y H, Romeis J, Wu K M and Peng Y F. 2014. Tier-1 assays for assessing the toxicity of insecticidal proteins produced by genetically engineered plants to non-target arthropods.InsectScience, 21: 125-134.
Li W D, Wu K M, Wang X Q, Wang G R and Guo Y Y. 2005. Impact of pollen grains fromBttransgenic corn on the growth and development of Chinese tussah silkworm,Antheraeapernyi(Lepidoptera: Saturniidae).EnvironmentalEntomology, 34: 922-928.
Li W D, Ye G Y, Wu K M, Wang X Q and Guo Y Y. 2002. Evaluation of impact of pollen grains fromBt,Bt/CpTItransgenic cotton andBtcorn plants on the growth and development of the mulberry silkworm,BombyxmoriLinnaeus (Lepidoptera: Bombycidae).AgriculturalSciencesinChina, 1: 1334-1343.
Losey J, Raynor L and Carter M E. 1999. Transgenic pollen harms Monarch larvae.Nature, 399: 214.
Mattila H R, Sears M K and Duan J J. 2005. Response ofDanausplexippusto pollen of two new Bt corn events via laboratory bioassay.EntomologiaExperimentalisetApplicata, 116: 31-41.
Müller A K, Schuppener M and Rauschen S. 2012. Assessing the impact of Cry1Ab expressing corn pollen on larvae ofAglaisurticaein a laboratory bioassay.GMOsinIntegratedPlantProduction, 73: 55-60.
Niu L, Ma Y, Mannakkara A, Zhao Y, Ma W, Lei C and Chen L. 2013. Impact of single and stacked insect-resistantBt-cotton on the honey bee and silkworm.PLoSONE, 8: e72988.
Pleasants J M, Hellmich R L, Dively G P, Sears M K, Stanley-Horn D E, Mattila H R, Foster J E, Clark P and Jones G D. 2001. Corn pollen deposition on milkweeds in and near cornfields.ProceedingsoftheNationalAcademyofSciences, 98: 11919-11924.
Prasifka P L, Hellmich R L, Prasifka J R and Lewis L C. 2007. Effects of Cry1Ab-expressing corn anthers on the movement of monarch butterfly larvae.EnvironmentalEntomology, 36: 228-233.
Raynor G S, Ogden E C and Hayes J V. 1972. Dispersion and deposition of corn pollen from experimental sources.AgronomyJournal, 64: 420-427.
Romeis J,lvarez-Alfageme F and Bigler F. 2012. Putative effects of Cry1Ab to larvae ofAdaliabipunctata—reply to Hilbecketal. (2012).EnvironmentalSciencesEurope, 24: 18.
Romeis J, Bartsch D, Bigler F, Candolfi M, Gielkens M M C, Hartley S E, Hellmich R L, Huesing J E, Jepson P C, Layton R, Quemada H, Raybould A, Rose R I, Schiemann J, Sear M K, Shelton A M, Sweet J, Vaituzis Z and Wolt J D. 2008a. Assessment of risk of insect-resistant transgenic crops to nontarget arthropods.NatureBiotechnology, 26: 203-208.
Romeis J, Shelton A M and Kennedy G G. 2008b.IntegrationofInsectresistantGeneticallyModifiedCropswithinIPMPrograms. Dordrecht, The Netherlands: Springer.
Romeis J, Meissle M and Bigler F. 2006. Transgenic crops expressingBacillusthuringiensistoxins and biological control.NatureBiotechnology, 24: 63-71.
Romeis J, Raybould A, Bigler F, Candolfi M P, Hellmich R L, Huesing J E and Shelton A M. 2013. Deriving criteria to select arthropod species for laboratory tests to assess the ecological risks from cultivating arthropod-resistant genetically engineered crops.Chemosphere, 90: 901- 909.
Shirai Y and Takahashi M. 2005. Effects of transgenicBtcorn pollen on a non-target lycaenid butterfly,Pseudozizeeriamaha.AppliedEntomologyandZoology, 40: 151-159.
Stanley-Horn D E, Dively G P, Hellmich R L, Mattila H R, Sears M K, Rose R, Jesse L C H, Losey J E, Obrycki J J and Lewis L. 2001. Assessing the impact of Cry1Ab-expressing corn pollen on monarch butterfly larvae in field studies.ProceedingsoftheNationalAcademyofSciences, 98: 11931-11936.
Wraight C L, Zangerl A R, Carroll M J and Berenbaum M R. 2000. Absence of toxicity ofBacillusthuringiensispollen to black swallowtails under field conditions.ProceedingsoftheNationalAcademyofSciences, 97: 7700-7703.
Yang Y, Liu Y, Cao F Q, Chen X P, Cheng L S, Romeis J, Li Y H and Peng Y F. 2014. Consumption ofBtrice pollen containing Cry1C or Cry2A protein poses a low to negligible risk to the SilkwormBombyxmori(Lepidoptera: Bombyxidae).PLoSONE, 9: e102302.
Yao H, Ye G, Jiang C, Fan L, Datta K, Hu C and Datta S K. 2006. Effect of the pollen of transgenic rice line, TT9-3 with a fusedcry1Ab/cry1Acgene fromBacillusthuringiensisBerliner on non-target domestic silkworm,BombyxmoriLinnaeus (Lepidoptera: Bombyxidae).AppliedEntomologyandZoology, 41: 339-348.
Yao H W, Jiang C Y, Ye G Y, Hu C and Peng Y F. 2008. Toxicological assessment of pollen from differentBtrice lines onBombyxmori(Lepidoptera: Bombyxidae).EnvironmentalEntomology, 37: 825-837.
Yu H L, Li Y H and Wu K M. 2011. Risk assessment and ecological effects of transgenicBacillusthuringiensiscrops on non-target organisms.JournalofIntegrativePlantBiology, 53: 520-538.
Zangerl A R, McKenna D, Wraight C L, Carroll M, Ficarello P, Warner R and Berenbaum M R. 2001. Effects of exposure to event 176Bacillusthuringiensiscorn pollen on monarch and black swallowtail caterpillars under field conditions.ProceedingsoftheNationalAcademyofSciences, 98: 11908-11912.
