转基因逃逸及其环境生物安全评价研究进展
——抗虫水稻案例分析
2014-08-30卢宝荣
卢宝荣
1复旦大学生命科学学院生物多样性与生态工程教育部重点实验室,上海 200433;2南昌大学生命科学研究院,流域生态学研究所,江西 南昌 330031
生物技术的创造发明在提高农业生产力和改善人类健康等方面起到了重要作用(Cooper,2008)。以转基因生物技术为例,其在农业生产中的应用大大提高了生产效率,改善了农作物的品质,并增强了农作物品种抵御生物胁迫(如病、虫害)和非生物胁迫(如干旱和盐碱)的能力,对全球粮食安全和农业可持续生产均具有重要意义。因此,自1996年世界第1例转基因西红柿被批准进入商品化生产以来,在短短不到20年的时间内,转基因农作物在全世界的种植面积已经飙升到约1.75亿hm2(James,2014)。其中,发展中国家的转基因作物种植面积高于发达国家,达到近0.93亿hm2(James,2014)。
然而,与其他任何一个新技术的产生和应用一样,转基因生物技术在带来巨大的经济和社会利益的同时,也为人们带来了一些潜在的生物安全顾虑(卢宝荣,2013; Ellstrand,2003; Lu,2008; Stewartetal.,2000),特别是在一些媒体不适当的宣传下,公众对转基因生物有很大的抵触情绪。但事实上,任何经转基因技术培育的作物产品,在进入商品化生产之前都要经历严格的生物安全评价,并获得安全证书(卢宝荣,2013)。在对转基因作物进行生物安全评价的过程中,不仅涉及其食品安全评价,而且包括其环境安全评价,这些安全评价都是在以科学为基础的原则指导下进行,以科学研究的最新成果建立转基因生物安全评价的框架体系。本文将以转基因水稻OryzasativaL.为案例,介绍和讨论如何对外源转基因逃逸及其潜在环境风险这一全球关注的环境生物安全问题进行科学合理的安全评价。
1 转基因逃逸及其环境风险评价的框架
转基因逃逸是指包含于转基因农作物体内的外源转基因,通过花粉介导的基因漂移(或天然杂交)过程转移到非转基因农作物品种或其野生近缘种群体的现象(Lu,2008)。具有一定自然选择优势的外源转基因,一旦通过基因漂移转移到农作物的野生近缘种(包括杂草类型),则可能在农作物的野生近缘种群体中存留并扩散。如果逃逸的转基因可能导致野生近缘种群体大规模的扩张或萎缩,均可能带来潜在的、非预期的环境和生态影响(Ellstrand,2003; Ellstrandetal.,1999; Lu,2008; Lu & Yang,2009; Snowetal.,2003)。因此,抗虫转基因水稻在进行商品化种植之前,必须接受环境生物安全评价。对于转基因逃逸及其潜在风险的评价有3个关键步骤(图1)。
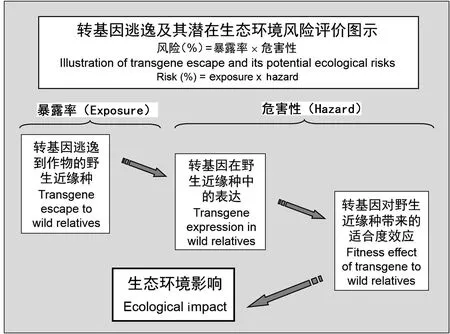
图1 转基因逃逸及其潜在环境风险的安全评价关键步骤Fig.1 The key steps for biosafety assessment of potential environmental impact caused by transgene escape through pollen-mediated gene flow
第一步:分析和检测转基因逃逸的频率(图1)。不同作物品种之间,以及作物品种与其野生近缘种之间的基因漂移频率有较大的变异幅度(Chenetal.,2004; Lu,2008、2013; Messegueretal.,2001; Rongetal.,2007、2010; Sajietal.,2005; Songetal.,2003; Watrudetal.,2004; Wilkinsonetal.,2000)。按照风险评价的模式[风险(%)=危害性 × 暴露率],转基因逃逸的频率(暴露率)越高,可能导致的风险就越高;反之,导致的风险就越低。基因漂移的频率,在很大程度上影响转基因逃逸及其潜在的风险,因此分析和检测作物—作物或作物—野生近缘种基因漂移频率,对转基因逃逸的风险评价非常重要。
第二步:研究和分析外源转基因在野生近缘种中的表达(图1)。经过人工修饰的外源转基因是否可能在作物的野生近缘种中正常表达是评价转基因逃逸及其环境影响的又一关键因素。如果转基因能够以一定的频率逃逸到作物的野生近缘种群体,且在野生近缘种中正常表达,则该转基因将可能由于在野生近缘种群体中产生新的表型性状(如抗虫、抗除草剂)而改变野生近缘种群体的生存竞争能力和适应能力,从而带来不可预测的环境影响(Xiaetal.,2009)。
第三步:研究和检测外源转基因的适合度效应(图1)。分析携带外源转基因的野生近缘种个体和群体的生态适合度和进化潜力是确定转基因逃逸是否会带来生态环境影响的关键(Lu,2008)。适合度是指某一基因型传递给后代的能力,或者是个体产生能生存并对未来世代有贡献能力的指标。通常以该基因型(如具有一定功能的转基因)对生物群体的生存能力和繁殖能力来度量。适合度高表明生物群体的生存能力和繁殖能力强,群体很容易生长、繁殖和扩张;反之,群体的生存能力和繁殖能力较弱,群体则会逐渐减少,甚至可能消亡和灭绝。无论哪一个过程发生,即适合度显著提高或降低,都将直接导致转基因对生态环境的影响。另外,生物群体面积增大或缩小的过程,均反映了群体的动态变化、进化潜力和最终命运。
2 水稻转基因逃逸频率的检测和研究
有关水稻基因漂移的研究大体可以分为3类:(1)栽培稻品种之间,包括转基因水稻与非转基因水稻品种的基因漂移,也被称之为作物—作物(crop-to-crop)的基因漂移;(2)栽培稻向杂草稻O.sativaf.spontanea的基因漂移,被称为作物—杂草种(crop-to-weed)的基因漂移;(3)栽培稻向普通野生稻O.rufipogon群体的基因漂移,被称为作物—野生种(crop-to-wild)的基因漂移。
大量的研究表明,栽培稻品种之间的基因漂移水平很低,在转基因与非转基因水稻近距离(约0.5 m)的条件下,基因漂移的频率远低于1%(Messegueretal.,2001; Rongetal.,2004、2005、2007);如果在转基因水稻与非转基因水稻品种之间设立一定的空间距离(如10 m),便会使转基因漂移到非转基因水稻品种的频率迅速降低至0.01%,甚至0.001%以下(Rongetal.,2007)。这可能是由于栽培稻是典型的自花授粉植物,其异交率水平很低。如此低水平的基因漂移造成的“混杂”所产生的影响几乎可以忽略不计。
有关栽培稻中的基因(包括转基因)向杂草稻的漂移有不少报道。Chenetal.(2004)在受控的试验条件下检测了栽培稻的抗除草剂转基因(bar)向同一试验田中不同杂草稻群体转移的频率。结果表明,即使花期相遇,在一个生长季节中,转基因漂移到杂草稻群体的频率也非常低,观测到的最大值约为0.5%。但转基因漂移可以在多代发生,由于杂草稻的落粒性和自我繁殖的特点,在数代以后,转基因由栽培稻漂移到同一块稻田杂草稻群体的频率可以积累到一个较高的水平,从而带来一定的生物安全问题。Shivrainetal.(2007、2008)在种植抗除草剂水稻品种Clearfield®的稻田中,检测到0.001%的杂草稻具有该抗除草剂的性状。这是由于抗除草剂栽培稻向其伴生杂草稻的基因漂移所致,这给水稻生产中的杂草控制增加了一定的难度(Gressel & Bernal,2009)。
有关栽培稻的基因向野生稻群体的转移频率也有一定的报道。结果表明,栽培稻向野生稻群体的基因漂移频率有很大变异,不同的野生稻群体和不同试验设计下所获得的栽培稻—野生稻基因漂移频率为1%~18%(Songetal.,2003; Wangetal.,2006)。这表明栽培稻向野生稻的基因漂移频率在很大程度上与栽培稻和野生稻之间的空间距离以及不同野生稻群体的异交率有关。对水稻基因漂移模型模拟的最新研究结果表明,基因漂移的频率取决于相关的生物因素(如花粉供体植物的花粉量、花粉受体植物的异交率、花粉供体与受体植物之间的杂交亲和性等)以及非生物因素(如空气湿度、风速、风力等)(Rongetal.,2010)。因此,一旦建立了适当的基因漂移模型,并且通过测量获得了相关的生物和气象参数,就可以对不同环境条件下的转基因逃逸频率进行计算和定量预测。
3 水稻转基因在野生近缘种中表达水平的检测
单从科学层面推测,许多栽培作物与其野生近缘种有着比较近的遗传关系和亲缘关系,特别是作物的野生祖先种,在人类栽培与驯化的过程中,这些作物与其野生祖先种一直保持着一定水平的天然杂交或基因交流,因此来自于栽培作物的基因,通常被认为可以在其野生近缘种中表达。为了验证这一推测,Xiaetal.(2009)利用转Bt抗虫基因水稻与普通野生稻进行人工杂交,获得了含有Bt抗虫基因的栽培稻—野生稻杂种F1,并通过杂种F1的自交获得了含有Bt抗虫转基因的F2分离后代群体;利用酶联免疫吸附测定(ELISA)的方法对含Bt抗虫转基因的水稻亲本、F1和F2的Bt抗虫蛋白的表达情况进行了比较分析(图2)。结果表明,与其栽培稻亲本相比,Bt抗虫转基因在F1和F2中的蛋白表达量没有显著降低,且在F2群体的分蘖期和开花期等不同时期,Bt转基因的表达水平明显高于其栽培稻亲本。其他类似的研究,也得出了转基因能够在野生近缘种群体中正常表达的结果。

图2 酶联免疫吸附测定(ELISA)方法分析不同生长时期Bt抗虫转基因(蛋白)在水稻亲本及其与普通野生稻杂种F1和F2中的表达水平(修改自Xia et al.,2009)Fig.2 The expression pattern of insect-resistant Bt protein in rice parent, F1 and F2 hybrid progeny at different growth stages obtained based on enzyme-linked immunosorbent assay (ELISA) (modified from Xia et al.,2009)
4 转基因带来生态适合度和生态影响的分析与研究
一旦外源转基因通过天然杂交以一定的频率转移到野生稻群体并在野生近缘种群体中正常表达,就必须通过受控试验对转基因所带来的适合度效应进行检测和分析。这是对转基因逃逸及其潜在环境风险评价的关键步骤。但目前我国大多数对转基因逃逸及其潜在环境风险的研究,仅停留在对转基因通过花粉介导的基因漂移逃逸到非转基因作物品种和野生近缘种的频率或概率进行检测和分析的阶段,而未深入研究逃逸的外源转基因对野生近缘种的适合度影响。这就很难对通过天然杂交而转移到作物野生近缘种群体的基因所造成的环境影响进行科学合理的评价。因为具有很强自然选择优势(如抗虫)的转基因,即使是以较低的频率转移到栽培稻的野生近缘种群体,都会影响含有转基因野生近缘种个体的生存能力和繁殖能力,并以较强的竞争优势在野生近缘种群体中留存和扩散,通过遗传同化(genetic assimilation)和选择性剔除(selective sweep)作用,取代群体中其他个体和基因型,导致不可预测的生态影响和野生稻遗传资源的丧失(Lu,2013)。
对于转基因带来的适合度效应,国外学者非常重视,已经有大量的研究并涉及不同的农作物及其野生近缘种(Robertoetal.,2006; Songetal.,2004; Snowetal.,2003、2005);而在我国,类似的研究相对较少。复旦大学的生态与进化研究小组,在抗虫(Bt、CpTI、Bt/CpTI)转基因和抗除草剂(EPSPS)转基因对栽培稻(Chenetal.,2006; Xiaetal.,2010、2012)、杂草稻和普通野生稻(张宏彬等,2013; Caoetal.,2009; Dongetal.,2011; Lu & Yang,2009; Yangetal.,2011、2012)适合度的影响方面进行了大量的研究,获得了一定的成果。
研究表明,抗虫转基因在有较高的自然选择压(虫压)环境条件下,即稻田有较高的虫害发生水平时,会为栽培稻及其野生近缘种带来显著的适合度利益;但是,在虫害发生水平很低的环境条件下,含有转基因的栽培稻与其非转基因水稻亲本或不含转基因的杂种分离后代相比,其生长、分蘖和产生种子的能力均显著降低(Chenetal.,2006; Xiaetal.,2010、2011)。因此,从大田生产的角度考虑,种植抗虫转基因水稻品种时,应该根据其靶标害虫的发生情况进行布局。在抗虫基因靶标害虫发生比较严重的地区和年份,种植抗虫转基因水稻可以降低靶标害虫带来的危害,从而保证高产;但如果在虫害发生水平较低的年份和地区种植抗虫转基因(特别是多基因叠加)水稻品种,则可能由于其适合度成本而带来一定的减产(Chenetal.,2006; Xiaetal.,2010、2011)。
对抗虫转基因水稻和非转基因亲本分别与杂草稻的杂种F1及其自交分离后代(F2~F7)的检测和分析结果表明,抗虫转基因在虫害发生水平较高的环境条件下,能够显著提高含有抗虫转基因杂草稻杂种后代群体的适合度;但是,在靶标害虫发生水平较低的环境条件下,含有抗虫转基因的杂草稻植株和群体不会比非转基因杂草稻有明显的优势(张宏彬等,2013; Yangetal.,2011、2012)。此外,当含有抗虫转基因的栽培稻或杂草稻与不含转基因的杂草稻混合种植时,环境中靶标害虫的虫压水平会显著降低,在这样的环境条件下,含有转基因的杂草稻与其非转基因杂草稻未表现出显著的适合度差异(张宏彬等,2013; Yangetal.,2011、2012)。在大田生产情况下,如果在某一地区种植抗虫转基因水稻,那么该地区的总体虫害发生水平会降低,这与已经观察到的抗虫转基因棉花种植降低了环境中的害虫发生水平(Wuetal.,2008)相似。因此,抗虫转基因很可能通过天然杂交而转移到栽培稻的伴生杂草稻,但是由于该抗虫基因不能给杂草稻带来适合度优势而不可能产生明显的生物安全问题。由此笔者预测,抗虫转基因通过基因漂移逃逸到杂草稻而产生的生态风险和环境影响将会非常有限,可以忽略不计。
抗虫转基因从栽培稻逃逸到野生稻所带来的适合度影响与杂草稻适合度的研究结果非常相似,即抗虫转基因在靶标害虫虫压较高的环境条件下,能为普通野生稻的个体或群体带来某些性状,如单株分蘖数、穗数和饱满种子数的适合度优势;但是,在靶标害虫虫压较低的环境条件下,抗虫转基因不能为普通野生稻带来显著的适合度变化(卢宝荣等未发表资料)。另有研究表明,抗虫转基因对普通野生稻的种子休眠性没有任何影响(Dongetal.,2011)。值得注意的是,同样的抗虫转基因对不同的普通野生稻群体带来的适合度影响程度不同,这是由于不同野生稻群体的遗传背景有较大的变异。另外,最新的研究结果表明,普通野生稻自身有较强的抗靶标害虫能力,抗虫转基因通过基因漂移转移到普通野生稻群体之后,不会为其带来额外的抗虫能力(卢宝荣等未发表资料),从而对普通野生稻的各适合度相关性状的影响较小。鉴于栽培稻与普通野生稻的基因漂移频率总体较高且有较大的变异,抗虫转基因逃逸到野生稻群体的环境安全问题还有待于进一步研究。
5 小结
水稻是我国最重要的粮食作物之一,而虫害是影响和制约水稻高产和稳产的最关键因素之一。依靠大量杀虫剂控制虫害,不仅对农业生态环境造成严重污染,而且会导致害虫对杀虫剂产生抗性,进而使用更高浓度的化学杀虫剂控制虫害。这种恶性循环的不断加剧,将严重威胁包括水稻在内的农作物的可持续与安全生产。同时,农作物可食用部位中化学农药的残留,会对人类健康带来直接的影响和长期的隐患。因此,用转基因技术对水稻品质进行遗传改良,提高水稻的抗虫性,保证水稻的高产和稳产,是绿色农业和生态农业发展的必经之路(Huangetal.,2005; James,2013; Phipps & Park,2002)。但是,在利用生物技术进行农作物品种遗传改良的过程中,必须对其产品的潜在风险进行科学和严格的评价,确保生物技术产品的安全性,包括转基因产品的食品和健康安全以及环境生态安全。
对于抗虫转基因水稻中的外源基因逃逸及其潜在环境影响的试验研究和模型模拟结果表明,栽培稻是比较严格的自花授粉和风媒传粉植物,外源基因从转基因水稻向非转基因水稻漂移的频率非常低,且通过一定的管理措施,如设置空间隔离带或错开其开花期(隔离时间),便可以降低甚至避免转基因向非转基因水稻品种的逃逸,避免由此导致的转基因“混杂”。但是,转基因通过天然杂交和基因漂移向杂草稻和野生稻群体的逃逸不可避免,对于转基因带来的潜在环境风险及其程度,可以通过对其逃逸的频率、在野生近缘种中的表达以及对野生近缘种的生态适合度效应进行科学评价而获得。通过对转基因逃逸及其环境影响的科学评价、监测和管理,可以将其风险降低到许可的阈值范围内。
卢宝荣. 2013. 以科学知识和事实增进公众对转基因生物及其安全性的了解. 植物生理学报, 49(7): 615-625.
张宏彬, 夏辉, 杨箫, 卢宝荣. 2013. 种植密度对抗虫转基因杂草稻分离后代适合度的影响. 复旦学报: 自然科学版, 52(4): 419-427.
Cao Q J, Xia H, Yang X and Lu B-R. 2009. Performance of hybrids between weedy rice and insect-resistant transgenic rice under field experiments: implication for environmental biosafety assessment.JournalofIntegrativePlantBiology, 51: 1138-1148.
Chen L J, Lee D S, Song Z P, Suh H S and Lu B-R. 2004. Gene flow from cultivated rice (Oryzasativa) to its weedy and wild relatives.AnnalsofBotany, 93: 67-73.
Chen L Y, Snow A A, Wang F and Lu B-R. 2006. Effects of insect-resistance transgenes on fecundity in rice (Oryzasativa, Poaceae): a test for underlying costs.AmericanJournalofBotany, 93: 94-101.
Cooper M. 2008.LifeasSurplus:BiotechnologyandCapitalismintheNeoliberalEra. Washington, USA: University of Washington Press.
Dong S S, Xiao M Q, Rong J, Liao H, Lu B-R, Chen J K and Song Z P. 2011. No effect of transgene and strong wild parent effects on seed dormancy in crop-wild hybrids of rice: implications for transgene persistence in wild populations.AnnalsofAppliedBiology, 159: 348-357.
Ellstrand N C. 2003. Current knowledge of gene flow in plants: implications for transgene flow.PhilosophicalTransactionsoftheRoyalSocietyofLondonSeriesB-BiologicalSciences, 358: 1163-1170.
Ellstrand N C, Prentice H C and Hancock J F. 1999. Gene flow and introgression from domesticated plants into their wild relatives.AnnualReviewofEcologyandSystematics, 30: 539-563.
Gressel J and Bernal E V. 2009. A strategy to provide long-term control of weedy rice while mitigating herbicide resistance transgene flow, and its potential use for other crops with related weeds.PestManagementScience, 65: 723-731.
Huang J, Hu R, Rozelle S and Pray C. 2005. Insect-resistant GM rice in farmers′ fields: assessing productivity and health effects in China.Science, 308: 688-690.
James C. 2014.GlobalStatusofCommercializedBiotech/GMCrops: 2013.ISAAABriefNo. 46. Ithaca, NY: ISAAA.
Lu B-R. 2008. Transgene escape from GM crops and potential biosafety consequences: an environmental perspective.InternationalCentreforGeneticEngineeringandBiotechnology(ICGEB),CollectionofBiosafetyReviews, 4: 66-141.
Lu B-R. 2013. Introgression of transgenic crop alleles: its evolutionary impacts on conserving genetic diversity of crop wild relatives.JournalofSystematicsandEvolution, 51: 245-262.
Lu B-R and Yang C. 2009. Gene flow from genetically modified rice to its wild relatives: assessing potential ecological consequences.BiotechnologyAdvance, 27: 1083-1091.
Messeguer J, Fogher C, Guiderdoni E, Marfa V, Catala M M, Baldi G and Mele E. 2001. Field assessment of gene flow from transgenic to cultivated rices (OryzasativaL.) using a herbicide resistance genes as tracer marker.TheoreticalandAppliedGenetics, 103: 1151-1159.
Phipps R H and Park J R. 2002. Environmental benefits of genetically modified crops: global and European perspectives on their ability to reduce pesticide use.JournalofAnimalandFeedSciences, 11: 1-18.
Roberto G, Clegg J and Ellstrand N C. 2006. Relative fitness of transgenic vs. non-transgenic maize× teosinte hybrids: a field evaluation.EcologicalApplications, 16: 1967-1974.
Rong J, Lu B-R, Song Z P, Su J, Snow A A, Zhang X S, Sun S G, Chen R and Wang F. 2007. Dramatic reduction of crop-to-crop gene flow within a short distance from transgenic rice fields.NewPhytologist, 173: 346-353.
Rong J, Song Z P, de Jong T, Zhang X S, Sun S G, Xu X, Xia H, Liu B and Lu B-R. 2010. Modelling pollen-mediated gene flow in rice: risk assessment and management of transgene escape.PlantBiotechnologyJournal, 8: 452-464.
Rong J, Song Z P, Su J, Xia H, Lu B-R and Wang F. 2005. Low frequency of transgene flow from Bt/CpTI rice to its nontransgenic counterparts planted at close spacing.NewPhytologist, 168: 559-566.
Rong J, Xia H, Zhu Y Y, Wang Y Y and Lu B-R. 2004. Asymmetric gene flow between traditional and hybrid rice varieties (Oryzasativa) estimated by nuclear SSRs and its implication in germplasm conservation.NewPhytologist, 163: 439-445.
Saji H, Nakajima N, Aono M, Tamaoki M, Kubo A, Wakiyama S, Hatase Y and Nagatsu M. 2005. Monitoring the escape of transgenic oilseed rape around Japanese ports and roadsides.EnvironmentalBiosafetyResearch, 4: 217-222.
Shivrain V K, Burgos N R, Anders M M, Rajguru S N, Moore J and Sales M A. 2007. Gene flow between ClearfieldTMrice and red rice.CropProtection, 26: 349-356.
Shivrain V K, Burgos N R, Gealy D R, Moldenhauer K A and Baquireza C J. 2008. Maximum outcrossing rate and genetic compatibility between red rice (Oryzasativa) biotypes and ClearfieldTMrice.WeedScience, 56: 807-813.
Snow A A, Andow D A, Gepts P, Hallerman E M, Power A, Tiedje J M and Wolfenbarger L L. 2005. Genetically modified organisms and the environment: current status and recommendations.EcologyApplications, 15: 377-404.
Snow A A, Pilson D, Rieseberg L H, Paulsen M J, Pleskac N, Reagon M R, Wolf D E and Selbo S M. 2003. A Bt transgene reduces herbivory and enhances fecundity in wild sunflowers.EcologyApplications, 13: 279-286.
Song Z P, Lu B-R, Wang B and Chen J K. 2004. Fitness estimation through performance comparison of F1 hybrids with their parental speciesOryzarufipogonandO.sativa.AnnalsofBotany, 93: 311-316.
Song Z P, Lu B R, Zhu Y G and Chen J K. 2003. Gene flow from cultivated rice to the wild speciesOryzarufipogonunder experimental field conditions.NewPhytologist, 157: 657-665.
Stewart C N, Richards H A and Halfhill M D. 2000. Transgenic plants and biosafety: science, misconceptions and public perceptions.Biotechniques, 29: 832.
Wang F, Yuan Q H, Shi L, Qian Q, Liu W G, Kuang B G, Zeng D L, Liao Y L, Gao B and Jia S R. 2006. A large-scale field study of transgene flow from cultivated rice (Oryzasativa) to common wild rice (O.rufipogon) and barnyard grass (Echinochloacrusgalli).PlantBiotechnologyJournal, 4: 667-676.
Watrud L S, Lee E H, Fairbrother A, Burdick C, Reichman J R, Bollman M, Storm M, King G and Van de Water P K. 2004. Evidence for landscape-level, pollen mediated gene flow from genetically modified creeping bentgrass with CP4 EPSPS as a marker.ProceedingsoftheNationalAcademiesofScienceUSA, 101: 14533-14538.
Wilkinson M J, Davenport I J, Charters Y M, Jones A E, Allainguillaume J, Butler H T, Mason D C and Raybould A F. 2000. A direct regional scale estimate of transgene movement from genetically modified oilseed rape to its wild progenitors.MolecularEcology, 9: 983-991.
Wu K M, Lu Y H, Feng H Q, Jiang Y Y and Zhao J Z. 2008. Suppression of cotton bollworm in multiple crops in China in areas with Bt toxin-containing cotton.Science, 321: 1676-1678.
Xia H, Chen L Y, Wang F and Lu B-R. 2010. Yield benefit and underlying cost of insect-resistance transgenic rice: implication in breeding and deploying transgenic crops.FieldCropsResearch, 118: 215-220.
Xia H, Lu B-R, Su J, Chen R, Rong J, Song Z P and Wang F. 2009. Normal expression of insect-resistant transgene in progeny of common wild rice crossed with genetically modified rice: its implication in ecological biosafety assessment.TheoreticalandAppliedGenetics, 119: 635-644.
Xia H, Lu B-R, Xu K, Wang W, Yang X, Yang C, Luo J, Lai F, Ye W and Fu Q. 2011. Enhanced yield performance of insect-resistant Bt rice under experimental conditions: implications for field management.TransgenicResearch, 20: 655-664.
Yang X, Wang F, Su J and Lu B-R. 2012. Limited fitness advantages of crop-weed hybrid progeny containing insect-resistant transgenes (Bt/CpTI) in transgenic rice field.PLoSONE, 7: e41220.
Yang X, Xia H, Wang W, Wang F, Su J, Snow A A and Lu B-R. 2011. Transgenes for insect resistance reduce herbivory and enhance fecundity in advanced-generation weed-crop hybrids of rice.EvolutionaryApplications, 4: 672-684.
