盐城棉区棉铃虫田间种群对Bt蛋白的抗性基因频率
2014-08-30方志翔郑央萍徐文华
刘 标, 方志翔, 郑央萍, 徐文华
1环境保护部南京环境科学研究所生物安全重点实验室,江苏 南京 210042; 2江苏沿海地区农业科学研究所,江苏 盐城 224002
转Bt基因作物因其高效杀虫性而被广泛应用,已经在全世界推广种植长达近20年之久。但是,随着Bt作物种植时间的延长以及关于害虫Bt抗性研究的深入,越来越多的科学家开始关注田间靶标害虫对Bt作物产生抗性风险的问题。多方面研究已经证实了害虫对Bt作物产生抗性的潜在风险(Ferré & Van Rie,2002; Griffitts & Aroian,2005; Mengetal.,2004; Tabashnik,1994)。因此,针对靶标害虫对转Bt作物抗性检测和监测显得尤为重要。棉铃虫HelicoverpaarmigeraHübner是转Bt基因抗虫棉的靶标害虫,有关河北、河南、山东、山西等地的棉铃虫抗性已有较多研究(何丹军等,2001; Wu,2007),但是,关于长江中下游地区棉铃虫的抗性变化情况尚未见报道。为此,本研究选择我国长江流域盐城棉区为试验地,开展了田间棉铃虫种群对Bt毒素抗性基因频率的监测工作,以期为转Bt基因抗虫棉花的长期发展提供依据。
1 材料与方法
1.1 试虫采集及饲养
于2012年8月(第3代棉铃虫盛发期),在江苏盐城市三龙镇和东台镇棉花种植区内随机采集500余头棉铃虫4龄幼虫,带回实验室放入培养皿中,在室内温度(27±1) ℃、光周期L∶D=14 h∶10 h、相对湿度75%~85%的条件下用人工饲料饲养至化蛹并羽化。然后将羽化后的成虫放入一次性塑料杯内单对交配(同一棉区1头雌成虫与1头雄成虫交配),每个单对编号,收集每个单对的有效卵,每个单对独立孵化饲养。取部分初孵棉铃虫幼虫用于测定其对转基因抗虫棉的敏感性,其余幼虫用人工饲料饲养至2龄初期,体重1 mg左右,用于测定其对Bt蛋白的抗性基因频率。
1.2 供试棉
供试棉分别为由中国农业科学院棉花研究所研制的中棉系列中16和由山东省棉花研究中心研制的鲁棉系列转Bt基因抗虫棉中30。
1.3 供试毒蛋白
Bt(CrylAc)活化毒素购自美国Case Western Reserve University。将活化后的Bt毒素溶于0.01 mol·L-1磷酸盐缓冲液(pH=7.4),配成0.1 μg·μL-1的毒蛋白溶液;对照组试剂(CK)为pH 7.4、0.01 mol·L-1磷酸盐缓冲液。
1.4 转Bt基因棉花对棉铃虫死亡率和体重的影响
把湿润的滤纸放入培养皿中,每皿接初孵棉铃虫幼虫5头后分别饲喂转Bt基因棉花(中30)及其对照非转基因棉花(中16)的幼嫩叶片。接虫后用纱布封严培养皿,防止幼虫逃逸和保持皿内湿度,置于(26±1) ℃、L∶D=14 h∶10 h的养虫室内。试验设5个重复。每天更换新鲜的棉花叶片,并调查各处理幼虫死亡情况,计算死亡率,用分析天平精确称量各处理组存活幼虫的体重。
1.5 棉铃虫幼虫对Bt蛋白的抗性基因频率
区分剂量法是在生物测定的基础上发展起来的,其原理是用杀死99%敏感个体的剂量作为诊断剂量,在此浓度下存活的个体为抗性个体,反之则为非抗性个体。根据陈海燕等(2007)的方法,棉铃虫2龄初期幼虫对活化Cry1Ac毒素的区分剂量为10 μg·头-1。具体操作步骤:(1)取已冷却凝结的棉铃虫人工饲料,以切片器将之切成3 mm厚的薄片;然后用打孔器打成圆片状,用镊子放入24孔培养板底部。(2)将24孔培养板每个孔中的饲料压实,并将孔口和孔壁等可能沾有饲料的地方清理干净。(3)将100 μL 0.1 μg·μL CrylAc活化毒素加入每个孔,培养板数量以供试幼虫数量而定。取一个24孔培养板作对照,只加入100 μL磷酸盐缓冲液。(4)待24孔培养板饲料表面的溶液晾干后,每孔接入上述1.1中获得的1头体重约1 mg左右的2龄初期幼虫,用2层尼龙纱和1层黑布覆盖防止其逃跑。置于恒温光照培养箱(26±1) ℃、L∶D=14 h∶10 h、相对湿度75%~85%条件下,5 d后检查幼虫的死亡状况。完全死亡或生长发育受到限制(体重小于5 mg)均视为死亡。
1.6 统计分析
采用Excel 2007软件对数据进行统计分析。
2 结果与分析
2.1 转Bt基因棉花对棉铃虫死亡率和体重的影响
由表1可见,初孵棉铃虫幼虫取食转Bt基因棉花幼嫩叶片之后,在9 d之内全部死亡,而取食非转基因棉花叶片的初孵棉铃虫幼虫在9 d之内绝大多数存活,且生长发育正常。这说明目前盐城棉铃虫田间种群对转基因抗虫棉仍保持很高的敏感性。
2.2 盐城田间棉铃虫种群对Bt蛋白的抗性基因频率
三龙镇和东台镇的受试总虫数分别为397和448头。2龄幼虫经区分剂量处理5 d后,绝大多数死亡,两地的死亡虫数分别为394和445头,由此计算出三龙镇和东台镇的田间棉铃虫种群对Bt蛋白的抗性基因频率分别为7.6×10-3和6.9×10-3。
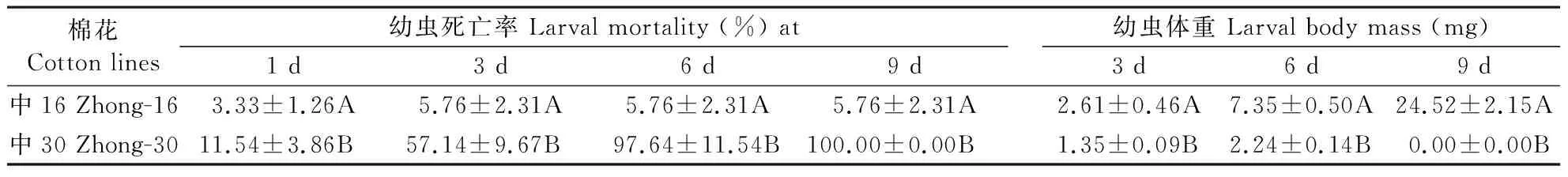
表1 初孵棉铃虫取食不同棉叶后的死亡率和体重Table 1 Mortality and body mass of the newly hatched larvae of the cotton bollworm exposed to different cotton leaves
数据为5个重复的平均值±标准偏差,同列数据后附不同大写字母者表示不同品种间差异极显著(P<0.01)。
Datas are means±SD, the same column followed by different capital letters show very significant differences between different cottons.
3 结论与讨论
转Bt基因棉长期大量种植,造成的潜在风险之一是靶标害虫对Bt棉的抗性进化,这将严重威胁Bt棉的持续有效应用。靶标害虫对转Bt基因作物的抗性进化依赖于多种因素,包括靶标害虫种群中抗性等位基因的初始频率、害虫抗性遗传模式、抗性的显隐性度及适合度、害虫在不同寄主上的时空分布情况以及不同地理种群间的基因流等(Gould,1998; McGaughey & Whalon,1992; Tabashnik,1994)。抗性监测是了解害虫抗性发展的有效途径,能够为防治抗性害虫种群提供科学依据(Huang,2006)。Akhurstetal.(2003)将田间采集的3个棉铃虫种群与室内敏感品系交配,在含有Cry1Ac毒素的饲料上筛选16代后检测Bt抗性,研究结果显示,对Bt有抗性的棉铃虫能够在表达Cry1Ac毒素蛋白的转基因棉上完成幼虫生长发育且羽化繁殖,说明棉铃虫有可能对Bt棉产生抗性。Lietal.(2004)通过F1代筛查法检测到2002年采自河北安次县和山东夏津县的棉铃虫田间种群对Cry1Ac的抗性基因频率分别为1×10-3和0.6×10-3左右。陈海燕等(2007)采用改进的F1筛查法检测到2005年采自河南安阳和河北沧县的棉铃虫种群对CrylAc的抗性基因频率分别为1.4×10-3和1.5×10-3。刘凤沂等(2008)采用F1代法在室内用喂饲法检测了2006年采自河北省邱县Bt棉田棉铃虫对Bt棉的抗性等位基因频率,发现127头田间雄虫中24头携带抗性基因,估测抗性等位基因频率为0.94,该值为我国首次检测到的高抗性等位基因频率。须志平(2008)采用单雌系F2代法监测到河北邱县地区2003~2005年棉铃虫种群对转基因Bt棉的抗性等位基因频率为0.0146,该频率值明显高于1999 年的监测结果(何丹军等,2001),表明持续监测棉铃虫田间种群的抗性变化十分必要。
本研究表明,盐城地区棉铃虫种群对我国目前的主栽转基因抗虫棉仍保持很高的敏感性,三龙镇和东台镇2龄幼虫对Bt蛋白的抗性基因频率分别为7.6×10-3和6.9×10-3。这个结果与河北、河南、山东等地的监测结果(卢美光等,2000)属于同一数量级水平,表明我国种植转基因棉花地区的田间棉铃虫种群还未出现明显的抗性进化。但是,管理措施不足已经导致某些靶标害虫对转Bt基因抗虫作物抗性的快速发展(van Rensburg,2007),且根据近年来冀、鲁、豫棉区抗虫棉抗性监测结果,抗虫棉对棉铃虫的防效有下降的趋势(吕丽敏等,2013)。这说明棉铃虫抗性风险依然存在,对此绝不能放松警惕,必须连续、系统地做好棉铃虫抗性监测工作。
陈海燕, 杨亦桦, 武淑文. 2007. 棉铃虫田间种群Bt毒素CrylAc抗性基因频率的估算. 昆虫学报, 50(1): 25-30.
何丹军, 沈晋良, 周威君, 高聪芬. 2001. 应用单雌系F2代法检测棉铃虫对转Bt基因棉抗性等位基因的频率. 棉花学报, 13(2): 105-108.
刘凤沂, 朱玉成, 沈晋良. 2008. F1代法监测田间棉铃虫对转Bt基因棉的抗性. 昆虫学报, 51(9): 938-945.
卢美光, 赵建周, 范贤林. 2000. 华北地区棉铃虫对Bt杀虫蛋白的抗性监测. 棉花学报, 12(4): 180-183.
吕丽敏, 雒珺瑜, 刘全义, 杨子山, 张帅, 王春义, 崔金杰. 2013. 冀鲁豫棉区Bt棉Cry1A蛋白表达及对棉铃虫控制效果监测. 棉花学报, 25(5): 459-466.
须志平. 2008. 应用单雌系F2代法监测田间棉铃虫种群对转Bt基因棉的抗性. 南京: 南京农业大学.
Akhurst R J, James W, Bird L and Beard C. 2003. Resistance to the Cry1Ac-endotoxin ofBacillusthuringiensisin the cotton bollworm,Helicoverpaarmigera(Lepidoptera: Noctuidae).JournalofEconomicEntomology, 96: 1290-1299.
Ferré J and Van Rie J. 2002. Biochemistry and genetics of insect resistance toBacillusthuringiensis.AnnualReviewofEntomology, 47: 501-533.
Gould F. 1998. Sustainability of transgenic insecticidal cultivars: integrate pest genetics and ecology.AnnualReviewofEntomology, 43: 701-726.
Griffitts J S and Aroian R. 2005. Many roads to resistance: how invertebrates adapt to Bt toxins.BioEssays, 27: 614-624.
Huang F. 2006. Detection and monitoring of insect resistance to transgenic Bt crops.InsectScience, 13: 73-84.
Li G, Wu K, Gould F, Feng H, He Y and Guo Y. 2004. Frequency of Bt resistance genes inHellicoverpaarmigerapopulations from the yellow river cotton-farming region of China.EntomologiaExperimentalisetApplicata, 112: 135-143.
McGaughey W H and Whalon M E. 1992. Managing insect resistance toBacillusthuringiensistoxins.Science, 258: 1451-1455.
Meng F X, Shen J L, Zhou W J and Cen H M. 2004. Long-term selection for resistance to transgenic cotton expressingBacillusthuringiensistoxin inHelicoverpaarmigera(Hübner) (Lepidoptera: Noctuidae).PestManagementScience, 60: 167 -172.
Tabashnik B E. 1994. Evolution of resistance toBacillusthuringiensis.AnnualReviewofEntomology, 39: 47-79.
van Rensburg J B J. 2007. First report of field resistance by the stem borer,Busseolafusca(Fuller) to Bt-transgenic maize.SouthAfricanJournalofPlantandSoil, 24: 147-151.
Wu K. 2007. Monitoring and management strategy forHelicoverpaamigeraresistance to Bt cotton in China.JournalofInvertebratePathology, 95: 220-223.
