香菇多糖对缓解乳腺癌化疗后骨髓抑制的临床观察
2014-08-29郭鹏
郭鹏
·论著·
香菇多糖对缓解乳腺癌化疗后骨髓抑制的临床观察
郭鹏
目的研究香菇多糖对缓解乳腺癌化疗后骨髓抑制疗效。方法选取2009年1月至2013年5月化疗的乳腺癌患者82例,随机分为治疗组(n=42)和对照组(n=40),2组患者均在化疗第1天起给予利可君20 mg、鲨肝醇60 mg口服,均为3次/d,每次化疗周期的第5天(即化疗停药后2 天)起,每日检查1次血常规。 治疗组自化疗第1天起给予香菇多糖注射液1 mg 静脉滴注,2次/周,对照组无其他用药。当患者出现骨髓抑制时,2组均应用重组人粒细胞刺激因子(G-CSF)皮下注射,白细胞Ⅰ、Ⅱ度减少时给予150 μg/d;白细胞Ⅲ、Ⅳ度减少时给予300 μg/d,2组均每日查血常规,当白细胞总数超过4.0×109/L,停G-CSF皮下注射继续观察血常规。观察2组患者白细胞下降持续时间,每化疗周期平均需要用G-CSF天数,白细胞、血红蛋白、血小板出现Ⅲ、Ⅳ度骨髓抑制的病例,每化疗周期平均使用G-CSF总量和每化疗周期第10天白细胞计数、血红蛋白、血小板计数的变化情况。结果2组白细胞下降持续时间和平均用药天数比较,差异有统计学意义(P<0.05)。2组白细胞、血红蛋白Ⅲ度抑制率比较差异无统计学意义(P>0.05)。2组每化疗周期平均使用G-CSF总量比较,差异有统计学意义(P<0.05)。2组每化疗周期第10天白细胞计数、血红蛋白、血小板计数Ⅲ、Ⅳ度率比较,差异有统计学意义(P<0.05)。结论乳腺癌患者化疗期间联合应用香菇多糖,可有效减轻化疗期间的骨髓抑制,缩短治疗时间及外周血的低血象期,提高机体的免疫功能状态。
乳腺肿瘤;香菇多糖;骨髓抑制
乳腺癌女性最常见的恶性肿瘤,全球每年新诊断乳腺癌130万,死亡约45万[1]。化疗是乳腺癌综合治疗的重要方法之一,可以杀伤患者体内残余肿瘤细胞,提高疗效,改善预后。但由于肿瘤细胞与正常细胞间代谢性差异相近,因此化疗药物易对化疗药物产生损害[1]。骨髓抑制是化疗过程中的常见不良反应,不仅延缓化疗时间而且影响疗效,甚至可能导致并发症发生从而危及患者生命。一些恶性肿瘤患者或许不会很快死于疾病本身,却可能由于骨髓抑制而致命。因此,有效的处理骨髓抑制是化疗的重要环节[2]。我科对乳腺癌患者化疗期间辅以香菇多糖治疗,报道如下。
1 资料与方法
1.1 一般资料 入选患者为2009年1月至2013年5月间在我院住院化疗的乳腺癌患者,以TEC方案化疗4至8个周期。将所有患者随机分为治疗组(n=42)和对照组(n=40)。治疗组,年龄31~69岁,平均年龄(51.2±1.2)岁;其中患有高血压病11例,2型糖尿病9例;临床病理分期:Ⅰ期12例、Ⅱ期21例、Ⅲ期8例、Ⅳ期1例。对照组,年龄 33~67岁,平均年龄(49.7±1.4)岁;其中高血压病9例,2型糖尿病12例;临床病理分期:Ⅰ期9例,Ⅱ期22例,Ⅲ期7例,Ⅳ期2例。2组患者的年龄、临床病理分期及并发症差异无统计学意义(P>0.05),具有可比性。为实现严格的控制研究质量,本研究入组患者均为采用TEC方案(多西他赛75 mg/m2d3,表柔比星75 mg/m2分2次d1、2,环磷酰胺50 mg/m2,d1)化疗的乳腺癌患者,82例均为女性,经病理检查确诊为乳腺癌,年龄31~69岁,平均51岁。化疗前所有患者血常规、尿常规、肝肾功能、心电图、肺CT均正常,无其他化疗禁忌证,外周血白细胞均> 4.0×109/L,粒细胞>2.0×109/L,血小板>100×109/L。
1.2 入选标准 香菇多糖儿童、妊娠和育龄期女性慎用,入选患者无妊娠期女性,其中35岁以下11例,36~40岁17例。鉴于乳腺癌患者怀孕后母体内的内分泌变化较大,体内激素水平发生改变,特别是雌激素水平明显升高,易促使癌细胞发展,引起肿瘤恶化、复发或转移,故不宜怀孕,且目前尚无明确应用香菇多糖致畸的报道。有关应用香菇多糖的意义及有可能出现的不良反应均向患者及其家属交代清楚,患者其家属均同意使用。
1.3 治疗方法 2组患者均在化疗第1天起给予利可君20 mg、鲨肝醇60 mg口服,均为3次/d,每次化疗周期的第5天(即化疗停药后2 d)起,每日检查1次血常规。 治疗组自化疗第1天起给予香菇多糖注射液1 min 静脉滴注,2次/周,对照组无其他用药。当患者出现骨髓抑制时,2组均应用重组人粒细胞刺激因子(G-CSF)皮下注射,白细胞Ⅰ、Ⅱ度减少时给予150 μg/d;白细胞Ⅲ、Ⅳ度减少时给予300 μg/d,2组均每日查血常规,当白细胞总数超过4.0×109/L,停G-CSF皮下注射继续观察血常规(我院使用的香菇多糖注射液为金陵药业生产,规格 2 ml:1 mg/支;重组人粒细胞刺激因子为齐鲁制药生产,规格 150 μg:0.9 ml/支、200 μg:1.2 ml/支)。
1.4 骨髓抑制程度 参照抗癌药物急性与亚急性毒性反应分度标准[3]。(1)白细胞Ⅰ、Ⅱ、Ⅲ、Ⅳ度分别为3.0~3.9×109/L,2.0~2.9×109/L,1.0~1.9×109/L,<1.0×109/L;(2)血小板Ⅰ、Ⅱ、Ⅲ、Ⅳ度分别为 75~99×109/L,50~74×109/L,25~49×109/L,<25×109/L;(3)血红蛋白Ⅰ、Ⅱ、Ⅲ、Ⅳ度分别为 95~109g/L、80~94 g/L、65~79 g/L、<65 g/L。
1.5 观察指标 (1)2组患者白细胞下降持续时间。(2) 每化疗周期平均需要用G-CSF天数。(3)2组患者白细胞、血红蛋白、血小板出现Ⅲ、Ⅳ度骨髓抑制的病例。(4)每化疗周期平均使用G-CSF总量。(5)2组患者每化疗周期第10天白细胞计数、血红蛋白、血小板计数的变化情况。
2 结果
2.1 2组患者粒细胞下降持续时间及平均用G-CSF时间比较 2组白细胞下降持续时间和平均用药时间比较,差异有统计学意义(P<0.05)。见表1。

表1 2组粒细胞下降持续时间及平均用G-CSF天数比较 ±s
2.2 2组出现白细胞、血红蛋白、血小板Ⅲ度骨髓抑制率比较 2组白细胞、血红蛋白Ⅲ度抑制率比较差异无统计学意义(P>0.05)。见表2。

表2 2组白细胞、血红蛋白、血小板Ⅲ度骨髓抑制率比较 例(%)
2.3 2组患者血红蛋白、血小板均未出现Ⅳ度骨髓抑制 2组每化疗周期平均使用G-CSF总量比较,差异有统计学意义(P<0.05)。见表3。

表3 2组出现Ⅳ度骨髓抑制和每化疗周期平均使用G-CSF总量比较
2.4 2组每化疗周期第10天白细胞计数、血红蛋白、血小板计数的变化情况 2组每化疗周期第10天白细胞、血红蛋白、血小板计数Ⅲ、Ⅳ度发生率比较,差异有统计学意义(P<0.05)。见表4。
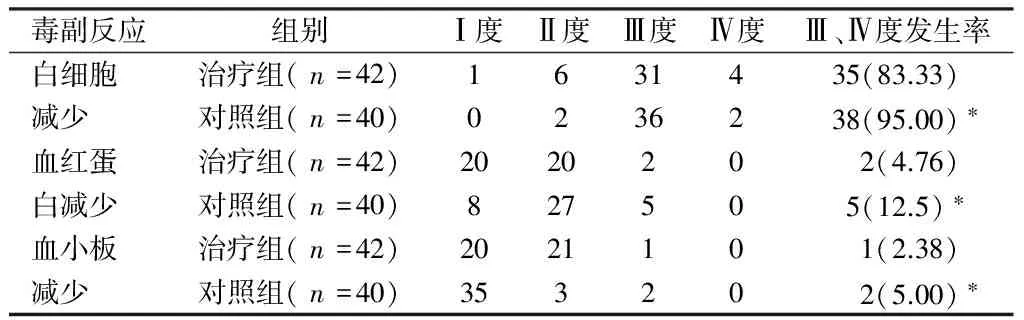
表4 2组每化疗周期第10天骨髓抑制情况 例(%)
注:与治疗组比较,*P<0.05
3 讨论
化疗是针对癌症患者较为有效的治疗方法,其对癌症细胞有抑制、杀伤作用,但化疗药物对、肿瘤细胞和正常身体细胞均产生毒性作用,尤其是骨髓造血细胞的破坏作用。癌症患者临床化疗过程中经常出现白细胞减少,进而影响化疗的正常进行。鲨肝醇、利血生、维生素B4等升白细胞药物,虽然可以促进机体造血功能,刺激白细胞生成,而达到升高白细胞的目的,但起效缓慢。对于中重度骨髓抑制,临床上多采取G-CSF予以治疗。G-CSF治疗骨髓抑制近期疗效确切,可以减轻多种化疗药物所致的白细胞下降,促进患者化疗后白细胞的恢复[4]。但G-CSF维持时间短,作用途径单一,且有一定的不良反应,如骨痛、发热等,并随着药物应用剂量的提高,发生率随之升高。本研究患者化疗期间均常规给予利可君、鲨肝醇口服,出现骨髓抑制时,应用G-CSF治疗,结果显示,治疗组患者出现Ⅳ度骨髓抑制例数及白细胞下降持续时间均明显低于对照组,有统计学差异(P<0.05),每化疗周期平均需用G-CSF天数及G-CSF用量明显也低于对照组,有统计学差异(P<0.05),治疗组患者出现白细胞、血红蛋白Ⅲ度骨髓抑制例数均低于对照组,但无统计学差异(P>0.05)。2组患者血红蛋白、血小板均未出现Ⅳ度骨髓抑制。
香菇多糖是一种中药类免疫增强药物,具有生物反应调节作用。香菇多糖通过刺激免疫细胞、分化和增殖,改善机体平衡,达到恢复和提高宿主细胞对淋巴因子、激素的反应性,使受抑制的辅助性 T 淋巴细胞功能恢复,进而影响机体免疫功能[5]。目前已广泛应用于肿瘤患者的非特异性免疫治疗,增强机体的免疫功能而发挥抗肿瘤活性。在患者化疗期间给予常规治疗的情况下,本研究意在探讨加用香菇多糖后对患者骨髓抑制的影响。虽然香菇多糖妊娠和育龄期女性慎用,但由于本研究之患者均在治疗期间不宜怀孕,故对患者交代清楚后可以使用。研究结果显示,乳腺癌患者化疗期间联合应用香菇多糖,可有效减轻化疗期间的骨髓抑制,缩短治疗时间及外周血的低血象期,提高机体的免疫功能状态,增强患者对化疗药物的耐受性,确保化疗顺利完成。
1 Olson JS.The History of Cancer-an annotated bibliography.New York: Greenwcocl Press,1989.327.
2 陈灏珠主编. 实用内科学. 第 11 版. 北京: 人民卫生出版社,2001.208.
3 孙燕,石远凯主编.临床肿瘤内科手册.北京:人民卫生出版社,2008.142.
4 张学军,孔南迁.重组人粒细胞集落刺激因子在恶性肿瘤化疗后应用的疗效观察.中国药房,2010,21:713.
5 李浩烜,周联,江益平,等.香菇多糖对小鼠 T 细胞比例及活化的影响. 亚太传统医学,2011,7:15-6.
10.3969/j.issn.1002-7386.2014.22.018
065000 河北省廊坊市人民医院肿瘤科
R 737.9
A
1002-7386(2014)22-3411-03
2014-05-13)
