氧化锆(ZrO2)的热、化学性质与应用
2014-08-29欧阳静伦惠林谢亚玲杨华明
欧阳静,周 正,伦惠林,谢亚玲,杨华明
(中南大学资源加工与生物工程学院 无机材料系,湖南 长沙 410083)
1 前 言
ZrO2的受热变化、晶体特征的转变等性质是已经得到广泛认同的基本常识,其结构转变所产生的大的体积效应经过长期而大量的研究已可得到有效解决,以往有关ZrO2的高温应用主要是陶瓷坩埚、高温结构部件等,而最新的有关ZrO2在受热环境中的应用则主要集中在高性能涡轮发动机叶片上的热障涂层、高温陶瓷发动机等的部件上。有关ZrO2的化学性质,从Zr元素的发现起就开始了大量的研究,相关的研究成果也为Zr的提取、各种Zr盐和化合物的合成提供了技术支撑。Zr是一种相对较“懒惰”的元素,对Zr的研究刚开始就遇到了各种困难,但经过化学家的大量努力,终于把Zr元素从自然界中提取并分离出来,这个过程延续了约150年,随后才大规模开展了ZrO2的制备与性质研究等工作[1]。
本篇介绍并归纳了ZrO2的有关热学性质、化学性质的普遍特点和新的研究发现,介绍相关原理和制备方法,并试理出其中的发展趋势,供相关科技研究、工程技术人员作参考与讨论。重点介绍了ZrO2在催化领域的重要应用,这也是ZrO2除光学性质外作为功能材料应用的典型途径。
2 ZrO2的热学性质与应用
各种离子掺杂的ZrO2陶瓷在烧结后的热膨胀系数在9~10×10-6℃-1之间,与钢的膨胀系数相似,热导率均只有1~2 W·m-1·K-1,相比于BeO、Al2O3等非常小,故ZrO2是优良的用于热障涂层的材料。
热障涂层(TBC)是利用陶瓷材料热导率低、抗氧化、耐热冲击等特性制备的热绝缘陶瓷层,它能够阻止外部环境的热量向基体金属传递,提高基体的工作温度。涂层由金属缓冲层或称金属粘结层和陶瓷表面涂层组成。陶瓷层是借助于这一中间的抗氧化作用的合金粘结层而与基体连结的。这一中间过渡层减少了界面应力,避免了陶瓷层的过早剥落。陶瓷层主要用来隔热,必须满足热导率低、抗热震性能好的指标,所以要求陶瓷层材料具有熔点高、高温下相稳定、热导率低、热反射率高等物理化学特性,同时要考虑其热膨胀系数与基体材料匹配[2]。
以燃气涡轮机叶片为例,这种叶片面临着苛刻的服役环境,当今主要的燃气涡轮机生产厂商提供的数据显示:作为普通用途的燃气涡轮机叶片的使用温度在960~1 100 ℃;军用飞机中的燃气轮机燃气温度高达1 600 ℃;至于商用飞机的燃气轮机燃气温度也高达1 500 ℃。然而用于生产涡轮叶片的镍基超强耐热合金的最高工作温度只有1 100 ℃。随着燃气轮机燃气温度的提高,相对于开发新型高温耐热合金材料来讲,致力于燃气轮机涡轮叶片保护成本要低得多。应用于燃气轮机的涡轮叶片表面,以起到隔热作用来提高燃气轮机使用温度,进而提高燃气轮机效率,并延长涡轮叶片的使用寿命是热障涂层的最重要应用之一[3]。
热障涂层的研究工作早在20世纪50年代末就已开始,当时发动机热端部件采用等离子喷涂保护,最初是应用在X-15火箭喷嘴及燃气涡轮发动机的燃烧室部件。20世纪70年代中期,等离子喷涂热障涂层首次成功地在试验性发动机上通过了地面试验,这标志着热障涂层的制备和应用进入了一个新的时代。20世纪80年代,热障涂层应用范围不再局限于航天航空领域,在轮船、汽车、能源等领域的热端部件上也有广泛的应用与研究。后来,美国宇航局(NASA)通过对几种氧化物类陶瓷作对比,发现ZrO2的综合性能最好。近年来,电子束物理气相沉积(EB-PVD)方法逐渐用于制备热障涂层,由于会形成致密的柱状晶结构,制备的热障涂层具有很大的应变容限和更高的结合强度,大大提高了热障涂层的抗热冲击能力[4-5]。近年来又开发了等离子体喷射沉积并辅助激光重熔技术,开发的热障涂层,性能也有一定的优越性[6-7]。
最早用于TBC的陶瓷层材料是MgO或CaO完全稳定的ZrO2(MSZ或CSZ),但随后人们发现,在热循环中MgO或CaO会从固溶体中析出,降低了对ZrO2相的稳定作用,使涂层的热循环寿命大为降低。经过进一步的发展,逐渐改为Y2O3稳定的ZrO2,其中以6%~8%Y2O3部分稳定的ZrO2(6%~8%YSZ)热循环寿命最长,而且有更好的抵抗Na2SO4和V2O5腐蚀的能力,成为目前陶瓷层材料的最佳选择。含6%~8%Y2O3的ZrO2,即部分稳定ZrO2(PSZ)作为陶瓷层材料具有许多优异的特性[5]:①高熔点(2 700~2 850 ℃);②低热导率(0.9~1.5 W·m-1·K-1);③适当的热膨胀系数(8.5~13.0×10-6℃-1),与基体合金(14~17×10-6℃-1)接近;④良好的抗热冲击性能,ZrO2涂层具有高孔隙率和应变容限性,能够缓解热循环带来的热应力;⑤耐高温氧化;⑥优良的高温化学稳定性;⑦优异的综合机械性能,具有较高的抗弯强度和断裂韧性。
上述6%~8%YSZ具有最高的抗热冲击性能,这是由于:①加热过程中部分稳定的ZrO2中单斜相会转变为四方相并伴随体积收缩,而四方相则随温度的升高而膨胀,体积内的收缩与膨胀相互抵消一部分,从而降低热应力,产生了良好的抗热震性;②Y2O3部分稳定ZrO2在加热、冷却过程中发生微量相变,吸收了能量,降低了裂纹扩展的能力,加上以EB-PVD法制造的热障涂层内部本身具有的垂直微裂纹、孔洞等缺陷,降低了热障涂层材料的弹性模量,并通过自由膨胀和收缩来缓解释放中间的应力[8]。其中的垂直微裂纹是采用EB-PVD方法制备的热障涂层的最大的特点,即整个涂层由垂直于基体表面的柱状晶组成,柱状晶与基体之间是冶金结合,在金属和陶瓷涂层的结合部,YSZ晶粒呈等轴晶状;陶瓷涂层中的YSZ晶粒成柱状排列并且沿<100>方向生长,如图1所示[9-10]。在热障涂层受热循环过程中,相邻柱状晶之间可以分开,陶瓷涂层在基体上完全膨胀或收缩而无裂纹产生。从而大大提高了涂层的应变容限,缓解了由于基体和陶瓷层热膨胀系数差异而造成的热应力,进而大幅度提高了热障涂层抗热疲劳性能。

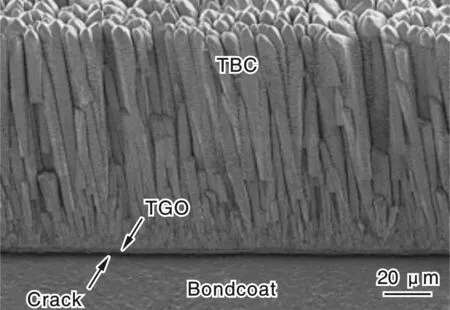
图1 以EB-PVD法制备的TBC层的宏观和微观结构Fig.1 The macro and micro structure of the TBC layers prepared by EB-PVD method
近年来也发现YSZ用于TBC也有一些本质的不足,主要是高温条件下YSZ的隔热性能有待于进一步提高:其长期工作温度不能超过1 250 ℃,因为超过此温度后,YSZ烧结加剧,柱状晶内微孔大大减少,而且出现由非平衡四方相t′到四方相与立方相(t+c),然后到单斜相m的转变,在相变的过程中伴随有约3.5%的体积膨胀,容易使涂层产生裂纹[11]。为了提高YSZ的相稳定性,近来有人用Ta2O5、Nb2O5和Y2O3一起稳定四方相、立方相或两者的混合物,或在Y2O3中添加化学性质与ZrO2十分相似的HfO2来稳定ZrO2,这些材料在某些方面具有较好的应用前景,但和目前的YSZ相比,还未发现性能上有质的提高[12-13]。由于这些不足,YSZ热障涂层在高于1 250 ℃的环境中使用寿命大大缩短,因此必须研究开发新型的热障涂层陶瓷材料。
为寻找适合更高温度的热障涂层材料,国内外学者在采用Y2O3部分稳定的ZrO2基础上,对ZrO2(Y2O3)+HfO2、ZrO2(Y2O3)+CeO2、ZrO2(Y2O3)+SiO2、ZrO2(Y2O3)+Sc2O3、ZrO2(Y2O3)+ La2O3等材料的性能进行了研究,取得了较大进展,结果表明加入多种氧化物特别是CeO2的热障涂层具有更好的热循环性能[14]。Cao X[15]等在YSZ中添加CeO2提高了涂层的耐腐蚀性能、断裂韧性,热导率也有所降低;同时,ZrO2(Y2O3)+CeO2组织几乎没有伴有体积变化的t-m转变;加入CeO2后在合金粘结层处产生的热应力小,并且涂层的热膨胀系数比ZrO2-Y2O3的膨胀系数明显增大,从而明显提高了涂层的高温热循环性能[16]。Dai H等人[17]在YSZ中掺杂50%(摩尔分数)的La2O3+ZrO2,对不同厚度(150 μm、200 μm)的涂层在1 250 ℃±30 ℃条件下进行了热循环试验,结果表明这种涂层的热导率为1.56 W·m-1·K-1,而无掺杂涂层的热导率为2.5 W·m-1·K-1,同时热循环寿命也高于未掺杂涂层;Mastsumoto M[18]研究发现,掺杂1%(摩尔分数)的La2O3能有效降低ZrO2压实粉末的致密度,同时可以使涂层具有抗烧结能力,从而经过高温后仍具有很低的热导率。NASA近来发展了HfO2-Y2O3热障涂层,并在实验室中成功地得到等离子喷涂的HfO2-Y2O3热障涂层。Stecura S研究了8%Yb2O3稳定的ZrO2,发现在同等条件下涂层的寿命比YSZ提高近30%[14]。
其实,某些锆酸盐的热导率比YSZ更低,因此,已有人用其作为替代YSZ的陶瓷顶层材料进行了研究。烧绿石结构的稀土锆酸盐是最近研究的很有前途的TBC材料,其中La2Zr2O7在熔点以上(2 300 ℃)是相稳定的,而且比YSZ热导率更低,但是它的热胀系数相对较低、涂层韧性较差,目前这种涂层的热循环寿命还不如YSZ涂层。研究发现用CeO2代替La2Zr2O7中的ZrO2使涂层的热膨胀系数能有所提高,热循环寿命也大为延长,可以与8YSZ相媲美,甚至更好。在由固相反应合成的La2O3-ZrO2-CeO2复合氧化物中,增加CeO2含量可以提高热膨胀系数和降低热导率[19]。
3 ZrO2的化学性质
3.1 ZrO2的溶解与化学稳定性
ZrO2的化学稳定性非常高,2 000 ℃以下与多种熔融金属、硅酸盐、玻璃等都不起反应,不溶于苛性碱、碳酸盐及其熔融液体,也不溶于盐酸、稀硫酸、硝酸等无机酸,但溶于氢氟酸和热浓硫酸。

3.2 ZrO2的表面性质
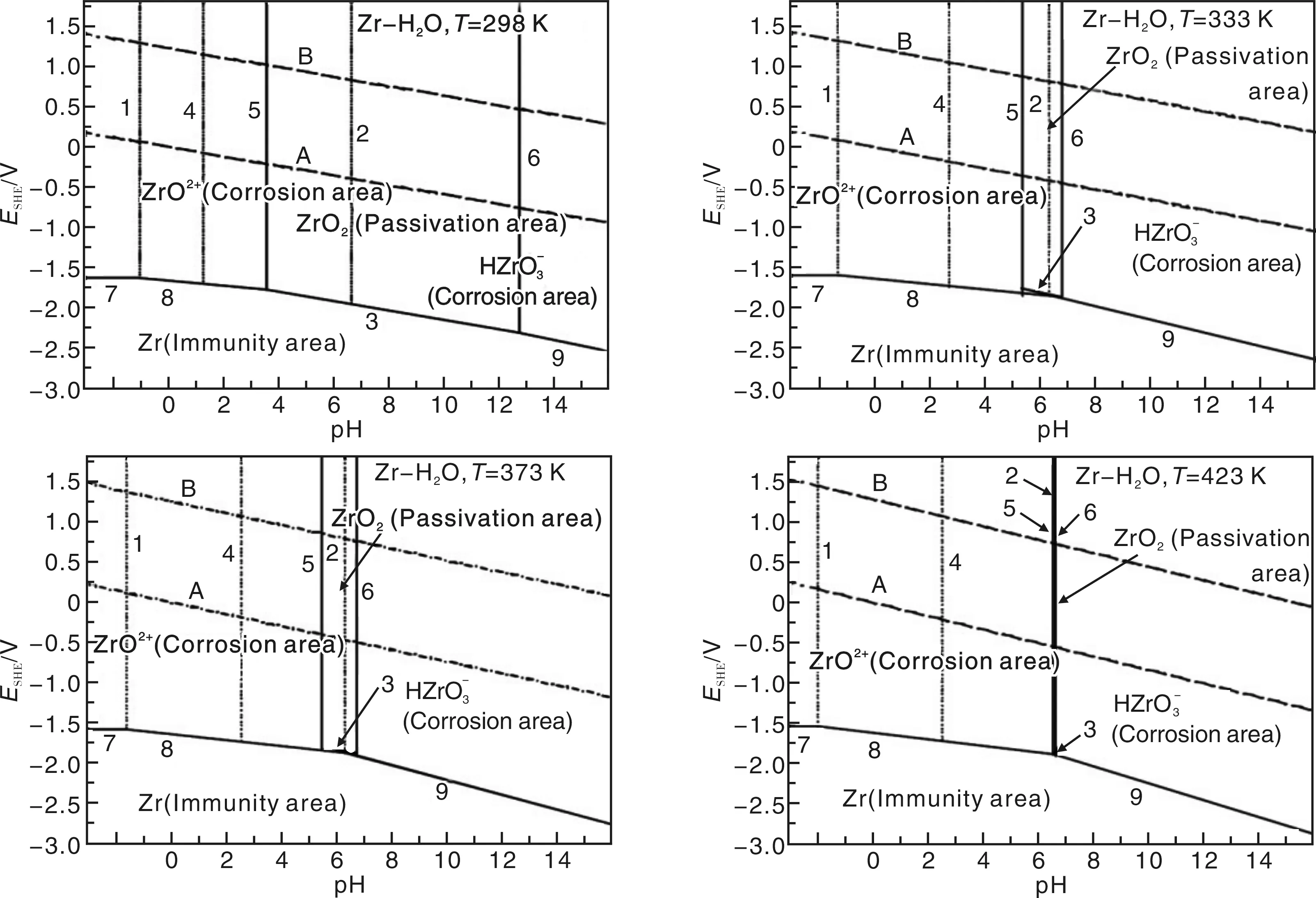
图2 在298 K,333 K,373 K和423 K下Zr-H2O系电位-pH平衡图Fig.2 The E-pH diagrams of Zr-H2O system at 298 K, 333 K, 373 K and 423 K
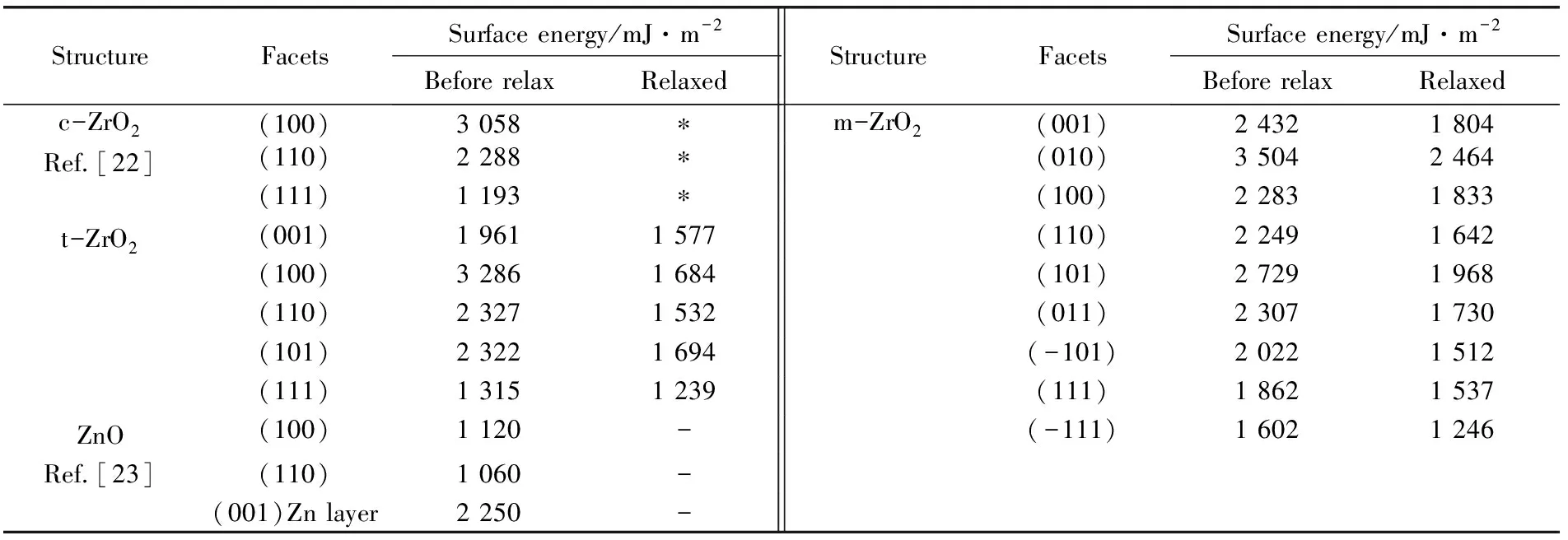
StructureFacetsSurface energy/mJ·m-2Before relaxRelaxedStructureFacetsSurface energy/mJ·m-2Before relaxRelaxedc-ZrO2(100)3 058∗m-ZrO2(001)2 4321 804Ref.[22](110)2 288∗(010)3 5042 464(111)1 193∗(100)2 2831 833t-ZrO2(001)1 9611 577(110)2 2491 642(100)3 2861 684(101)2 7291 968(110)2 3271 532(011)2 3071 730(101)2 3221 694(-101)2 0221 512(111)1 3151 239(111)1 8621 537ZnO(100)1 120-(-111)1 6021 246Ref.[23](110)1 060-(001)Zn layer2 250-
Note:*denotes the value doesn′t exist,if relaxation take, the structure will transform from c-phase to t-phase.-denotes the value was not calculated
ZrO2中Zr-O键结合非常强,其单键离解能高达760.8 kJ·mol-1[21],是所有元素中除C-O(包括单键、双键和三键,其离解能均高于1 000 kJ·mol-1)、Si-O(798.8 kJ·mol-1)、Ce-O(795.13 kJ·mol-1)、Hf-O(791.8 kJ·mol-1)、Ta-O(805.13 kJ·mol-1)、Th-O(854.13 kJ·mol-1)和U-O(761.17 kJ·mol-1)之外离解能最高的一种键,故由这种键结合产生的物质硬度高、熔点高、化学稳定性好。而且由于其特别高的键能,其表面悬空键能也非常高,新生表面的表面能也较高,一般需要吸附小分子或重新团聚来平衡其极高的表面能。这也可以解释为什么ZrO2很难合成出具有完整单晶形貌的粉体。Christensen A等[22]由第一性原理计算得到的3种不同晶型ZrO2的不同晶面的表面能见表1,表1中还列出了Na S H等[23]以理论计算得到的ZnO的表面能作为对比。由表可见ZrO2的表面能较ZnO高很多,且单斜相的表面能较四方相和立方相更高。
但是ZrO2在催化、表面化学等领域却是非常活泼的物质,它是惟一一种表面既有酸性中心又具有碱性中心的物质。其表面酸性中心既有Brönsted(B)酸位,也有Lewis(L)酸位。其中B酸位是较靠近外层的,而L酸位是靠近内层的。B酸位的出现是表面的Zr4+由于晶格断裂而产生悬空键,这一悬空键需要被补偿中和,从而能够吸附空气中的羟基(-OH)而产生表面Zr-O-H,这一结构中,由于Zr-O键很强,吸附后就很难再从表面直接移除,当有碱性的分子接触时将优先提供质子,从而显示出B酸位的性质。同时如果表面是与水分子相互作用,水分子除离解出一个羟基,还有一个质子,这一质子也可与ZrO2表面附近的O结合,产生一个能释放质子的B酸位,如图3所示。而表面的L酸性位置,则来源于未吸附羟基的Zr4+,这种离子在悬空键未被补偿的情况下先与碱性分子接触,由于Zr4+的强的静电力,将表现出强的接收或形成孤对电子的能力,从而表现出L酸位性质。所以ZrO2在经过潮湿气氛后,表面的酸位将以B酸位为主,而如果未经过湿气氛即测试表面的酸位,将主要以L酸位为主,而且B酸的位置将更靠近ZrO2的外表面。ZrO2表面的碱性位置则来源于表面的O2-离子,其本质同样是表面未形成完整晶格的悬空键在O的表面将表现出碱性,这一碱性是由于O2-能够接受酸性分子的质子,而呈B碱位置。但一般来说,ZrO2表面的酸性要强于碱性。对表面酸性的检测可用在表面吸附碱性的吡啶、NH3分子后用红外光谱来检测,而对碱性的检测可用在表面吸附酸性的CO2分子后检测[24]。
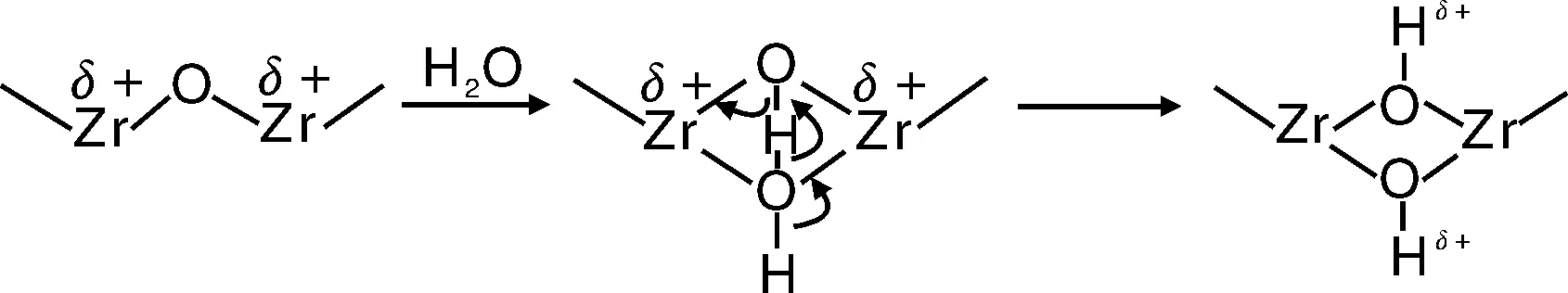
图3 ZrO2表面Brönsted酸位的产生原理示意图,其中δ表示酸位置Fig.3 Brönsted acid sites on surface of ZrO2, δ stands for the acidic sites
从不同晶型的ZrO2表面性质研究结果来看,单斜结构的ZrO2表面酸性和碱性均强于t和c结构的。这是由于m-ZrO2中的Zr4+是7配位的,比t和c相中的Zr4+的配位数少一个,故而其中的Zr4+有更多的电荷数和更高的电荷密度,对O2-的静电力更强,从而表现出更强的B酸和L酸性质。同样由于7配位的事实,m-ZrO2同样有更强的接收孤对电子的能力,从而表现出比其他两种晶型更强的碱性。
3.3 ZrO2的催化性质
利用ZrO2的双重性质,即可用它来制备高效的催化剂。现有的文献分析来看,ZrO2催化剂有直接作为催化剂的,更多的是以它为基质负载其它的催化中心来合成高效催化剂,广泛应用于石油加氢催化、异构重整、裂解、烷化、酰化、醚化、环化、浓缩等领域[25]。而纳米材料的兴起也为ZrO2基高效催化剂的开发与研究提供了新的思路,结合催化材料的特点和纳米材料的高比表面积、高活性等性质,可以预计,将催化剂载体和活性中心制成纳米材料后将可使用更少的催化剂或活性中心,获得更高的催化效率,取得更好的催化结果。以下分别综述ZrO2基(纳米)催化剂的类别和特点,并略举例进行说明。
3.3.1 纯ZrO2催化剂
ZrO2的化学稳定性好,在催化领域它既可以单独作为催化剂使用,也可以以载体或助剂的角色出现。纳米ZrO2由于粒子尺寸小,而使其比表面积大大增加,作为催化剂及其载体,可使催化性能大大提高。ZrO2单独作为催化剂即具有较强的酸性及高的热稳定性,可用于选择催化、烯烃加氢、缩合反应等[26]。Maehashi等发现ZrO2是性能优良的异构合成催化剂,能够选择性地催化合成异丁烯。李映伟等[27]研究了纳米ZrO2催化一氧化碳加氢合成异丁烯的反应,认为纳米ZrO2的制备方法对ZrO2的物理性质和催化性能有较大的影响。用超临界流体干燥并在流动N2气氛中焙烧制得的ZrO2催化剂,对异丁烯具有较高的选择性。当加入Al2O3和KOH助剂时,表现出非常优良的助剂效应,在大幅度提高催化剂对i-C4烃选择性的同时,仍然保持了同样高的催化活性。刘欣梅等[28]提出了一种独特的固态反应-结构导向合成技术,成功地解决了纳米介孔ZrO2的合成,得到了纳米尺度均一、介孔结构丰富的新型材料,这种纳米介孔ZrO2显示出了优越的吸附与催化性能。Watanabe M[29]研究了在超临界水中,以ZrO2作催化剂催化生物体中的葡萄糖和纤维素加氢的反应。在同样条件下,对比了只加碱金属,不加催化剂的实验。结果表明,用ZrO2作催化剂时加氢产量增加了2倍。Liu X M等[30]将纳米ZrO2催化剂应用于CO2加氧生成甲醇的反应,实验结果表明,CO2表现出很高的转化率,使用纳米ZrO2为催化剂制备甲醇,同时也表现出很高的选择性。
3.3.2 ZrO2负载型催化剂
这种催化剂的设计目的是将催化活性中心负载于ZrO2粉体、介孔孔道、陶瓷的表面,用于适应于催化目标的负载型催化剂。一般情况下,催化剂载体在催化反应中一般有下述几方面作用[31]:①增大有效表面积和提供合适的孔结构;②提高催化剂的机械强度,包括耐磨性、硬度、抗压强度和耐冲击性等;③提高催化剂的热稳定性;④提供催化反应的活性中心;⑤与活性组分作用形成新的化合物;⑥增加催化剂的抗毒性能,降低对毒物的敏感性;⑦节省活性组分用量,降低成本。由此可见,ZrO2的高热稳定性、高化学稳定性等特点完全可以满足作为载体的要求,并可利用ZrO2独特的酸碱性质优势,加快反应的进行。现有的研究结果也显示以ZrO2为基础的负载型催化剂具有很多独特的优势。
3.3.2.1 ZrO2基固体超强酸
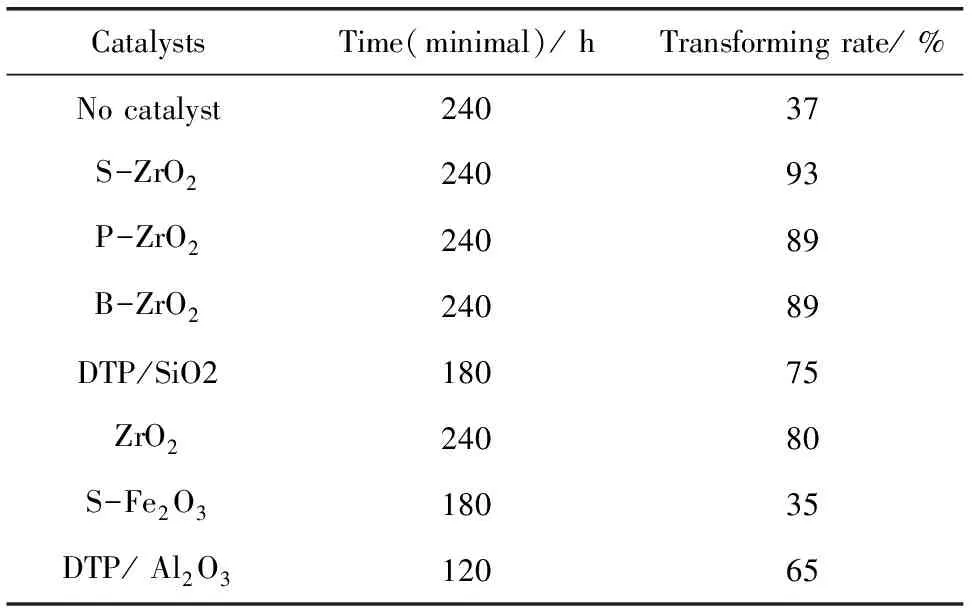
表2 不同固体超强酸催化邻苯二甲与2-乙基己醇酯化反应的效果对比(单酯∶2-乙基己醇 = 1∶1;温度 195 ℃;催化剂用量w=1.2%)

3.3.2.2 其它ZrO2负载催化剂
程时标等[38]采用具有酸碱双功能特性的ZrO2作催化剂载体,以B2O3作催化剂,进行了气相Beckmann重排反应研究。试验结果表明,该催化剂有很高催化活性(97.7%)和己内酰胺选择性(97.0%)。以ZrO2作为载体的催化剂的催化活性优于以A12O3、SiO2、TiO2和MgO等作载体的。他们认为这与ZrO2载体本身具有独特的酸碱双功能特性有密切关系。Lindström B等[39]将ZrO2负载Cu应用于合成甲醛的反应中,同时把Zr催化剂与Cr催化剂相比较,在低于240 ℃下,含Cr和Zr的催化剂对CO2选择性几乎相同,基本上在90%~95%,但随着温度升高,含Zr的CO2选择性仍然高于90%,而含Cr的选择性低至77%。不管催化剂中含铜率高或低,含Zr的催化剂都对CO2有高的选择性。
以纳米ZrO2为载体,铜为活性组分,常被用于CO/H2及CO2/H2合成醇反应,与其他载体(ZnO、A12O3、SiO2和TiO2)相比,均呈现出较好的活性和很高的选择性,特别是对CO2/H2反应的效果更佳[40]。合成气制甲醇是强放热反应,工业上采用Cu/ZnO/A12O3作为催化剂,反应温度较高,合成气必须循环使用,造成能耗高。而用ZrO2作载体的催化剂则可避免这些缺点,在反应中ZrO2使Cu和ZnO高度分散,稳定低价态的反应活性中心,阻止活性组分的迁移和聚集,从而提高催化剂的稳定性,延长催化剂的寿命[41]。
Garcia E A等[41]在423 K~503 K时将Fe,Mn加入硫酸锆里,通过脉冲反应考察对丁烷的转化率的影响,分析了Mn对Fe在氧化锆上的分散性的影响。在含2%Fe的试样中,丁烷异构化活性在Mn含量超过0.65%时随Fe/Mn摩尔比下降而下降。
Gtlerrero S等[42]考察了高比表面积ZrO2负载Pd催化剂对甲烷氧化反应的影响。通过氯化氧锆和NaOH的沉淀反应制备的ZrO2比表面积高达224 m2·g-1,其在高温下相对稳定。与通过氢氧化铵沉淀氯化氧锆得到的ZrO2相比,其负载Pd催化剂对甲烷燃烧表现出更高的转换效率。同时发现,将商业氢氧化锆通过NaOH回流处理,得到的ZrO2加热到700 ℃时,仍具有稳定的高比面积(157 m2·g-1),与其它任何方法制备的ZrO2相比,其负载的Pd催化剂呈现出最好的分散性和最高的催化活性[43]。
3.3.3 ZrO2复合型催化剂
与单一的氧化物相比,复合氧化物通常具有更大的比表面积、更好的热稳定性和机械强度以及更强的表面酸碱性,故对于许多催化剂,以复合氧化物作载体往往比以单一氧化物作载体具有更好的催化性能[44]。比如TiO2在低温(400 ℃)活化时具有一定的酸性,但在高温活化时这些酸性位就会消失。在高温下,Ti4+会被还原成Ti3+,从而产生了供电子的L碱位。TiO2-ZrO2的表面酸碱性均大于纯TiO2和纯ZrO2的,且随Ti/Zr摩尔比的变化而改变,多数研究结果表明,当Ti/Zr=1时,TiO2-ZrO2复合催化剂表面的酸度和碱度均达到最大值。
3.3.3.1 CeO2-ZrO2固溶体催化剂
ZrO2与氧化铈(CeO2)复合或固溶形成的CeO2-ZrO2(CZ)固溶体材料是一种在环保领域具有极其重要应用价值的三效催化剂(TWC),主要应用于汽车尾气催化分解净化领域。所谓的TWC是基于在CeO2基材料中具有可逆氧化-还原性能优越的Ce3+/Ce4+离子对,通过这一离子对的反应,汽车尾气中有害的NOx、COy和CHz可以在不需要额外提供新的空气、氧气或提高空燃比的条件下被催化转化为对环境危害很小的CO2,N2和H2O[45]。考虑到CeO2基催化材料在作为TWC应用的时候都有较高的环境温度(一般尾气的出缸温度会高于700 ℃),这些催化材料的热稳定性、化学稳定性以及结构稳定性是决定它们的催化性能的关键因素。近10年的研究发现,如果将Zr4+引入CeO2晶格,将可以大大增加后者在高温时的结构稳定性并提高TWC的催化性能[46],而掺入ZrO2后形成的ZrO2-CeO2固溶体(CZ)已被大量研究[47]。结果发现:CZ催化剂比CeO2有更低的开始反应温度、更高的离子移动率、更大的氧储存容量(Oxygen Storage Capacity,OSC)和放氧能力[48],即使只加入5%的ZrO2,释氧性能也显著提高[49]。这些优势来源于在CZ固溶体中,氧有更高的晶格移动能力,而这能力则来源于CZ固溶体的晶格有一定的变形,使得氧离子比在纯CeO2中更容易从晶格中脱出参与反应,不仅在表面的氧离子、而且在晶体内部的氧离子也可以参与氧化还原反应。而在纯CeO2中,通过同位素跟踪技术证明只有表面的氧离子才参与反应[50]。
为了进一步优化CZ材料的催化性能,很多文献已报道了使用不同制备方法合成的不同成分的CZ固溶体,各种检测手段也用于检测产物的结构和催化性能,并研究催化机理,常用XRD与Raman光谱表征CZ的结构,而常用程序升温还原(TPR)、程序控温脱附(TPD)和傅利叶变换红外光谱来检测CZ的催化活性[51]。通过上述的检测手段和系统的研究,现在已基本认同的是CZ材料的制备方法以及后续的处理手段均可以显著地影响材料的结构与性能。还有一些研究则注重建立一种CZ的结构与性能的关系,但是这一工作是较麻烦的,因为CZ的结构虽与ZrO2的结构类似,但是更复杂。如一个CZ材料样品中可能会同时存在m相、c相、t相和t′相,甚至还可能出现另一种亚稳态四方结构的t″相[52],如CeO2-ZrO2的二元系统相图上(图4a)虚线所示[53]。图4b是早在1966年发表的CeO1.5-ZrO2的二元系统相图,即还原后的纯Ce2O3与ZrO2的二元相图[53]。图4b中显示,A型纯Ce2O3为六方的结构。在CeO1.5含量为5%~44%范围内,在高温下可形成连续的富Zr的立方相固溶体,但是低温下将发生分解,分解后的相组成将随原料配比有变化。而在CeO1.5含量为44%~55%范围内,有一个P相,即烧绿石相,在CeO1.5含量为81%~86%范围内有一个C2相,即两者形成的富Ce的立方相固溶体。最新研究结果还显示,在CZ样品被深度还原的时候可能会出现一种还原度更低的烧绿石结构(P-II),而这种烧绿石结构在重新缓慢氧化的时候还有可能获得一种称为k相的CZ物质,但可能由于当时的研究水平有限,并没有在图4b中绘出后两种结构[54]。Monte R D等[55]系统地综述了CZ材料的结构与性能,列出了不同Ce含量的样品的还原深度,并提出了一种在还原过程中的结构变化过程模型。而其另一篇综述报道了CZ样品在热处理过程中的原位XRD图谱,说明了在热处理过程中,CZ样品会有一定的晶格收缩[56]。
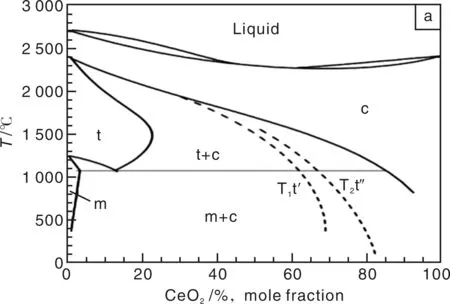
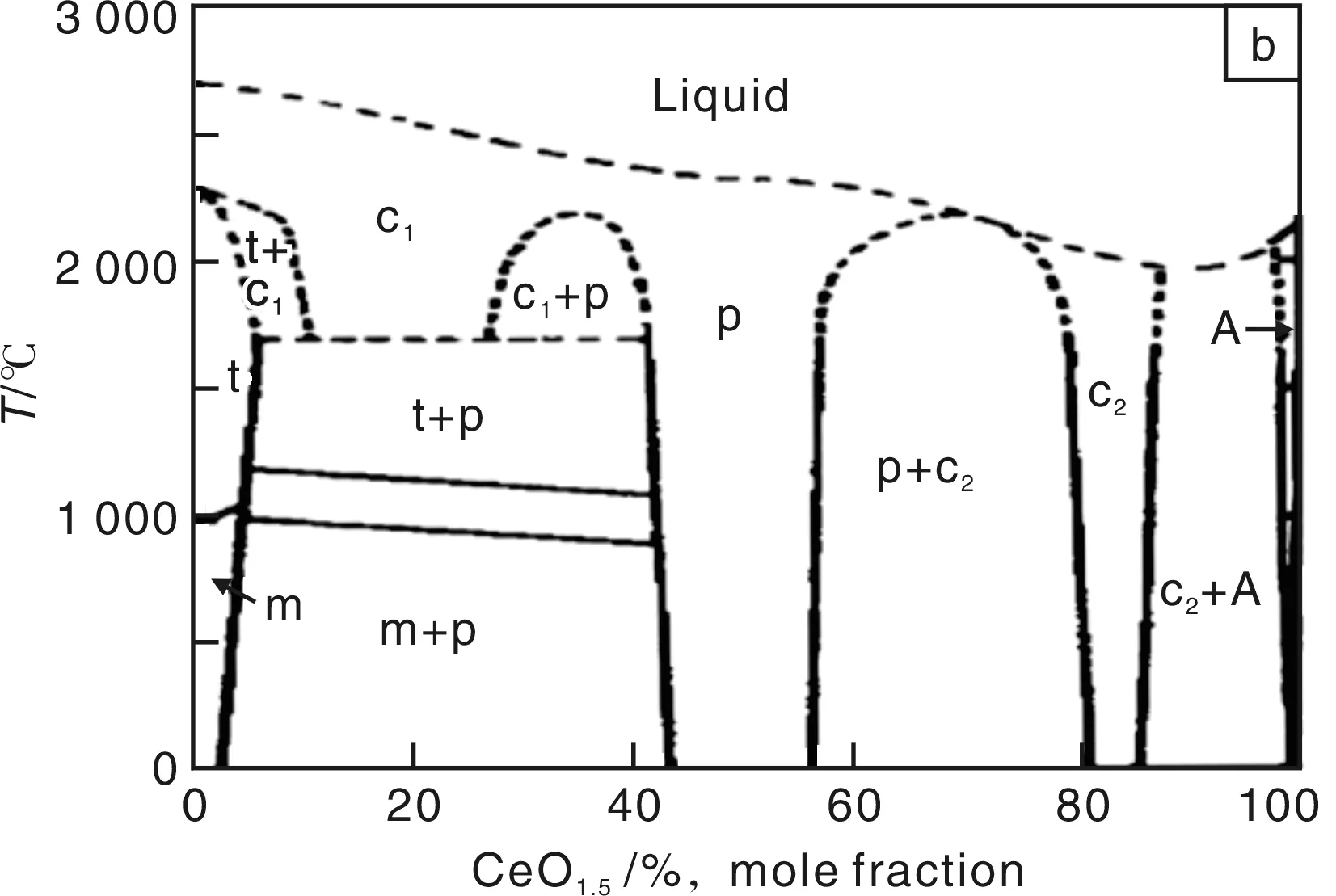
图4 (a)CeO2-ZrO2和(b)CeO1.5-ZrO2的二元系统相图Fig.4 Phase diagrams of the (a) CeO2-ZrO2 and (b) CeO1.5-ZrO2 systems
通常测定被还原后的结构需要结合XRD谱以及对谱进行Rietveld结构精修[58],从已报道的结果来看,研究人员主要研究纯的CZ固溶体或纯的烧绿石材料(即被完全还原后的CZ材料),几乎没有报道过从立方(或四方)相向烧绿石结构的转变过程和中间状态。关于氧离子在交换过程中的重复能力到底如何还有待验证,只有Reddy等人[58]报道了在还原过程中的可逆质量变化,但是基本的结构和条件参数变化不明确。
作者所在课题组[59]以溶剂热法制备了一系列成分逐渐变化的CeO2-ZrO2固溶体和混合氧化物粉体,采用典型的和自行设计的检测方法对所获材料进行了氧化-还原性质表征。根据TPR和OSC检测结果,认为CeO2∶ZrO2=1∶1是较合适作为与氧储存有关的材料,并对这一样品进行了大量的检测和分析,结果发现,CZ具有完全可逆的氧吸附-脱附能力,说明CZ有关的材料可以用于氧储存、氧缓冲和三效催化等。经严格还原后,Ce0.5Zr0.5O2样品的OSC在所有样品中有最大值,达到0.44 mol O2/mol Ce,而相关的机理分析得出,达到这一OSC值的前提就是将CZ固溶体还原成具有烧绿石(P-II)结构的材料。
虽然CZ用于TWC的机理已基本清晰,但一些细节的原理还有待研究,如催化反应过程中的机理、催化剂的结构转变及其机理尚有争议,如何更好地提升催化剂的性能等还有待开发。在环保要求越来越高、然而汽车数量却在持续指数增加的今天,开发尾气催化净化的材料将具有广阔前景。
3.3.3.2 其它类型的ZrO2复合材料
Sun W等[60]采用反相微乳液法制备了WO3/ZrO2纳米催化剂,将其应用于固定床的反应,并与使用溶胶-凝胶法制备的催化剂进行对比,结果表明:反相微乳液法制得的催化剂有更高的反应活性和酸性。Tajima M等[61]研究了TiO2-ZrO2负载的不同金属(V,M,Mo,Fe,Mn,Co和Ni)氧化物催化剂对CFC113分解反应的催化性能。结果表明,WO3/TiO2-ZrO2催化剂具有最高的活性及稳定性,在350 ℃时CFC113的转化率可达90%,而且反应70 h转化率基本无变化。活性提高的原因主要是负载氧化钨后催化剂的酸性得到增强。但CFC113在WO3/TiO2-ZrO2催化剂上会生成与CO2等量的CO,若加入一定量的Pt/TiO2-ZrO2催化剂,则可大大降低反应产物中CO的产率(<5%),且在反应150 h内CFC113的转化率可始终保持在95%。Maity S K等[62]将Mo/TiO2-ZrO2催化剂用于噻吩加氢脱硫和四氢呋喃加氢脱氧反应,其催化活性均明显大于Mo/TiO2和Mo/ZrO2,并且当载体中的Zr/Ti=65/35时,两个反应的活性均达到最大值。氧化锡(SnO2)是优良的气敏材料,将SnO2掺杂在ZrO2基体上可以制作气体探测器。Selim M S[63]将制得的SnO2-ZrO2薄膜用于H2S气体探测,响应时间小于10 s,灵敏度大于99%,恢复时间小于5 min。
4 结 语
随着热障涂层工作温度的不断提高,如何获得性能更可靠、寿命更长的热障涂层将是研究人员所面临的巨大挑战;选用更好的ZrO2稳定剂和更好的隔热材料,从材料、结构、工艺入手进一步提高TBC的抗热震性能和隔热效果,将是未来TBC研究的重点;而开发新的高性能TBC制备技术、优化现有的EB-PVD、等离子体喷射沉积设备,获得改善提高材料性能的工艺也是工程技术人员的一大课题。
ZrO2的化学性质与其应用是除陶瓷类应用外的另一大领域,其独特的双重酸、碱性表面决定了其在催化领域的不可替代的地位,ZrO2基催化材料具有重要的发展前景。开拓ZrO2的新催化领域、研发新型复合催化材料等方面仍将有大量工作要做,研讨ZrO2在新型催化剂中的作用与地位、探究ZrO2的结晶形态与化学性质的关系、结合第一原理计算催化机理、基于ZrO2设计与制备新催化材料等领域具有广阔的发展前景,也是有可能实现新的突破的领域,需要广大科研工作者投入大量的精力开展研究。
参考文献 References
[1]Zirconia(锆)[EB/OL]. (2013-12-05)[2013-12-10]http://www.chazidian.com/baike/904572/.
[2] Cao X Q, Vassen R, Stoever D. Ceramic Materials for Thermal Barrier Coatings[J].JEurCeramSoc, 2004, 24(1): 1-10.
[3] Lin Feng(林 锋), Jiang Xianliang(蒋显亮). 热障涂层的研究进展[J].FunctionalMaterials( 功能材料), 2003, 34(3): 254-261.
[4] Ding Zhangxing(丁彰雄). 热障涂层的研究动态及应用[J].ChinaSurfaceEngineering(中国表面工程), 1999, (2): 31-37.
[5] Wang Liqiang(王利强), Yan Dianran(阎殿然), He Jining(何继宁),etal. 热障涂层研究状况及进展[J].TheNewTechnologyandNewProcess(新技术新工艺), 2002, (3): 34-36.
[6] Zhu C, Li P, Javed A,etal. An Investigation on The Microstructure and Oxidation Behavior of Laser Remelted Air Plasma Sprayed Thermal Barrier Coatings[J].Surface&CoatingsTechnology, 2012, 206(18): 3 739-3 746.
[7] Wang Y Z, Wu W, Hua J J,etal. Microstructure Characterization and Thermal Conductivity Analysis of Plasma Sprayed ZrO2Coatings[J].JInorgMater, 2012, 27(5): 550-554.
[8] Song Xiwen(宋希文),Yu Haitao(于海涛), Niu Xiaoqing(牛晓庆),etal. 稀土掺杂ZrO2基热障涂层陶瓷材料研究进展[J].JournalofInnerMongoliaUniversityofScienceandTechnology(内蒙古科技大学学报), 2009, 28(3): 287-292.
[9] Wang H, Dinwiddie R B. Characterization of Thermal Barrier Coatings Using Thermal Methods[J].AdvFunctMater, 2001, 3(7): 465-468.
[10] Schulz U, Leyens C, Fritscher K,etal. Some Recent Trends in Research and Technology of Advanced Thermal Barrier Coatings[J].AerospaceScienceandTechnology, 2003, 7: 73-80.
[11] Clarke D R. Materials Selection Guidelines for Low Thermal Conductivity Thermal Barrier Coatings[J].SurfaceandCoatingsTechnolory, 2003, 163: 67-74.
[12] Stöver D, Pracht G., Lehmann H,etal. New Material Concepts for The Next Generation of Plasma Sprayed Thermal Barrier Coatings[J].JThermSprayTechnol, 2004, 13(1): 76-83.
[13] Ji Xiaojian(纪小健), Li Hui(李 辉),Li Zhuexin( 栗卓新),etal. 热障涂层的研究进展及其在燃气轮机的应用[J].GasTurbineTechnology(燃气轮机技术), 2008, (21): 2.
[15] Cao X, Vassen R, Fischer W,etal. Lanthanum-Cerium Oxide as A Thermal Barrier-Coating Material for High-Temperature Applications[J].AdvMater, 2003, 15(17): 1 438-1 442.
[16] Lee C H, Kim H K, Choi H S. Phase Transformation and Bond Coat Oxidation Behavior of Plasma-Sprayed Zirconia Thermal Barrier Coating[J].SurfCoatTechnol, 2000, 124(1):1-12.
[17] Dai H, Zhong X, Li J,etal. Thermal Stability of Double-Ceramic-Layer Thermal Barrier Coatings with Various Coating Thickness[J].MaterialsScienceandEngineering:A, 2006, 433(1-2): 1-7.
[18] Matsumoto M, Aoyama K, Matsubara H,etal. Thermal Conductivity and Phase Stability of Plasma Sprayed ZrO2-Y2O3-La2O3Coatings [J].SurfCoatTechnol, 2005, 194(1): 31-35.
[19] Liu Chunbo(刘纯波), Lin Feng(林 锋),Jiang Xianliang( 蒋显亮). 热障涂层的研究现状与发展趋势[J].TheChineseJournalofNonferrousMetals(中国有色金属学报), 2007, 17(1): 1-13.
[20] Chen Xiaowen(陈小文), Bai Xinde(白新德), DengPingye(邓平晔),etal. 升温条件下Zr-H2O系电位-pH平衡图[J].RareMetalMaterialsandEngineering(稀有金属材料与工程), 2004, (7): 43-46.
[21] Dean J A.Lange’SHandbookofChemistry[M]. New York: Mcgraw-Hill, 1999.
[22] Christensen A, Carter E A. First-Principles Study of The Surfaces of Zirconia[J].PhysRevB, 1998, 58(12): 8 050-8 064.
[23] Na S H, Park C H. First-Principles Study of The Surface of Wurtzite Zno and Zns -Implications for Nanostructure Formation[J].JournalofTheKoreanPhysicalSociety, 2009, 54(2): 867-872.
[24] Zhao Yubao(赵玉宝), Li Wei(李 伟), Zhao Minghui(张明慧),etal. ZrO2晶相对 Mo基纳米结构 ZrO2加氢脱硫催化剂活性的影响[J].ActaPetroleiSinica(PetroleumProcessing)(石油学报) (石油加工), 2002, 18(5): 21-27.
[25] Yadav G D, Nair J J. Sulfated Zirconia and Its Modified Versions as Promising Catalysts for Industrial Processes[J].MicroporousandMesoporousMaterials, 1999, 33: 1-48.
[26] Rao Xiaoxiao(饶晓晓), Hu Shubing(胡树兵). 纳米ZrO2应用现状及前景研究[J].MaterialsReview(材料导报), 2007, 21(feature viii): 143-146.
[27] Li Yangwei(李映伟), He Dehua(贺德华), Yuan Yubin(袁余斌),etal. 纳米二氧化锆催化剂上一氧化碳加氢合成异丁烯[J].ChineseJournalofCatalysis(催化学报), 2002, 23(2): 185-190.
[28] Liu Xinmei(刘欣梅), Yan Zifeng(阎子峰), Lu G Q. 介孔纳米二氧化锆的微观结构及其应用[J].ChineseScienceBulletin(科学通报), 2004, 49(6): 522-527.
[29] Watanabe M, Inomata H, Arai K. Catalytic Hydrogen Generation from Biomass (Glucose and Cellulose) with ZrO2in Supercritical Water [J].BiomassBioenergy, 2002, 22(5): 405-410.
[30] Liu X M, Lu G Q, Yan Z F. Nanocrystalline Zirconia as Catalyst Support in Methanol Synthesis[J].ApplCatal,A-Gen, 2005, 279(1-2): 241-245.
[31] Yang Shumei(杨淑梅),Deng Shuhua( 邓淑华), Huang Huimin(黄慧民),etal. 二氧化锆负载催化剂的应用[J].IndustrialCatalysis(工业催化), 2003, 11(10): 39-43.
[32] Liao Liewen(廖列文), Zhu Xuewen(朱学文), Zhang Mingyue(张明月),etal. 无机功能材料二氧化锆的应用及研究进展[J].GuangdongChemical(广东化工), 2001, (6): 2-4.
[33] Armelao L, Eisenmenger-Sittner C, Groenewolt M,etal. Zirconium and Hafnium Oxoclusters as Molecular Building Blocks for Highly Dispersed ZrO2or HfO2Nanoparticles in Silica Thin Films[J].JMaterChem, 2005, 15(18): 1 838-1 848.
[34] Yadav G D, Sengupta S. Friedel-Crafts Alkylation of Diphenyl Oxide with Benzyl Chloride over Sulphated Zirconia[J].OrgProcessResDev, 2002, 6(3): 256-262.
[35] Srinivasan R, Keogh R A, Davis B H. Sulfated Zirconia Catalysts: Are Brønsted Acid Sites The Source of The Activity? [J].CatalLett, 1996, 36(1-2): 51-57.
[37] Baidu Encyclopaedia(百度百科).SolidSuperAcid(固体超强酸) [EB/OL]. (2013-4-18) [2013-12-20]. http://baike.baidu.com/view/408485.htm.
[38] Cheng Shibiao(程时标), Xu Boqing(徐柏庆), Wu Wei(吴 巍). 制备方法对B2O3/ZrO2催化剂织构及其催化性能的影响[J].ActaPetroleiSinica(PetroleumProcessing)(石油学报)(石油加工), 2002, 18(4): 1-8.
[39] Lindström B, Pettersson L J. Hydrogen Generation by Steam Reforming of Methanol over Copper-Based Catalysts for Fuel Cell Applications[J].IntJHydrogenEnergy, 2001, 26(9): 923-933.
[40] Liu Lijuan(刘丽娟), Wang Jikui(王济奎). 纳米二氧化锆催化剂的制备与应用[J].AdvancesinFinePetrochemical(精细石油化工进展), 2005, 6(8): 46-48.
[41] Cortright R D, Dumesic J A.Low-TemperatureHydrocarbonProductionfromOxygenatedHydrocarbons: US, 20030220531[P]. 2003.
[42] Guerrero S, Araya P, Wolf E E. Methane Oxidation on Pd Supported on High Area Zirconia Catalysts[J].ApplCatal,A-Gen, 2006, 298(1): 243-253.
[43] Wang Guoying(王国营), Shao Zhongcai(邵忠财), Gao Jinglion(高景龙),etal. 纳米氧化锆在催化领域中的应用[J].ChemicalIntermediates(化工中间体), 2007, (11): 24-28.
[44] Mao Dongsen(毛东森), Lu Guanzhong(卢冠忠), Chen Qingling(陈庆龄). 钛锆复合氧化物载体的制备、物化性质及在催化反应中的应用[J].ChineseJournalofCatalysis(催化学报), 2004, 25(6): 501-510.
[45] Fernandez-Garcia M, Martinez-Arias A, Iglesias-Juez A,etal. Structural Characteristics and Redox Behavior of CeO2-ZrO2/Al2O3Supports[J].JCatal, 2000, 194(2): 385-392.
[46] Dimonte R, Fornasiero P, Desinan S,etal. Thermal Stabilization of CexZr1-xO2Oxygen Storage Promoters by Addition of Al2O3: Effect of Thermal Aging on Textural, Structural, and Morphological Properties[J].ChemMater, 2004, 16(22): 4 273-4 285.
[47] Hernandez J C, Hungria A B, Perez-Omil, J A,etal. Structural Surface Investigations of Cerium-Zirconium Mixed Oxide Nanocrystals with Enhanced Reducibility[J].JPhysChemC, 2007, 111(26): 9 001-9 004.
[48] Fernandez-Garcia M, Wang X, Belver C,etal. Ca Doping of Nanosize Ce-Zr And Ce-Tb Solid Solutions: Structural and Electronic Effects[J].ChemMater, 2005, 17(16): 4 181-4 193.
[49] Abdollahzadeh-Ghom S, Zamani C, Andreu T,etal. Improvement of Oxygen Storage Capacity Using Mesoporous Ceria-Zirconia Solid Solutions[J].ApplCatal, B, 2011, 108(1-2): 32-38.
[50] Madier Y, Descorme C, Le Govic, A M,etal. Oxygen Mobility in CeO2and CexZr(1-x)O2Compounds: Study by Co Transient Oxidation and18o/16o Isotopic Exchange[J].JPhysChemB, 1999, 103(50): 10 999-11 006.
[51] Atribak I, Such-Basanez I, Bueno-Lopez A,etal. Comparison of The Catalytic Activity of MO2(M=Ti, Zr, Ce) for Soot Oxidation Under NOx/O2[J].JCatal, 2007, 250(1): 75-84.
[52] Ahniyaz A, Watanabe T, Yoshimura M. Tetragonal Nanocrystals from The Zr0.5Ce0.5O2Solid Solution by Hydrothermal Method[J].JPhysChemB, 2005, 109(13): 6 136-6 139.
[53] Varez A, Garcia-Gonzalez E, Sanz J. Cation Miscibility in CeO2-ZrO2Oxides with Fluorite Structure. A Combined TEM, SAED and XRD Rietveld Analysis[J].JournalofMaterialsChemistry, 2006, 16: 4 249-4 256.
[54] Yeste M P, Hernandez J C, Bernal S,etal. Redox Behavior of Thermally Aged Ceria-Zirconia Mixed Oxides. Role of Their Surface and Bulk Structural Properties[J].ChemistryofMaterials, 2006, 18(11): 2 750-2 757.
[55] Monte R D, Kaspar J. Nanostructured CeO2-ZrO2Mixed Oxides[J].JMaterChem, 2005, 15(6): 633-648.
[57] Omata T, Kishimoto H, Otsuka-Yao-Matsuo S,etal. Vibrational Spectroscopic and X-Ray Diffraction Studies of Cerium Zirconium Oxides with Ce/Zr Composition Ratio=1 Prepared by Reduction and Successive Oxidation of T′-(Ce0.5Zr0.5)O2Phase[J].JSolidStateChem, 1999, 147(2): 573-583.
[58] Reddy B M, Lakshmanan P, Bharali P,etal. Influence of Alumina, Silica, and Titania Supports on The Structure and Co Oxidation Activity of CexZr1-xO2Nanocomposite Oxides[J].JPhysChemC, 2007, 111(28): 10 478-10 483.
[59] Ouyang J, Yang H, Tang A. Investigation of The Oxygen Exchange Property and Oxygen Storage Capacity of CexZr1-xO2Nanocrystallites[J].JPhysChemC, 2009, 113(17): 6 921-6 928.
[60] Sun W, Xu L, Chu Y,etal. Controllable Synthesis, Characterization and Catalytic Properties of WO3/ZrO2Mixed Oxides Nanoparticles[J].JColloidInterfaceSci, 2003, 266(1): 99-106.
[61] Tajima M, Niwa M, Fujii Y,etal. Decomposition of Chlorofluorocarbons on W/TiO2-ZrO2[J].ApplCatal,B-Environ, 1997, 14(1-2): 97-103.
[62] Maity S K, Rana M S, Bej S K,etal. TiO2-ZrO2Mixed Oxide as A Support for Hydrotreating Catalyst[J].CatalLett, 2001, 72(1-2): 115-119.
[63] Selim M S. Room Temperature Sensitivity of SnO2-ZrO2Sol-Gel Thin Films[J].SensActuators,A, 2000, 84(1-2): 76-80.
