地塞米松促进人甲状腺滤泡上皮原代细胞凋亡
2014-08-28郭慕红毛晓明
何 珂,胡 蕴,郭慕红,张 斌,姜 鹏,毛晓明*
(南京医科大学附属南京医院南京市第一医院1.内分泌科;2.普外科,江苏南京210012)
地塞米松是一种常用的糖皮质激素,具有较强的抗炎、抗过敏及免疫抑制作用,在甲状腺相关自身免疫性疾病的治疗中占有重要地位。它可以抑制甲状腺激素的合成与释放,显著改善甲亢患者的一般状况,被广泛用于严重甲状腺功能亢进症,尤其是甲状腺危象的治疗中。在Graves病等甲状腺相关自身免疫性疾病中,地塞米松甲状腺局部注射可以调节T淋巴细胞平衡,改善T调节细胞功能,发挥免疫调节作用[1-2]。研究发现,地塞米松可以诱导淋巴细胞、嗜酸性细胞、成骨细胞等发生凋亡,在调节机体生理功能中发挥重要作用[3-5]。但是,地塞米松是否能直接影响甲状腺滤泡上皮细胞本身的凋亡,机制目前尚不明确。本研究拟研究地塞米松对甲状腺滤泡上皮细胞凋亡的影响,探讨地塞米松在甲状腺稳态和甲状腺相关疾病治疗中的作用。
1 材料与方法
1.1 实验材料
甲状腺组织取自甲状腺腺瘤及甲状腺结节等患者手术标本周边正常的甲状腺。地塞米松(Sigma公司),DMEM高糖培养基(Hyclone公司),胎牛血清、胰蛋白酶、胶原蛋白酶Ⅱ(Gibco公司),4-羟乙基哌嗪乙磺酸(HEPES)(Amresco公司),促甲状腺激素(TSH)(Calbiochem公司),青链霉素、异硫氰酸荧光素(annexin V-FITC)、碘化丙啶(propidium iodide,PI)细胞凋亡检测试剂盒及MTT细胞增殖与毒性检测试剂盒(南京凯基生物科技发展有限公司),实时荧光定量反转录聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)试剂盒(Takara公司)。本研究经南京医科大学附属南京医院(南京市第一医院)伦理委员会批准,患者签署知情同意书。
1.2 甲状腺原代细胞的分离与培养
甲状腺组织取自甲状腺腺瘤及甲状腺结节等患者手术标本周边正常的甲状腺。D-Hanks液反复漂洗甲状腺组织,去除血细胞和杂质,去除甲状腺组织包膜后,将组织剪碎直至呈匀浆状,用消化液(0.25%胰蛋白酶,250 U/mL II型胶原蛋白酶)37℃恒温水浴振荡消化90 min。消化后用200目不锈钢筛网过滤,滤液离心,DMEM洗涤沉淀2~3次,锥虫蓝计数细胞存活率大于90%,培养于含10%胎牛血清的DMEM高糖培养基中,添加青霉素80 U/mL、链霉素 0.08 mg/mL、HEPES 2.975 g/L、促甲状腺激素(thyroid stimulating hormone,TSH)10 mU/L,37℃、5%CO2的恒温培养箱内培养。24 h后换液,冲洗去除未黏附细胞,贴壁细胞即为原代甲状腺滤泡上皮细胞。2~3 d更换培养基1次,每5~7d传代1次。取对数生长期的细胞进行实验。
1.3 地塞米松刺激实验
原代培养的甲状腺滤泡上皮细胞,换以不含或含不同浓度地塞米松的DMEM完全培养基,10-6、10-5和 10-4mol/L 浓度,分别培养 12、24、48 及72 h。
1.4 MTT检测细胞增殖及抑制实验
取对数生长期的甲状腺细胞,以100 μL/孔(约1×104个细胞)接种于96孔板培养。24 h后弃上清,换以不含或含不同浓度地塞米松的DMEM完全培养基行地塞米松刺激实验。每孔加入50 μL 1×MTT液,37 ℃孵育4 h,弃去上清。加入150 μL二甲基亚砜(DMSO),振荡摇匀10 min,酶标仪于490 nm波长处测定每孔吸光度(A值)。
1.5 Annexin V FITC-PI细胞凋亡的检测
取6孔板中各组经不同浓度及不同时间地塞米松刺激后的甲状腺细胞,收集5×105个细胞,冷PBS洗涤细胞2次后,加入500 μL结合缓冲液悬浮细胞,5 μL Annexin V-FITC 和 5 μL PI混匀,避光孵育15 min后,流式细胞仪检测。
1.6 凋亡相关基因mRNA的检测
采用实时荧光定量PCR法。Trizol提取原代培养的甲状腺细胞总RNA,反转录合成cDNA。凋亡相关基因 Bcl2、Bax、caspase3、caspase9、P53、Fas及内参GAPDH引物设计见表1。凋亡基因采用荧光定量PCR扩增检测。

表1 凋亡基因及内参引物序列Table 1 Primer sequences of apoptosis-related gene and GAPDH
1.7 统计学分析
每组实验重复3次或以上,数据采用SPSS17.0软件进行统计学分析。计量资料以均数±标准差±s)表示,两两组间比较采用独立样本t检验。
2 结果
2.1 MTT检测细胞增殖及抑制试验
地塞米松对甲状腺滤泡上皮细胞具有明显的增殖抑制作用,其浓度在0~10-4mol/L之间,作用浓度与A490nm值呈明显负相关,即随着地塞米松浓度增高,活细胞数逐渐减少(表2)。
2.2 Annexin V FITC-PI细胞凋亡的检测
在地塞米松 10-6、10-5和 10-4mol/L 浓度范围内,地塞米松呈剂量依赖性地增加甲状腺细胞的凋亡率(图1,表3)。
2.3 凋亡相关基因mRNA的检测
在0、10-6、10-5和10-4mol/L 浓度范围内,刺激72 h后地塞米松可显著促进甲状腺细胞凋亡相关基因mRNA的表达。随着地塞米松浓度的增高,凋亡抑制基因Bcl2 mRNA表达逐渐下降,而凋亡相关基因 Bax、caspase3、caspase9、P53 及 Fas mRNA 表达均逐渐增高(图2)。
表2 地塞米松不同作用浓度及时间对甲状腺滤泡上皮细胞增殖的影响Table 2 Effect of different concentrations and different acting time of dexamethasone on proliferation of thyroid follicular epithelial cells±s,n=3)

表2 地塞米松不同作用浓度及时间对甲状腺滤泡上皮细胞增殖的影响Table 2 Effect of different concentrations and different acting time of dexamethasone on proliferation of thyroid follicular epithelial cells±s,n=3)
*P <0.05,**P <0.01 compared with 0 mol/L.
dexamethasone concentration(mol/L)±0.027 10-6 0.903±0.009* 1.020±0.013 1.076±0.094 1.210±0.110 10-5 0.993±0.020 0.965±0.032* 1.077±0.001** 1.190±0.080 10-4 0.887±0.113 0.935±0.019** 1.052±0.012** 1.179±0.001 12 hours 24 hours 48 hours 72 hours 0 0.977±0.039 1.049±0.033 1.190±0.010 1.327**
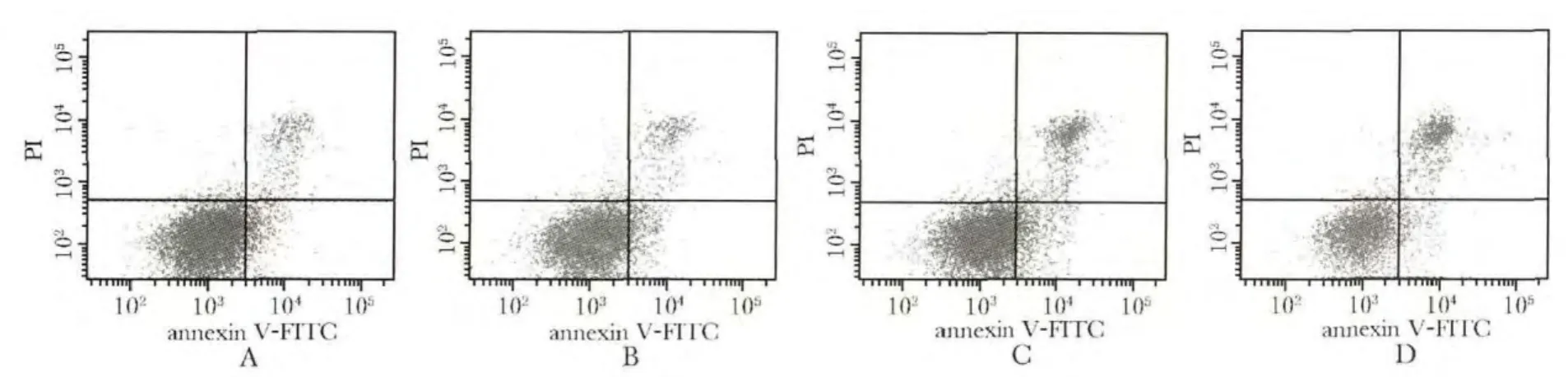
图1 不同浓度的地塞米松对甲状腺滤泡上皮细胞凋亡的影响Fig 1 Effect of different concentrations of dexamethasone on apoptosis of thyroid follicular epithelial cells
表3 地塞米松不同作用浓度及时间对甲状腺滤泡上皮细胞凋亡的影响Table 3 Effect of different concentrations and different time of dexamethasone on apoptosis of thyroid follicular epithelial cells ± s,n=3)

表3 地塞米松不同作用浓度及时间对甲状腺滤泡上皮细胞凋亡的影响Table 3 Effect of different concentrations and different time of dexamethasone on apoptosis of thyroid follicular epithelial cells ± s,n=3)
*P <0.05,**P <0.01 compared with 0 mol/L.
dexamethasone concentration(mol/L)total apoptosis 00 5.60±0.35 2.10±0.30 6.70±0.60 6.60±0.50 10-6 12.10±0.40 13.10±0.60 12.80±0.75 13.20±1.10 5.70±0.40 2.20±0.40 5.50±0.50 6.90±0.45 10-5 13.30 ±0.65 13.30±0.80 19.80±1.30** 19.80±1.70** 4.50±0.20** 4.60±0.45** 9.10±0.65** 9.20±0.70**10-4 13.90±1.60 14.80±0.80* 20.90±3.00* 29.20±2.30** 5.00±0.35 3.60±0.50** 4.20±0.30** 5.90±0.20 dexamethasone concentration(mol/L)urs 48 hours 72 hours 0 11.90±0.60 13.00±0.50 13.10±0.30 11.70±1.early apoptosis 12 hours 24 hours 48 hours 72 hours 12 hours 24 ho interim apoptosis 10±0.15 1.80±0.20 1.30±0.10 0.50±0.00 10-6 5.20±0.40 9.00±0.85 5.80±0.70 4.70±0.40 2.00±0.25** 1.90±0.10 1.50±0.00* 1.60±0.10**10-5 6.80±0.70* 7.20±0.50 9.00±0.70** 9.30±0.70** 1.20±0.10 1.50±0.15 1.70±0.20* 1.30±0.20**10-4 7.80±0.65** 10.10±1.10 14.90±1.30** 21.30±2.10** 1.30±0.15* 1.10±0.00** 1.80±0.20* 2.00±0.40 urs 48 hours 72 hours 0 5.00±0.45 9.10±1.15 5.10±0.50 4.60±0.50 1.late apoptosis 12 hours 24 hours 48 hours 72 hours 12 hours 24 ho**

图2 不同浓度的地塞米松对甲状腺滤泡上皮细胞凋亡基因mRNA表达的影响Fig 2 Effect of different concentrations of dexamethasone on apoptosis-related mRNA expression of thyroid follicular epithelial cells
3 讨论
地塞米松的抗炎、抗过敏及免疫抑制作用与其诱导的体内细胞凋亡有关。本研究在0~10-4mol/L浓度范围内,地塞米松呈剂量依赖性地抑制甲状腺细胞的增殖,增加甲状腺细胞的凋亡率。由于地塞米松还能诱导淋巴细胞、单核巨噬细胞凋亡,在甲状腺稳态的调节中具有重要作用。因此,推测地塞米松对以甲状腺组织内淋巴细胞浸润为特征的Graves病、桥本氏甲状腺炎等可能起到积极的治疗作用,为甲状腺局部注射地塞米松治疗甲状腺相关疾病提供理论依据。
地塞米松等糖皮质激素诱导细胞凋亡的途径目前尚未完全阐明。研究发现,它可以与细胞内特异性的糖皮质激素受体结合,直接触发DNA裂解或激活caspases蛋白酶导致凋亡[6-7]。本研究中,甲状腺滤泡上皮细胞caspase凋亡信号通路中参与凋亡起始的基因caspase9,凋亡执行的基因caspase3 mRNA表达均随地塞米松浓度的升高而升高。此外,其作用还受Bcl2基因家族、肿瘤抑制基因P53等复杂的调控机制和因素的影响[8]。Bcl2和Bax是同一个基因家族中参与调节细胞凋亡的作用相反的独立成员,Bcl2通过多种刺激阻断细胞死亡;而过表达的Bax具有促凋亡作用,并能消除Bcl2的抗凋亡效应[9]。本研究中,随着地塞米松浓度的增高,Bcl2 mRNA表达降低,Bax mRNA表达逐渐升高,Bax/Bcl2比例升高,凋亡增多。Fas基因是重要的死亡基因,其表达产物Fas抗原与FasL结合后可介导多种组织细胞的凋亡[10],地塞米松对凋亡相关基因Fas的表达也有显著调节作用,本研究中,随地塞米松浓度的上升,Fas mRNA表达逐渐上升。
综上所述,在0~10-4mol/L浓度范围内,地塞米松呈剂量依赖性地抑制甲状腺滤泡上皮细胞的增殖,促进甲状腺滤泡上皮细胞凋亡的发生。然而,细胞凋亡在自身免疫性甲状腺疾病发生发展中的具体作用目前仍并不能确定。地塞米松对Graves病和桥本氏甲状腺炎的治疗作用是否源于同一机制也无法定论。因此,有必要进一步探讨地塞米松等糖皮质激素对不同疾病状态的甲状腺滤泡上皮细胞以及甲状腺内淋巴细胞凋亡的影响,为将来更合理更有效地治疗自身免疫性甲状腺疾病提供理论依据。
[1]Mao XM,Li HQ,Li Q,et al.Prevention of relapse of Graves'disease by treatment with an intrathyroid injection of dexamethasone[J].J Clin Endocrinol Metab,2009,94:4984-4991.
[2]Hu Y,Tian W,Zhang LL,et al.Function of regulatory T-cells improved by dexamethasone in Graves'disease[J].Eur J Endocrinol,2012,166:641-646.
[3]Silvestrini G,Ballanti P,Patacchioli FR,et al.Evaluation of apoptosis and the glucocorticoid receptor in the cartilage growth plate and metaphyseal bone cells of rats after highdone treatment with corticosterone[J].Bone,2000,26:33-42.
[4]Pandolfi J,Baz P,Fernández P,et al.Regulatory and effector T-cells are differentially modulated by Dexamethasone[J].Clin Immunol,2013,149:400-410.
[5]Gruver-Yates AL,Quinn MA,Cidlowski JA.Analysis of glucocorticoid receptors and their apoptotic response to dexamethasone in male murine B cells during development[J].Endocrinology,2014,155:463-474.
[6]Carey KT,Tan KH,Ng J,et al.Nfil3 is a glucocorticoidregulated gene required for glucocorticoid-induced apoptosis in male murine T cells[J].Endocrinology,2013,154:1540-1552.
[7]Luo W,Zhang R,Xu Y,et al.WITHDRAWN:Survivin,caspase-3 and caspase-9-activated proteins kinases in apoptosis[J].Int J Biol Macromol,2013.doi:10.1016/j.ijbiomac.2013.04.039.
[8]Phelps E,Wu P,Bretz J,et al.Thyroid cell apoptosis.A new understanding of thyroid autoimmunity[J].Endocrinol Metab Clin North Am,2000,29:375-388.
[9]Martinou JC,Youle RJ.Mitochondria in apoptosis:Bcl-2 family members and mitochondrial dynamics[J].Dev Cell,2011,21:92-101.
[10] Liberman AC,Refojo D,Antunica-Noguerol M,et al.Underlying mechanisms of cAMP-and glucocorticoid-mediated inhibition of FasL expression in activation-induced cell death[J].Mol Immunol,2012,50:220-235.
