塞来昔布诱导人椎间盘细胞表达神经生长因子
2014-08-28陈小明周润梅
陈小明,周润梅,欧 斌,曹 奇
(南华大学1.附属第二医院脊柱外科;2.药学与生命科学学院药物药理研究所,湖南衡阳421001)
腰痛是脊柱外科最常见的疾病,是导致患者丧失劳动力以及致残的重要因素。本病在全世界范围内呈上升趋势,虽然人椎间盘(intervertebral disc,IVD)退行性变性是导致腰痛的主要原因,但其发病机制仍不清楚[1]。正常的IVD无血管和无神经,外部仅有3层纤维环[2]。神经生长因子(nerve growth factor,NGF)是一种由IVD细胞等细胞分泌的神经细胞生长、分化的因子。近年研究显示NGF能刺激外周痛觉神经在IVD组织外部生长,并与痛觉过敏有关。研究显示,炎性细胞因子IL-1β和TNF-α两者均可刺激NGF在人IVD细胞中的表达。但NGF调节IVD的作用机制仍不清楚。硬膜外注射环氧化酶抑制剂是临床上用于治疗腰痛的最常用方法,可有效减少炎性反应以及缓解疼痛[3-4]。本研究旨在探讨塞来昔布是否能影响IL-1β诱导人IVD细胞表达NGF,并对其可能的机制进行初步探讨。
1 材料与方法
1.1 主要实验试剂
塞来昔布(美国辉瑞公司,生产批号652T)。PGE2及 NGF ELISA kit(分别 Cayman Chemical和R&D Systems公司)。IL-1β(Sigma-Adrich 公司)。细胞培养板(Corning公司)。PGE2受体激动剂17-苯基三降8-异前列腺素E2(EP1激动剂)、布他前列素(EP2激动剂),硫前列酮(EP3激动剂)以及利文前列素(EP4前列腺素,均Cayman Chemical公司)。NGF和GADPH的引物对(Qiagen公司)。
1.2 椎间盘细胞的原代分离与培养
人IVD细胞来自南华大学附属第二医院接受外科手术的腰椎管狭窄患者,年龄范围在37~63岁平均(52±14.5)岁。本研究经本院伦理委员会的批准,并在收集组织样本前和患者签署知情同意书。术中获取的椎间盘组织剪碎成1 mm3的小块,反复洗涤后加0.1%链霉蛋白酶消化1~2 h,随后用0.1%胶原蛋白酶振荡过夜。用含有抗生素以及血清的DMEM培养基终止消化,离心弃上清。沉淀用含10%胎牛血清、100 U/mL青霉素和100 U/mL链霉素的DMEM于37℃、5%CO2条件下培养。3 d后换液,去除未贴壁细胞。当细胞增殖至90%左右汇合时进行传代。
1.3 实验分组与处理
IVD细胞分为:1)对照组:仅加入0.1%二甲基亚砜;2)IL-1β组(阳性对照组):加入10 ng/mL IL-1β作用6 h;3)塞来昔布组:IVD细胞与终浓度为1、5和10 mmol/L塞来昔布预孵育30 min,随后同组2)。在研究PGE2及前列腺素受体(EP)激动剂干预实验时,分别采用终浓度为0.1,1和10 μmol/L PGE2,或 10 μmol/L 的 17-苯基三降 8-异前列腺素E2(17-phenyl trinor 8-iso prostaglandin E2,EP1 激动剂)、布他前列素(EP2激动剂)、硫前列酮(EP3激动剂)以及利文前列素(EP4激动剂)与IVD细胞共同孵育6 h,随后加入IL-1β继续孵育6 h。
1.4 乳酸脱氢酶(lactate dehydrogenase,LDH)实验
IVD细胞孵育结束后,对照组细胞4℃1 000 r/min离心5 min,用冻融法裂解处理后的细胞,以评估最大LDH活性;同时获取各处理组培养上清,测量从细胞中自发释放的LDH,并根据试剂盒提供的说明用校正酚红以及血清中内源性LDH活性的影响。随后加入50 μL底物混合物,避光孵育30 min;加入终止液,在490 nm记录吸光度值。LDH漏出率(%)=实验孔LDH释放量(A490)/最大LDH释放量(A490)
1.5 RT-PCR
根据Omega Bio-Tek试剂盒提供的说明,利用Total RNA kit1从细胞内提取总RNA。利用Thermal Cycler Dice Real Time system进行实时定量PCR。采用ΔCt(阈值循环)方法,计算NGF和管家基因GAPDH的相对值。
1.6 酶联免疫吸附分析(ELISA)
根据Cayman Chemical公司提供的PGE2检测试剂盒操作步骤,测量释放至条件培养基中的PGE2的含量。同时,采用 R&D Systems公司的 Duoset ELISA Development kit测定条件培养基中NGF的含量。利用Microplate Reader Model 680(Bio-Rad)分别测量PGE2和NGF(405 nm和450 nm)的吸光度值。从标准曲线中计算相应的浓度。
1.7 统计学分析
2 结果
2.1 IL-1β以时间和剂量依赖性方式诱导人IVD细胞表达NGF mRNA
10 ng/mL IL-1β刺激IVD细胞3h后即可诱导NGF mRNA表达,6h时NGF表达含量增高了8.5倍(P<0.05),24 h之后逐渐下降(图1A,B)。而此时LDH漏出实验结果显示IVD细胞并无明显毒性(图1C)。
2.2 塞来昔布对IL-1β诱导IVD细胞表达NGF的影响
IVD细胞预先用塞来昔布预处理细胞30 min后,与IL-1β组相比,NGF mRNA表达随着浓度的增加而显著增高。当塞来昔布浓度达10 mmol/L时,NGF mRNA水平表达增加了1.8倍。此外,ELISA也得到了类似的结果(表1)。
2.3 塞来昔布抑制 IL-1β诱导IVD细胞分泌PGE2
IVD细胞未经刺激时几乎无PGE2表达。IL-1β处理后,PGE2含量显著增高(P<0.05)。当给予塞来昔布处理后,PGE2的产生随其浓度的增高而降低(图2)。
2.4 外源性PGE2抑制IL-1β诱导IVD细胞分泌NGF
IVD细胞在给予IL-1β处理的同时,加入1,10,100 μmol/L PGE2共同孵育6 h,ELISA 结果显示,与IL-1β组相比,NGF产生明显降低(P<0.05)(图3)。

图1 IL-1β对IVD细胞表达NGF的影响Fig 1 Effect of IL-1β on NGF expression± s,n=3)
表1 塞来昔布对IL-1β诱导IVD细胞表达NGF的影响Table 1 Effect of Celecoxib on IL-1 β-induced NGF expression in IVD cells± s,n=3)

表1 塞来昔布对IL-1β诱导IVD细胞表达NGF的影响Table 1 Effect of Celecoxib on IL-1 β-induced NGF expression in IVD cells± s,n=3)
*P <0.05 compared with IL-1β group.
group NGF/GAPDH mRNA NGF concentration(pg/mL)control 0.0025±0.0021 8.98±6.74 IL-1β 0.0360±0.018 46.73±7.52 IL-1β+1 mmol/L Celecoxib 0.0410±0.023 65.08±5.69*IL-1β+5 mmol/L Celecoxib 0.0520±0.019* 81.73±16.54*IL-1β+10 mmol/L Celecoxib 0.0648±0.016* 98.21±13.44*
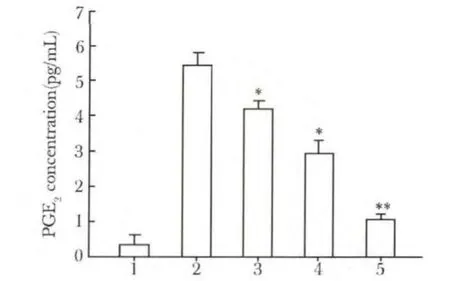
图2 塞来昔布对IL-1β诱导IVD细胞产生PGE2的影响Fig 2 Effect of Celecoxib on IL-1β-induced PGE2 production in IVD cells(± s,n=3)
2.5 外源性PGE2通过结合EP2和EP4受体从而抑制NGF的产生
布他前列素(EP2激动剂)和利文前列素(EP4激动剂)能显著下调IL-1β诱导的NGF产生。而17-苯基三降8-异前列腺素E2(EP1激动剂)和硫前列酮(EP3激动剂)对NGF的产生无明显影响(图4)。

图3 PGE2对IL-1β诱导IVD细胞产生NGF的影响Fig 3 Effect of PGE2on IL-1β-induced NGF production in IVD cells± s,n=3)
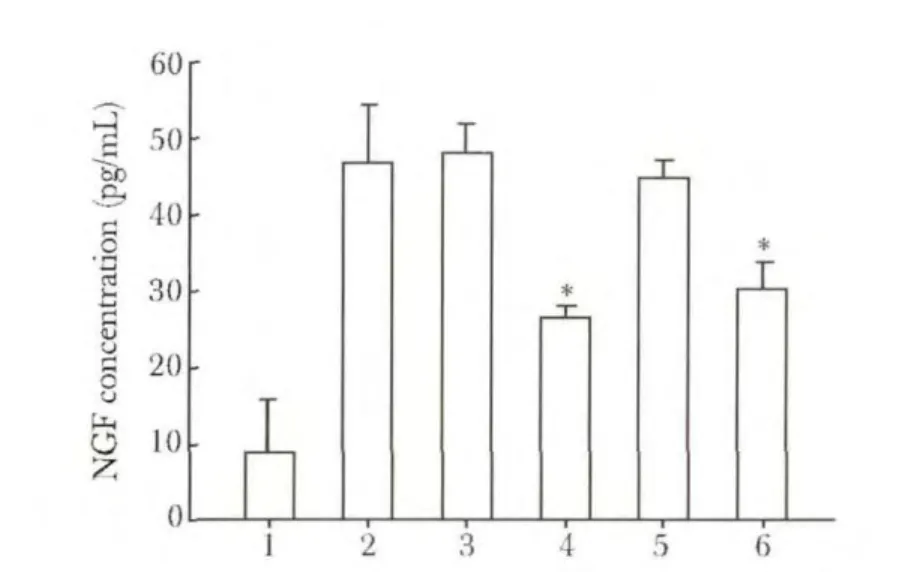
图4 PGE2受体激动剂对IL-1β诱导NGF产生的影响Fig 4 PGE2receptor agonists on IL-1β-induced NGF production ± s,n=3)
3 讨论
在各种慢性腰痛中,IVD组织内部的外周痛觉神经元是引起椎间盘疼痛的重要因素[5]。研究显示,有疼痛症状的患者中NGF的表达量高于无症状患者[6]。此外,在 IVD组织受损的动物实验中,NGF敏感性神经元含量较多。因此,外周神经生长至IVD内部可能与腰痛的发生发展有关,但其分子机制目前仍不清楚。研究显示,促炎性反应细胞因子如IL-1β和TNF-α是NGF诱导剂[7]。这些细胞因子在腰痛患者局部往往呈高水平表达并能维持数天至数周[8]。而抑制这些细胞因子或相应受体后,可有效减轻腰痛的临床症状及病理学改变。这表明炎性因子是参与腰痛发生发展的重要因素。本研究IL-1β能快速诱导NGF的表达,其峰值大约在3~6 h之间,24 h后逐渐下降,在随后可在细胞中仍维持较高水平。
NSAIDs也是广泛用于腰痛的药物,选择性COX-2抑制剂由于不良反应较少,在急性腰痛患者中应用广泛[9]。虽然COX-2抑制剂对急性腰痛有效,但是有近1/3的急性疼痛患者并不能有效改善症状,从而发展为慢性腰痛[10]。本研究发现,塞来昔布可明显增加IL-1β对IVD细胞NGF的诱生作用。为了进一步阐明塞来昔布诱导NGF表达的机制,本研究将外源性PGE2加至培养基内以恢复PGE2的含量,结果显示外源性PGE2可有降低NGF的产生。以往认为PGE2是一种致炎物质,而本研究显示炎性反应条件下PGE2对NGF的表达具有一定的抑制作用,可能的解释是在炎性反应存在时,PGE2的持续表达可能是机体一种警示性标志,而随后发挥负反馈调控作用,如抑制其他疼痛相关分子NGF的表达,从而避免损伤的发展[11-12]。本研究同时还证实,EP2和EP4激动剂处理IVD细胞后,也得到了与PGE2类似的结果,这表明前列腺素受体介导的cAMP途径可能参与调控NGF的表达。因此,塞来昔布的应用虽然能降低局部PGE2的表达,对炎性反应具有一定的抑制作用,但同时也可能消除了PGE2对NGF的负反馈调控作用,从而使塞来昔布在腰痛的治疗中受到一定的限制,因为它可能增加IVD组织中NGF的表达。由于EP2或EP4激动剂可处理可抑制NGF的产生,或许,在塞来昔布治疗的同时给予适量的EP2或EP4激动剂,有望在一定程度上减弱塞来昔布所致的这种负面效应。
[1]Manchikanti L,Benyamin RM,Singh V,et al.An update of the systematic appraisal of the accuracy and utility of lumbar discography in chronic low back pain[J].Pain Physician,2013,16:55-95.
[2]郑力峰,叶君健.MCP-1在腰椎间盘突出症髓核中的表达及临床意义[J].基础医学与临床,2011,31:139-143.
[3]Bannwarth B,Kostine M,Shipley E.Nonspecific low back pain:assessment of available medications[J].Joint Bone Spine,2012,79:134-136.
[4]Sakamoto C,Soen S.Efficacy and safety of the selective cyclooxygenase-2 inhibitor celecoxib in the treatment of rheumatoid arthritis and osteoarthritis in Japan[J].Digestion,2011,83:108-123.
[5]Browning JE.Chiropractic distractive decompression in the treatment of pelvic pain and organic dysfunction in patients with evidence of lower sacral nerve root compression[J].J Manipulative Physiol Ther,1988,11:426-432.
[6]Freemont AJ,Watkins A,Le MC,et al.Nerve growth factor expression and innervation of the painful intervertebral disc[J].J Pathol,2002,197:286-292.
[7]Lee JM,Song JY,Baek M,et al.Interleukin-1beta induces angiogenesis and innervation in human intervertebral disc degeneration[J].J Orthop Res,2011,29:265-269.
[8]Abe Y,Akeda K,An HS,et al.Proinflammatory cytokines stimulate the expression of nerve growth factor by human intervertebral disc cells[J].Spine(Phila Pa 1976),2007,32:635-642.
[9] Kuritzky L,Samraj GP.Nonsteroidal anti-inflammatory drugs in the treatment of low back pain[J].J Pain Res,2012,5:579-590.
[10]Henschke N,Maher CG,Refshauge KM,et al.Prognosis in patients with recent onset low back pain in Australian primary care:inception cohort study[J].BMJ,2008,337:171-177.
[11]Vassiliou E,Jing H,Ganea D.Prostaglandin E2inhibits TNF production in murine bone marrow-derived dendritic cells[J].Cell Immunol,2003,223:120-132.
[12]Jing H,Vassiliou E,Ganea D.Prostaglandin E2inhibits production of the inflammatory chemokines CCL3 and CCL4 in dendritic cells[J].J Leukoc Biol,2003,74:868-879.
