沉默信息调节因子1(SIRT1)在前列腺癌恶性生物学表型中的作用
2014-08-28李淑玲王忠利王翠瑶
李淑玲,王忠利,王翠瑶
(辽宁医学院基础医学院1.组织与胚胎学教研室;2.生物化学与分子生物学教研室;3.辽宁医学院附属第一医院外科,辽宁锦州121001)
崔运福
沉默信息调节因子1(silent information regulator 1,SIRT1)隶属于sirtuin家族,为烟酰胺腺嘌呤二核苷酸(NAD+)依赖性的组蛋白去乙酰化酶。它一方面通过修饰组蛋白,去乙酰化H1K26,H3K9和H4K16位点,维持染色质处于沉默状态、保持基因组稳定;另一方面通过去乙酰化众多的非组蛋白如肿瘤抑制蛋白P53、FOXO转录因子、DNA修复蛋白 Ku70、P300、Rb、NF-κB和P73等,参与调控细胞的能量代谢、增殖、侵袭和转移、凋亡、衰老和神经退行性病变等[1]。SIRT1在肿瘤中呈异质性表达,随肿瘤类型的不同,SIRT1的表达也不一致。SIRT1在人前列腺癌、急性髓细胞白血病、结肠癌等肿瘤中的表达高于正常组织,提示SIRT1可促进肿瘤的发生[2-3];但也有研究发现SIRT1在恶性胶质瘤、膀胱癌和卵巢癌中的表达明显减少[4],提示SIRT1也可能发挥抑癌作用。因此,SIRT1是癌基因还是抑癌基因目前尚无定论。本研究通过观察SIRT1在前列腺癌发生中的作用,为进一步探讨SIRT1在前列腺癌发生的机制奠定基础。
1 材料与方法
1.1 主要试剂
RPMI1640/F12、DMEM和 RPMI1640培养基(Corning公司);First Strand cDNA Synthesis试剂盒和Lamin B(兔多克隆抗体)(Thermo Fisher Scientific公司);SYBR Green Master Mix(Takara公司);SIRT1(鼠单克隆抗体)(Merck Millipore公司)、P53和α-TUBULIN(兔多克隆抗体)(Cell Signaling Technology公司)、β-actin(兔多克隆抗体)(Santacruz公司);Western细胞裂解液和BCA蛋白浓度测定试剂盒(碧云天生物技术公司);HRP标记的山羊抗兔、抗鼠IgG(北京中杉金桥生物技术有限公司)。
1.2 组织标本
收集8例在辽宁医学院附属一院泌尿外科手术切除的新鲜前列腺癌组织和相应的癌旁组织,用于mRNA和蛋白的检测。所有患者术前均未接受放化疗。所有患者都签署了标本研究的知情同意书。
1.3 细胞培养
人前列腺癌细胞系PC3、DU145和LNCap(上海生命科学院细胞和生物化学研究所),分别培养于含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的RPMI1640/F12、DMEM和RPMI1640培养基中。人前列腺成纤维细胞PrEC(Clonetics公司)培养于前列腺上皮生长培养基PrEGM中。所有细胞均在饱和湿度、37℃、5%CO2孵箱中培养,0.25%胰蛋白酶消化传代。当细胞处于对数生长期时,以适合浓度接种于25 cm2的培养瓶中或96孔培养板中。
1.4 Real-time PCR方法检测 SIRT1和P53的mRNA表达水平
Trizol一步法提取前列腺组织和细胞总RNA,1%琼脂糖凝胶电泳检测RNA的完整性,利用First Strand cDNA Synthesis试剂盒反转录合成 cDNA。PCR引物序列 SIRT1(上游:5'-TGCTGGCCTAATA GAGTGGCA-3',下游:5'-CTCAGCGCATGGAAAATG T-3',102 bp);P53(上游:5'-GGACAACCGCCATCC AGACT-3',下 游:5'-GCCAGGGACACCTCCATCTC-3',121 bp);GAPDH(上游:5'-GAAGGTGAAGGTCG GAGTC-3',下游:5'-GAAGATGGTGAGGGATTTC-3',236 bp)。循环条件:94℃预变性2 min;94℃15 s;X℃(SIRT1 55℃;P53 59.3℃)30 s;72℃ 30 s;40个循环;72℃终延伸10 min。每个循环完毕,FTC2000系统采集每个样品荧光信号强度;40个循环扩增结束后,样品继续从72℃缓慢加热到95℃生成熔解曲线。应用2-ΔΔCt法计算 SIRT1和 P53 mRNA在前列腺癌组织和癌旁组织中的表达差异及不同前列腺癌细胞系中的表达差异,其中GAPDH为内参对照,ΔΔCt=CtSIRT1-CtGAPDH。Ct为 PCR扩增过程中,荧光信号强度达到设定检测阈值时所需要的扩增循环数。SIRT1和P53的mRNA的相对表达量为 2-ΔΔCt。
1.5 总蛋白的提取及Western blot法检测SIRT1和P53的蛋白表达
收集前列腺癌组织和相应的癌旁组织及前列腺癌细胞系,用预冷的PBS洗涤2次,1 000 r/min离心5 min,弃上清。100 mg组织加蛋白裂解液100 μL或每瓶细胞加裂解液 80 μL,冰上放置30 min,超声破碎20 s/次,3 ~4 次。12 000 r/min离心20 min取上清,BCA蛋白浓度测定试剂盒测定蛋白含量,-70℃保存备用。取50 μg总蛋白上样,10%SDS-PAGE电泳分离后将蛋白转至硝酸纤维素膜上,含3%BSA的TBST(pH 7.4)封闭滤膜2 h,滤膜再分别与 SIRT1、P53、LAMIN B、α-TUBULIN 和β-actin抗体4℃温育过夜。经TBST洗涤后,HRP偶联的IgG(稀释比为1∶5 000)室温温育2 h,洗膜后,ECL发光法显色。
1.6 胞核和胞质蛋白的提取及Western blot法检测SIRT1和P53的定位
PBS清洗生长状态良好的细胞,加入低盐胞质裂解液 10 mmol/L HEPES(pH 7.9),10 mmol/L KCl,0.1 mmol/L EDTA,0.1 mmol/L EGTA,1 μmol/L DTT和 1 mmol/L PMSF。4℃ 放置 15 min,加P-40至终浓度1.25%。12 500 r/min离心5 min,上清为胞质蛋白。将沉淀重悬于高盐胞核裂解液中20 mmol/L HEPES(pH 7.9),400 mmol/L NaCl,0.1 mmol/L EDTA,0.1 mmol/L EGTA,1 μmol/L DTT,1 mmol/L PMSF,4 ℃放置 30 min。12 500 r/min离心5 min,上清为胞核蛋白。BCA法测定蛋白浓度,按照1.5方法进行Western blot。
1.7 统计学分析
Graphpad prism 5统计软件进行数据统计与分析,各组数据以均值±标准差±s)表示,多样本均数检验采用方差分析。
2 结果
2.1 SIRT1和P53 mRNA在前列腺癌组织中的表达
SIRT1 mRNA在前列腺癌组织中的表达明显高于癌旁组织(P<0.01),而P53 mRNA在前列腺癌组织中的表达明显低于癌旁组织(P<0.01)(图1)。
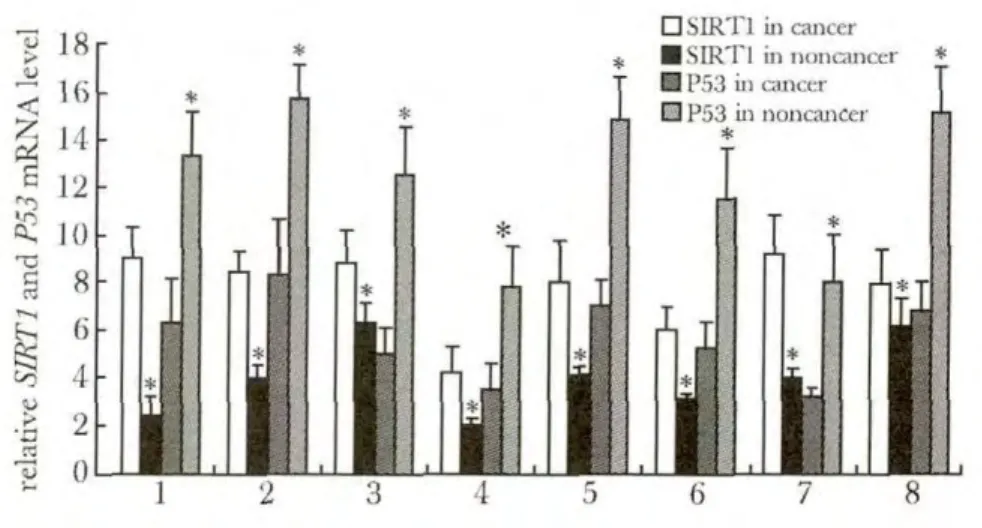
图1 前列腺癌及癌旁组织中SIRT1和P53的mRNA表达Fig 1 The SIRT1 and P53 mRNA expression levels in fresh prostate cancer tissues and non-tumor tissues detected by real-time PCR(x ± s,n=8)
2.2 SIRT1和P53蛋白在前列腺癌组织中的表达
SIRT1蛋白在前列腺癌组织中的表达明显高于癌旁组织,而P53蛋白在前列腺癌组织中的表达明显低于癌旁组织(图2)。
2.3 SIRT1和P53 mRNA在前列腺癌细胞系中的表达

图2 前列腺癌及癌旁组织中SIRT1和P53的蛋白表达Fig 2 The SIRT1 and P53 protein expression levels in fresh prostate cancer tissue(C)and non-tumor tissue(N)assayed by Western blot± s,n=8)
SIRT1 mRNA在前列腺癌细胞系PC3、DU145和LNCap中的表达高于PrEC的表达(P<0.01),并且PC3和DU145细胞中SIRT1的mRNA水平比LNCap细胞显著升高(图3)。
2.4 SIRT1和P53蛋白在前列腺癌细胞系中的表达
前列腺癌细胞系PC3和DU145中SIRT1的表达水平明显高于前列腺成纤维细胞PrEC,而在3种细胞系中LNCap细胞中SIRT1的表达水平最低(图4)。

图3 前列腺癌细胞系SIRT1和P53的mRNA表达Fig 3 The SIRT1 and P53 mRNA expression levels in prostate cancer cells PC3,DU145,LNCap and prostate epithelial cells PrEC examined by real-time PCR± s,n=8)
2.5 SIRT1和P53蛋白在前列腺癌细胞系PC3和DU145细胞中的定位
SIRT1在PC3和DU145细胞的胞质和胞核中均有定位,但以胞核定位为主;P53主要聚集在DU145细胞中的胞核,胞质中微弱可见,而PC3细胞中无P53的表达(图5)。
3 讨论

图4 前列腺癌细胞系SIRT1和P53的蛋白表达Fig 4 The SIRT1 and P53 protein expression levels in prostate cancer cells PC3,DU145,LNCap and prostate epithelial cells PrEC examined by Western blot(± s,n=8)

图5 SIRT1和P53蛋白在前列腺癌细胞系PC3和DU145细胞中的定位Fig 5 The SIRT1 and P53 protein location in prostate cancer cells PC3 and DU145 detected by Western blot± s,n=8)
本研究首先观察SIRT1在前列腺癌组织中的表达,结果表明SIRT1 mRNA和蛋白表达在前列腺癌组织中明显高于癌旁组织[5]。对前列腺癌细胞系LNCap、DU145和PC3和前列腺成纤维细胞PrEC的比较分析发现,前列腺癌细胞系中SIRT1 mRNA和蛋白的表达明显高于PrEC细胞,但激素非依赖性PC3和DU145细胞中SIRT1的mRNA和蛋白水平比激素依赖性LNCap细胞显著升高[6]。以上结果表明SIRT1在前列腺癌组织及癌细胞中表达上调,可能作为诊断前列腺癌的依据之一。SIRT1在PC3和DU145细胞中表达上调的机制还不十分清楚,P53的乙酰化状态是其发挥抑制细胞增长和促进细胞凋亡必不可少的因素。P53已被证明是SIRT1的下游底物[7-9],Vaziri等发现SIRT1结合并去乙酰化P53蛋白羧基末端L382,使其功能失活,进而抑制P53依赖性的基因转录活化[8]。本研究结果表明SIRT1在PC3和DU145细胞的胞核和胞质中均有表达,尤以胞核中显著增多;P53主要聚集在DU145细胞中的胞核,胞质中微弱可见,而在PC3细胞中无P53的表达,缺失的P53可以部分地解释SIRT1在PC3细胞中表达上调[10]。有趣的是,P53表达的DU145细胞中SIRT1的表达也上调,说明还有不同的机制调控SIRT1的表达。
综上所述,本研究提示SIRT1在前列腺癌的发生中可能发挥重要作用,为判断前列腺癌的生物行为学提供依据,但SIRT1在前列腺癌中的作用机制还不清楚,有待进一步研究。
[1]Chang HC,Guarente L.SIRT1 and other sirtuins in metabolism[J].Trends Endocrinol Metab,2014,25:138-145.
[2]Wu ML,Li H,Yu LJ,et al.Short-term resveratrol exposure causes in vitro and in vivo growth inhibition and apoptosis of bladder cancer cells[J].PLoS One,2014,9:e89806. doi: 10. 1371/journal. pone. 0089806.eCollection 2014.
[3]Yuan H,Su L,Chen WY.The emerging and diverse roles of sirtuins in cancer:a clinical perspective[J].Onco Targets Ther,2013,6:1399-1416.
[4]Wang RH,Sengupta K,Li C,et al.Impaired DNA damage response,genome instability,and tumorigenesis in SIRT1 mutant mice[J].Cancer Cell,2008,14:312-323.
[5]Jung-Hynes B,Nihal M,Zhong W,et al.Role of sirtuin histone deacetylase SIRT1 in prostate cancer.A target for prostate cancer management via its inhibition?[J].J Biol Chem,2009,284:3823-3832.
[6]Kojima K,Ohhashi R,Fujita Y,et al.A role for SIRT1 in cell growth and chemoresistance in prostate cancer PC3 and DU145 cells[J].Biochem Biophys Res Commun,2008,373:423-428.
[7]Lhee SJ,Song EK,Kim YR,et al.SIRT1 inhibits P53 but not NF-κB transcriptional activity during differentiation of mouse embryonic stem cells into embryoid bodies[J].Int J Stem Cells,2012,5:125-129.
[8]Vaziri H,Dessain SK,Ng Eaton E,et al.hSIR2(SIRT1)functions as an NAD-dependent P53 deacetylase[J].Cell,2001,107:149-159.
[9]Hasegawa K,Yoshikawa K.Necdin regulates P53 acetylation via Sirtuin1 to modulate DNA damage response in cortical neurons[J].J Neurosci,2008,28:8772-8784.
[10]Arah IN,Song K,Seth P,et al.Role of wild-type P53 in the enhancement of camptothecin cytotoxicity against human prostate tumor cells[J].Anticancer Res,1998,18:1845-1849.
