哮喘患儿外周血RORC mRNA、IL-17水平及其与气道重塑的关系研究
2014-08-22黄雪琼檀卫平王东烨麦贤弟吴葆菁李静蓝丹
黄雪琼 檀卫平 王东烨 麦贤弟 吴葆菁 李静 蓝丹
支气管哮喘是常见的气道慢性疾病,除持续性气道炎症外,气道重塑是哮喘的另一重要特征。气道重塑病理基础包括气道上皮细胞和平滑肌增生、黏液高度分泌、上皮下组织纤维化,以及血管生成[1]。目前评估气道炎症的指标包括,痰液中嗜酸性粒细胞(EOS),呼出气一氧化氮等,而气道重塑的评估需要行有创性气道黏膜活组织检查(活检),临床难以实现。鉴于近年研究发现Th17细胞及其介导的中性粒细胞炎症在哮喘气道重塑过程中起着重要作用[2]。本研究拟通过检测哮喘儿童外周血单个核细胞(PBMC)中Th17细胞的转录因子维甲酸相关孤儿核受体C(RORC) mRNA和主要效应因子IL-17表达水平,以及通过高分辨CT(HRCT)观察患儿气道重塑的影像学改变,探讨其相互联系,为哮喘气道重塑评估寻求新指标,现报告如下。
对象与方法
一、研究对象
2010年9月至2012年8月在中山大学孙逸仙纪念医院儿科哮喘专科门诊及住院就诊的中重度持续哮喘儿童45例。其中处于哮喘急性发作期25例,男16例,女9例,年龄(7.9±2.3)岁;临床缓解期(经过治疗或未经治疗症状、体征消失,肺功能恢复到急性发作前水平,并维持3个月以上)20例,男12例,女8例,年龄(8.2±2.5)岁。儿童哮喘诊断、分期、分度标准均按2008年中华医学会儿科学分会呼吸学组修订的《儿童支气管哮喘诊断与防治指南》中儿童支气管哮喘诊断标准[3]。健康对照组:选择20名进行健康体检的儿童,均为无过敏性疾病和近期无呼吸道感染的健康儿童,男10名,女10名,年龄(8.0±1.6)岁。CT对照组:选择中山大学孙逸仙纪念医院小儿外科收治的10例肝母细胞瘤、原发性腹膜良性肿瘤患儿,年龄(7.2±2.5)岁,均无呼吸道病变。所有受试者无恶性肿瘤病史及自身免疫病史,近4 周内未使用全身肾上腺皮质激素(激素)等免疫抑制药。
二、主要试剂及仪器
主要试剂包括:人IL-17 ELISA试剂盒,购自武汉中美公司;ABI MultiScribeTMReverse Transcriptase逆转录试剂盒及SYBR Green 荧光染料试剂均购自美国ABI公司。HRCT使用SIEMENS SOMATOM Sensation 64 CT系统。
三、方 法
1.PBMC的分离和培养
抽取入选研究对象的外周静脉血2 ml,使用依地酸二钠抗凝。常规Ficoll密度梯度离心法分离PBMC, 加入RPMI 1640培养液重悬PBMC,调整细胞密度为2×106/ml。每孔0.5 ml接种于24孔板,加入anti-CD3(OKT3)(0.2 mg/L)、 antiCD28(1 mg /L),置于37℃、5 %CO2饱和湿度培养箱培养72 h,收集PBMC,置于-80℃冰箱冻存备用。
2.PBMC的IL-17水平检测
收集上述培养PBMC,采用双抗体夹心ELISA法测定细胞IL-17的水平。具体操作严格按照试剂盒说明书操作,每个样本和标准品均设2个复孔,酶标仪492 nm处测定各孔吸光值。
3.PBMC的RNA提取及实时定量PCR检测
收集上述培养PBMC,采用Trizol试剂盒分离出总RNA,核酸测定仪测RNA纯度(A260/A280),纯度要求为1.8~2.0。按照ABI MultiScribeTMReverse Transcriptase试剂盒说明书进行半量体系RNA逆转录模板DNA。采用SYBE GREEN实时荧光定量PCR检测RORC mRNA的表达水平,内参基因NAPDH,半定量反应体系(12.5 μl),参照说明书设定PCR程序,95℃ 10 min变性,然后95℃ 15 s,60℃ 30 s,重复40个循环进行扩增。反应结束,设定最佳阈值,获取CT值,根据仪器给出的标准曲线和斜率,获得目的基因的相对表达指数。引物由上海生物工程有限公司根据设计合成,序列见表1。
4.小支气管气道面积和管壁厚度变化的测量
选取其中14例病程较长[病程3~8(中位数4.5)年]的临床缓解期患儿,采用HRCT进行胸部检测及支气管壁测量。HRCT条件:层厚3 mm,取吸气末3个横断层面(主动脉弓上、气管分叉、下肺静脉)进行测量;横断图像上每个层面选取双侧管腔内径0.5~2 mm的气道各3支,取平均值作为每次的测量值。测量指标:气道内径(L)、气道外径(D)、气道腔面积(Ai)、气道总面积(Ao)。选用气道壁厚度与气道管腔外径之比值(T/D)、气道壁面积占气道总截面积的百分比(WA%)及气道腔面积(Ai)作为观察指标,见图1。
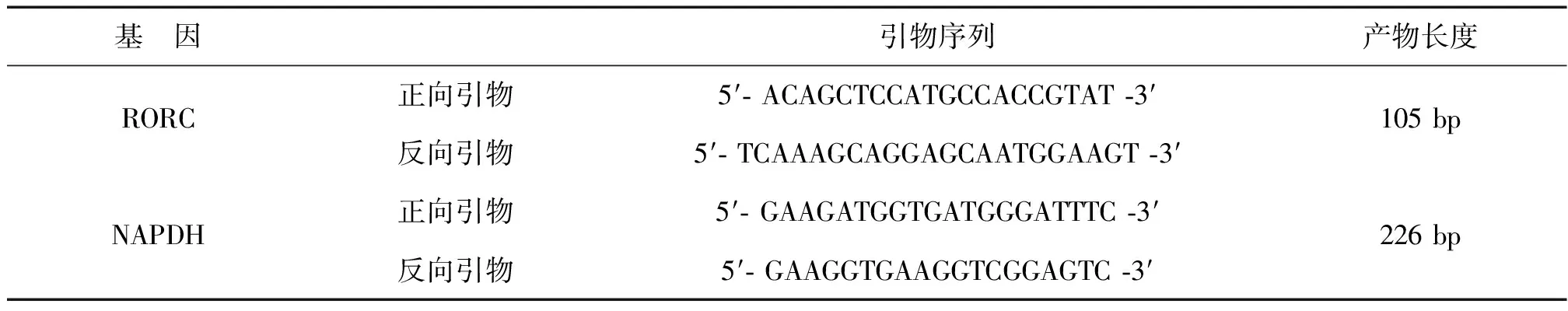
表1 引物序列
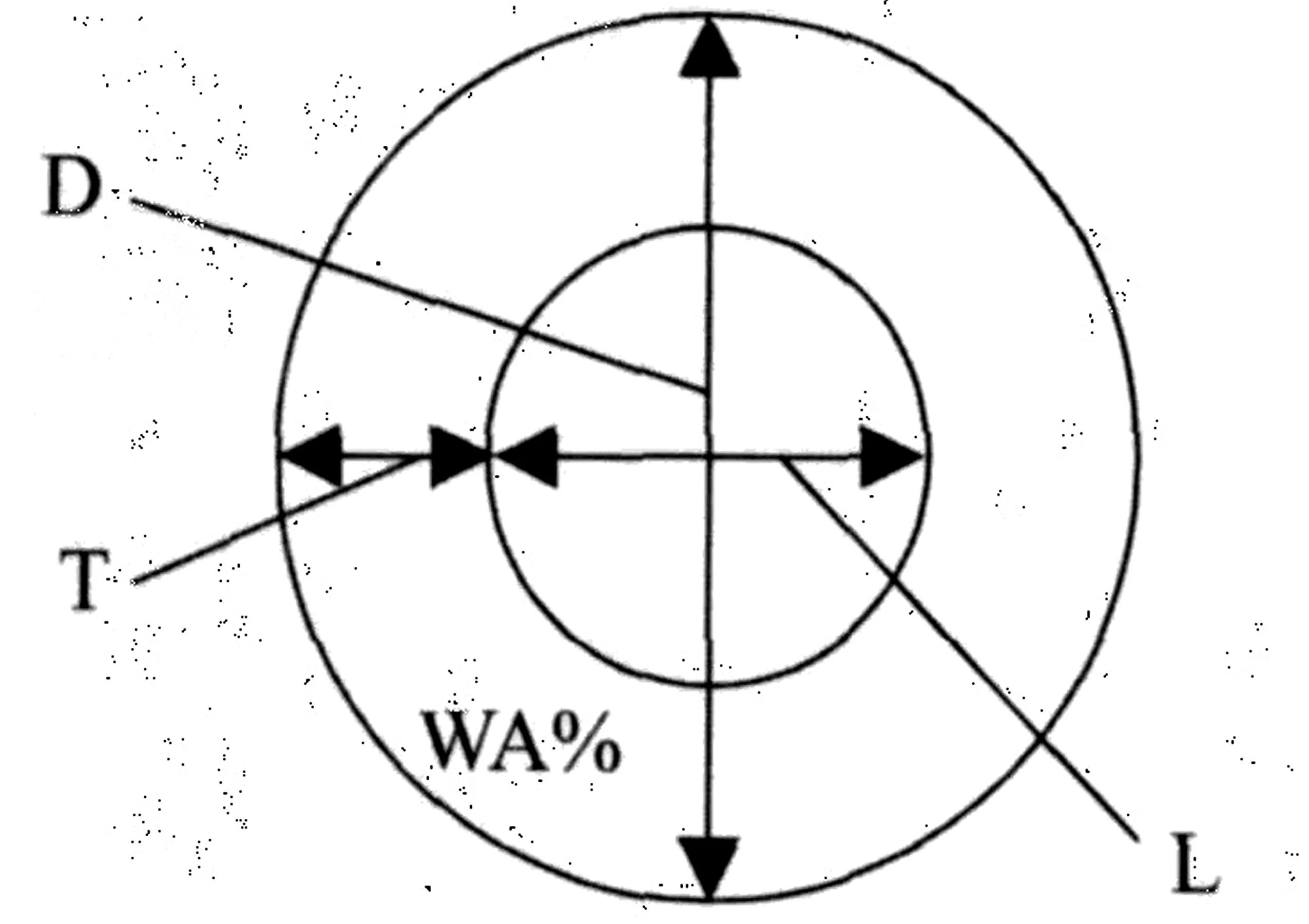
图1 小支气管气道面积和管壁厚度测量示意图
四、统计学处理
结 果
一、中重度哮喘患儿与正常对照组PBMC中RORC mRNA、IL-17表达水平比较
哮喘急性发作期患儿RORC mRNA、IL-17表达水平明显高于缓解期和正常对照组患儿(P<0.05),与正常对照组相比,缓解期患儿IL-17水平明显增高(P<0.05),而两组RORC mRNA表达水平比较差异无统计学意义(P>0.05),见表2。
二、中重度哮喘缓解期患儿与正常对照组儿童支气管测量T/D、WA%、Ai比较
与正常对照组儿童相比,哮喘缓解组患儿T/D、WA%均明显增加,而Ai较正常对照组儿童狭窄(P均<0.05),见表3。
三、中重度哮喘缓解期患儿T/D、WA%与IL-17相关性分析
中重度哮喘缓解期患儿T/D、WA%均与其PBMC IL-17水平呈正相关,r分别为0.78、0.77(P均<0.05),见图2。
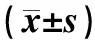
表2 哮喘急性发作期、缓解期患儿和正常对照组儿童RORC mRNA、IL-17表达水平比较
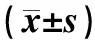
表3 哮喘儿童T/D、WA%及Ai与正常儿童的比较
讨 论
哮喘是一种免疫紊乱的变态反应性疾病,主要表现为慢性气道炎症、气道高反应性和气道重塑[4]。近年来Th17细胞作为 CD4+T细胞调节中性粒细胞参与哮喘气道炎症、气道重建的中介作用备受关注[5]。我们的前期研究显示IL-17与中重度儿童哮喘气道中性粒细胞炎症密切相关[6]。动物实验显示IL-17通过诱导IL-6、IL-8、PGE2及G-CSF等炎症因子的产生,活化、动员中性粒细胞并募集到气道,放大炎症反应;中性粒细胞活化后可释放弹性蛋白酶、髓过氧化物酶及蛋白水解酶等介质,参与气道损伤和修复过程[7]。此外,IL-17还可刺激转化生长因子-β、IL-11等多种促炎因子及黏蛋白基因表达,参与气道上皮损伤、黏液高度分泌、气道上皮下纤维化和血管生成等气道重塑过程[8]。但儿童哮喘气道重塑与IL-17之间的关系尚不清楚。
RORC和IL-17分别为Th17细胞的上游调控基因和主要效应因子。RORC基因参与哮喘发病过程是由其下游的细胞Th17细胞与IL-17介导的。研究显示,哮喘患者的肺组织RORC mRNA表达水平明显上调,同时外周血、支气管灌洗液及痰液中IL-17表达均显著增高,且与气道高反应性程度呈正相关[9-10]。本研究发现,哮喘患儿急性发作期外周血PBMC中RORC mRNA表达和IL-17水平明显高于缓解期和正常对照组,缓解期患儿RORC mRNA表达降至正常,而IL-17水平仍明显高于正常对照组,表明在哮喘的急性发作中转录因子RORC通过促进细胞因子IL-17的基因转录,加重气道炎症及气道高反应性[11]。IL-17水平在缓解期仍持续升高,则可能是通过减少翻译后的蛋白降解途径,参与哮喘的慢性过程。本研究通过HRCT检查评估儿童哮喘的气道重塑,发现与正常对照组比较,中重度哮喘患儿缓解期气道管径明显狭窄,而气道壁厚度和面积较正常对照组明显增加,且与同期外周血IL-17表达水平呈正相关,表明IL-17不仅在哮喘急性发作期参与气道炎症和气道高反应性,且在缓解期促进气道重塑的发生发展。
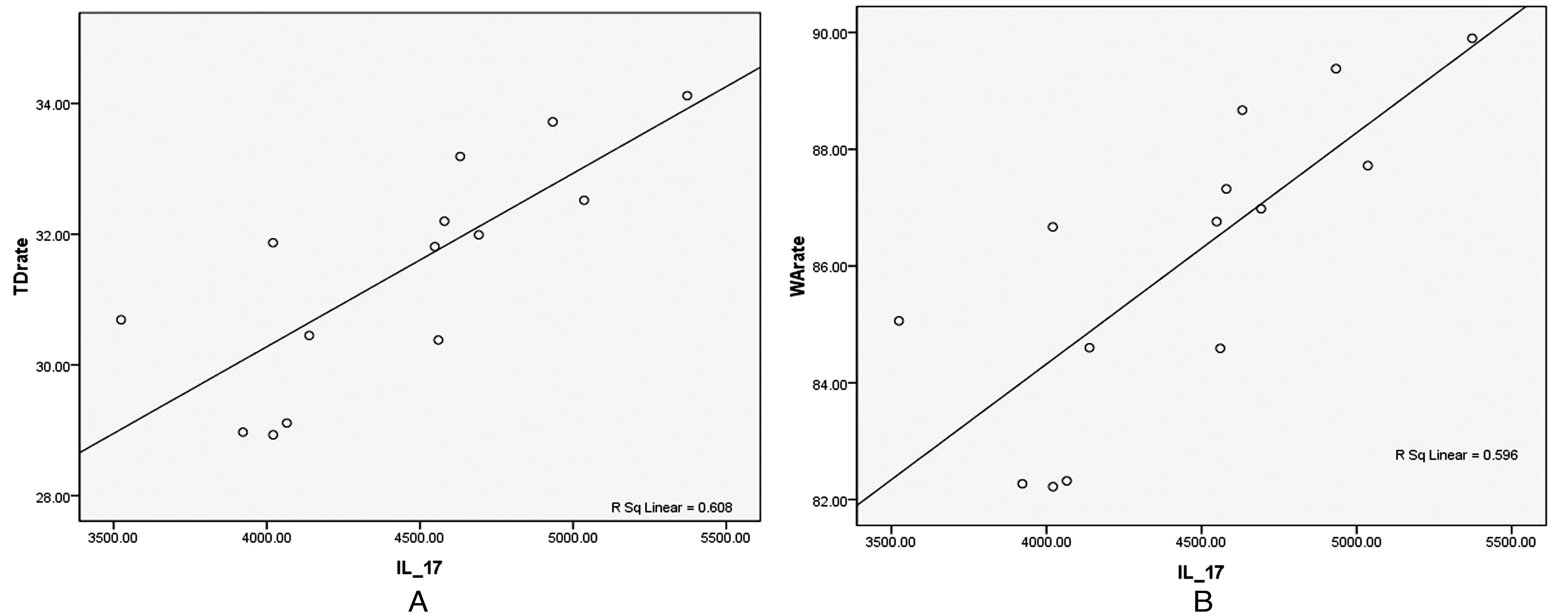
图2 中重度哮喘缓解期患儿PBMC IL-17水平与同期气道壁厚度(A)及面积(B)呈正相关
近年来儿童哮喘的治疗目标不仅要有效控制气道慢性炎症,更力求减少气道重塑的发生,进而减少儿童哮喘向成人哮喘发展。目前指南推荐的吸入性激素(ICS)治疗虽能有效控制嗜酸性粒细胞介导的气道炎症,但对中性粒细胞炎症及气道重塑无效。IL-17作为促进哮喘中性粒细胞炎症的重要因子,与哮喘气道重塑关系密切,有望成为防治哮喘的新靶点。
[1] Gras D, Bourdin A, Chanez P, et al. Airway remodeling in asthma: clinical and functional correlates. Med Sci (Paris),2011,27:959-965.
[2] Al-Ramli W, Préfontaine D, Chouiali F, et al. T(H)17-associated cytokines (IL-17A and IL-17F) in severe asthma. J Allergy Clin Immunol, 2009, 123:1185-1187.
[3] 中华医学会儿科学分会呼吸学组. 儿童支气管哮喘诊断与防治指南. 中华儿科杂志,2008,46:745-753.
[4] 檀卫平, 夏焱, 吴葆菁, 等. T-bet基因转染对哮喘小鼠气道炎症的影响. 中国病理生理杂志, 2009,25:2399-2402.
[5] Doe C, Bafadhel M, Siddiqui S, et al. Expression of the T helper 17-associated cytokines IL-17A and IL-17F in asthma and COPD. Chest,2010,138:1140-1147.
[6] 李静,檀卫平,吴葆菁,等. 中重度哮喘患儿白细胞介素-17与中性粒细胞炎症反应的关系. 中山大学学报:医学科学版, 2010,31:449-456.
[7] Jones CE, Chan K. Interleukin-17 stimulates the expression of interleukin-8, g rowth-related oncogene-alpha, and granulocyte-colony-stimulating factor by human airway epithelial cells. Am J Respir Cell Mol Biol,2002,26:748-753.
[8] Fujisawa T, Velichko S, Thai P, et al. Regulation of airway MUC5AC expression by IL-1beta and IL-17A; the NF-kappaB paradigm. J Immunol,2009,183:6236-6243.
[9] Bullens DM, Truyen E, Coteur L, et al. IL-17 mRNA in sputum of asthmatic patients:linking T cell driven inflammation and granulocytic influx? Respir Res,2006,7:135.
[10] Wilson RH, Whitehead GS, Nakano H, et al. Allergic sensitization through the airway primes Th17-dependent neutrophilia and airway hyperresponsiveness. Am J Respir Crit Care Med,2009,180:720-730.
[11] Durrant DM, Gaffen SL, Riesenfeld EP, et al. Development of allergen-induced airway inflammation in the absence of T-bet regulation is dependent on IL-17. J Immunol, 2009, 183:5293-5300.
