骨髓增生异常综合征患者血红素加氧酶表达水平及其临床意义
2014-08-22解杰李丽珍黄涛王鲁群李颢李湘新王玲玲李芳邻
解杰 李丽珍 黄涛 王鲁群 李颢 李湘新 王玲玲 李芳邻
骨髓增生异常综合征(MDS)是一组起源于造血干细胞的恶性克隆性疾病,其预后呈现明显异质性。根据1997年Greenberg提出的国际预后评分系统(IPSS)可将MDS分为低危组、中危-1组、中危-2组和高危组。低危组患者多表现为难治性贫血、白细胞和血小板减少,但原始病态造血的程度较轻,因而多数患者生存时间较长。近来研究证实,低危MDS患者骨髓微环境中一些应激性刺激可引起造血干/祖细胞过度凋亡从而导致骨髓无效造血和外周血细胞数减少[1]。细胞的高凋亡贯穿于疾病的各个阶段,以难治性贫血(MDS-RA)及环形铁粒幼细胞性难治性贫血(MDS-RAS)为著。目前,低危MDS的治疗主要是对症支持、低甲基化治疗等,但疗效不理想。血红素加氧酶-1(HO-1)参与清除细胞内氧自由基,减少细胞应激性凋亡,这种作用可能与MAPK 信号通路有关[2-3]。本研究通过检测在不同浓度HO-1诱导剂Hemin干预下,低危MDS患者HO-1的表达水平的变化及HO-1基础水平的变化与患者预后的关系,探讨HO-1可能的作用机制和临床靶向治疗的可能。
对象与方法
一、研究对象
采集2008年9月至2012年9月在山东大学齐鲁医院血液科就诊的60例初治低危MDS患者骨髓,其中男28例、女32例,年龄19~80岁、中位年龄55岁,病程0.5~8.3年、中位病程5.6年。病理分型包括:MDS-RA 45例、MDS-RAS 15例,MDS的诊断符合2008年WHO分型标准[4]。另外,采集同期在我院就诊的缺铁性贫血(IDA)患者20例的骨髓作为对照,男9例、女11例,年龄20~78岁、中位年龄50岁。所有标本取材均获得山东大学齐鲁医院伦理委员会批准,所有患者及家属均签署知情同意书。
二、方 法
用蛋白免疫印迹法检测60例初诊低危MDS患者骨髓单个核细胞(BMMNCs)中HO-1蛋白表达水平及JNK信号分子磷酸化水平的表达,并追踪随访MDS患者无进展生存期(PFS)。
1.主要材料
胎牛血清和RPMI 1640培养液(Gibco公司),Hemin(Sigma公司),RIPA细胞裂解液、BCA蛋白浓度测定试剂盒(碧云天生物技术研究所),c-Jun氨基末端激酶(JNK)和磷酸化JNK(p-JNK)、β-actin等一抗及二抗(Cell signaling technology公司),HO-1一抗(Abcam公司)。
2.BMMNCs的提取与体外孵育
无菌条件下抽取患者骨髓5 mL,予乙二胺四乙酸(EDTA)抗凝,稀释后加入Ficoll淋巴细胞分离液分离BMMNCs。将患者BMMNCs接种于含20%的胎牛血清的RPMI1640培养液中,分为4组,每组接种细胞浓度为2×106/ml。第2~4组加入不同剂量HO-1诱导剂Hemin,使Hemin在体系中的终浓度分别为5、10、20 μM,第1组培养体系中加入等量无菌磷酸盐缓冲液(PBS)。于37℃、含5% 二氧化碳饱和湿度下培养48 h后收集细胞备用。
3.采用蛋白免疫印迹法检测BMMNCs中HO-1蛋白和磷酸化JNK信号分子的表达
用RIPA细胞裂解液处理BMMNCs,提取总蛋白质,测定蛋白浓度。按每孔50 μg蛋白上样,10%~12% SDS-聚丙烯酰胺凝胶垂直电泳分离后转至PVDF膜上,用封闭液(含50 g/L脱脂牛奶的TBST缓冲液)室温封闭2 h,加入一抗(1∶1 000)于4℃孵育过夜。第2日于室温下洗膜后加入相应辣根过氧化物酶(HRP)耦联羊抗兔二抗室温孵育1 h,洗膜后用电化学发光法显影。以β-actin条带作为内对照。目的蛋白显色条带灰度与内参显色条带灰度比值代表目的蛋白相对表水平。
4.病例随访
随访截止日期为2013年10月。对可追踪的60例患者进行PFS分析。PFS是从疾病确诊日开始至死亡或疾病进展为止。低危MDS患者疾病进展定义为粒细胞或血小板数较最佳缓解/疗效时下降≥50%或血红蛋白下降≥20 g/L或原始细胞<5%者的原始细胞数增加≥50%达到5%。将随访终止时仍未发生疾病进展和死亡的患者以及失访患者的生存期作为删失值处理。
三、统计学处理
采用SPSS 17.0软件处理数据,单因素方差分析中用LSD-t检验进行组间蛋白表达量比较。进行Kaplan-Meier生存分析,并用Log-rank检验比较生存曲线。用COX风险比例模型分析HO-1对无进展生存期的影响。P<0.05为比较差异有统计学意义。
结 果
一、低危MDS患者BMMNCs中HO-1蛋白的表达水平
60例低危MDS患者HO-1蛋白相对表达水平为0.450±0.248,与IDA患者水平0.4913±0.2377比较差异无统计学意义(P>0.05)。用不同浓度(0、5、10、20 μM)的HO-1诱导剂Hemin体外孵育BMMNCs 48 h,HO-1蛋白相对表达水平分别为0.450±0.248、0.695±0.213、0.896±0.202、1.126±0.167,多组间比较差异有统计学意义(F值为18.938,P<0.01),各组间两两比较差异均具有统计学意义(LSD-t检验的P值均<0.05),提示随着Hemin浓度的增加HO-1蛋白表达水平呈浓度依赖性逐渐升高,见图1。
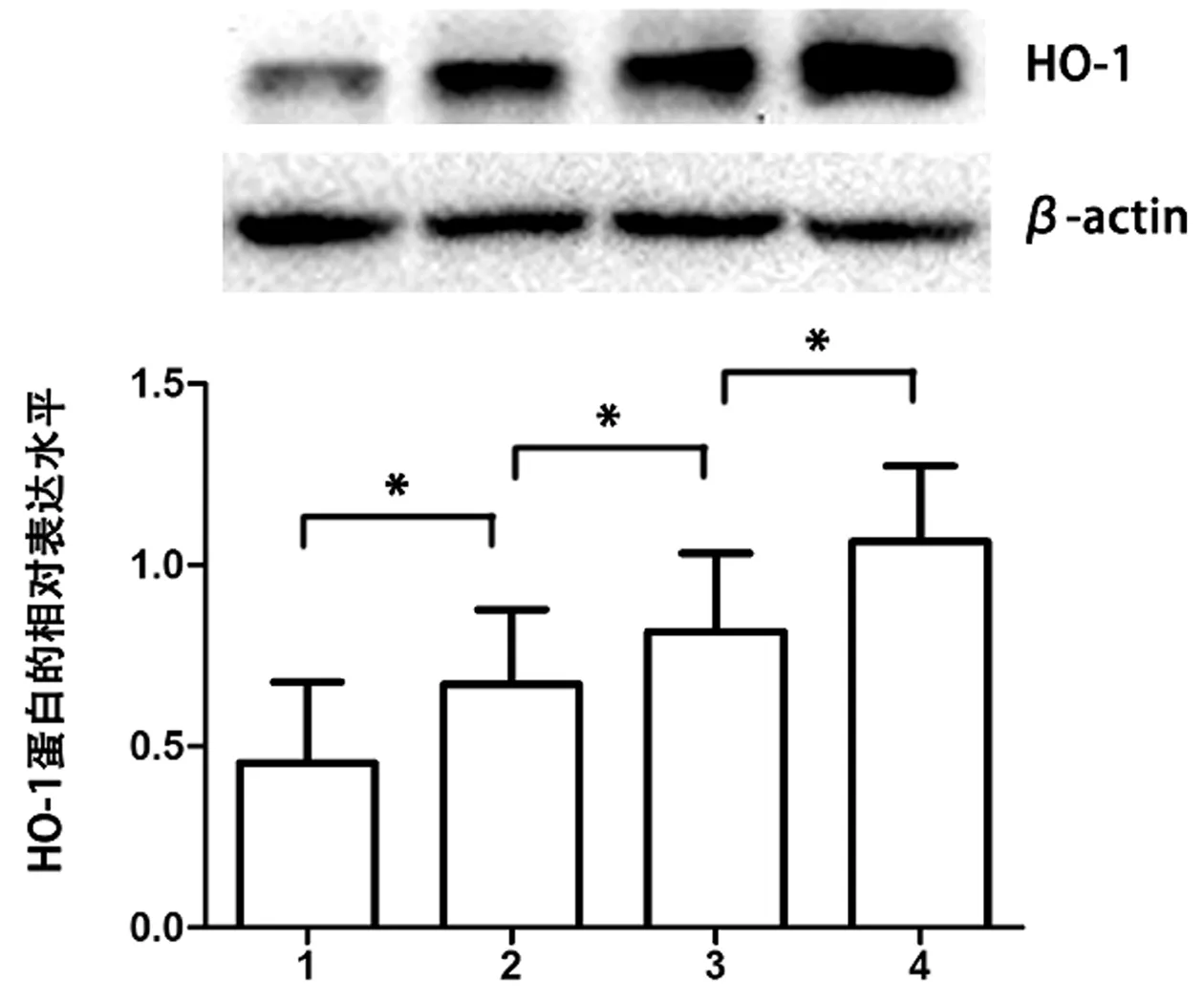
图1 蛋白免疫印迹法检测低危MDS患者骨髓单个核细胞中HO-1蛋白的表达
二、 HO-1对磷酸化JNK信号分子表达水平的调控
不同浓度Hemin孵育BMMNCs 48 h,随着HO-1蛋白表达量的逐渐增高,磷酸化JNK信号分子相对表达水平在各组分别为0.412±0.217、0.632±0.245、0.861±0.221、1.112±0.233,多组间比较差异有统计学意义(F值为17.163,P<0.01),各组间两两比较差异均具有统计学意义(LSD-t检验的P均<0.05)。提示随着HO-1表达水平的升高,磷酸化JNK信号分子表达水平也逐渐升高,见图2。
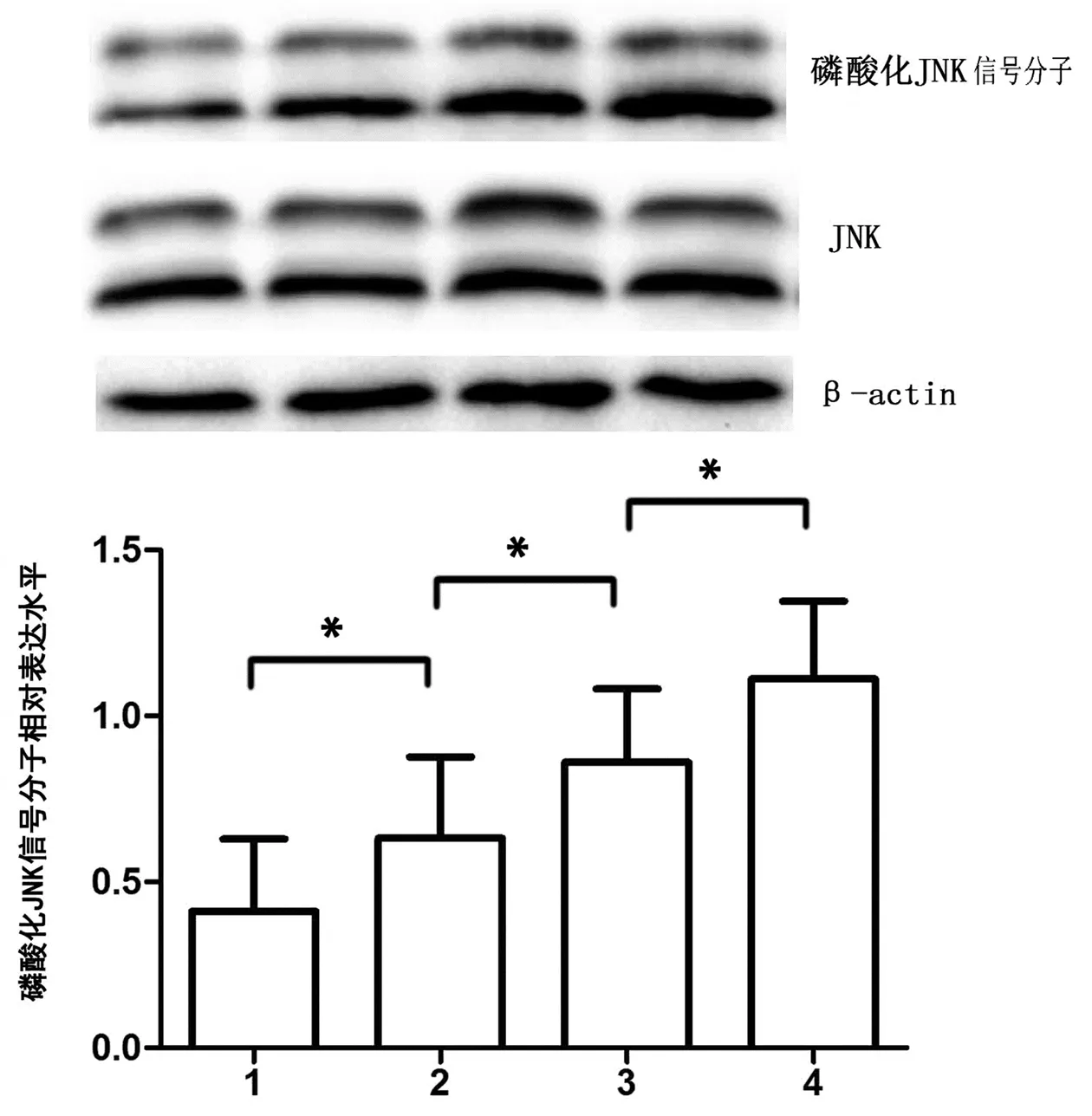
图2 蛋白免疫印迹法检测低危MDS患者骨髓单个核细胞中磷酸化JNK信号分子的表达
三、HO-1表达水平与低危MDS患者预后的关系
1.HO-1表达水平的高低对低危组患者PFS的影响
以低危MDS患者HO-1蛋白表达水平的均数0.450为界,将MDS患者分为两组,超过0.450为高表达组,共30例(50%),小于0.450为低表达组,共30例(50%)。至随访截止日,60例患者中25例发生血液学疾病进展(41.7%),7例进展为MDS-RA伴原始细胞增多4例或白血病3例(11.7%)。18例(30.0%)疾病好转且稳定,至随访结束日未发生进展;8例(13.3%)死亡(死亡原因为感染5例、严重出血2例、高龄1例);2例(3.33%)失访。总的PFS为32.8(6.4~57.6)个月,其中HO-1高表达组患者PFS为41.6(6.4~57.6)个月,低表达组为32.0(7.4~49.3)个月,两组比较差异有统计学意义(P=0.047)。两组无病生存率的比较见图3。
2.COX回归模型分析
将HO-1蛋白表达水平纳入COX回归模型中,结果显示HO-1表达水平是判断低危MDS患者预后的独立影响因素(HR为0.048,95%CI为0.005~0.420,P=0.006,回归系数为-3.043)。以上结果提示HO-1蛋白表达量的增加将减小低危MDS患者病情进展的可能性。
讨 论
MDS造血细胞的高凋亡状态贯穿于MDS从低危到高危的各个亚型。Raza于1997年提出低危MDS患者可出现多种凋亡信号转导的改变,其中包括MAPK通路中的p38 传导通路及抗凋亡传导通路ERK、JNK等的异常调节,它们多造成DNA合成期阶段的造血细胞凋亡,在高危亚型患者同样存在凋亡过度的现象,但因其骨髓中出现代偿性的恶性细胞增殖而掩盖了此现象。骨髓细胞凋亡的调控如何影响低危MDS患者的预后,不同研究者均有相似见解。其中,骨髓造血细胞保护机制,如血红素加氧酶/一氧化碳(HO-CO)系统、热休克蛋白系统和集落刺激因子系统信号的调节可明显抑制细胞凋亡。Navas等于2006年报道体外抑制低危MDS骨髓细胞凋亡,发现其造血祖细胞集落形成能力显著增强,说明抑制细胞凋亡可明显改善MDS患者骨髓造血。同年,Kim等通过体内试验将抗凋亡制剂(己酮可可碱、环丙沙星、地塞米松等)用于低危MDS患者,发现随着骨髓造血细胞凋亡率的减低其外周血三系细胞数明显提升,提示抑制造血细胞高凋亡可能是改善低危组MDS患者预后的一条新途径。
HO-1 广泛存在于机体的各个组织、器官,参与机体的氧化还原、组织修复及DNA修复等多种与细胞保护有关的反应,可通过抗氧化、抗应激、抗凋亡等发挥细胞保护作用[5-6]。有学者在小鼠移植模型中发现,HO-1单倍体基因突变导致其表达不足时,会使应激状态下小鼠骨髓和脾脏各阶段红系造血细胞数目减少、铁代谢再循环利用受阻、巨噬细胞分泌TNF-α等造血负调控因子增多,说明应激状态下红系祖细胞保持正常的增殖、代谢及分化成熟过程中HO-1起到关键的调节作用[7]。Morita等于2009年报道,他们的研究证明HO-CO信号系统的上调可以抑制p38MAPK途径信号激活,调节骨髓基质中干细胞因子(SCF)、血管内皮生长因子(VEGF)的产生,从而调控造血细胞的增殖。本研究通过随访低危MDS患者的状况,观察到HO-1高表达组患者PFS长于HO-1低表达组患者。通过COX回归分析观察到HO-1的表达水平是判断低危组MDS预后的独立因素,提示HO-1是阻止病情进展的保护性因素。上调HO-1的表达可能会通过优化造血细胞的增殖条件而减轻造血细胞的凋亡,从而改善MDS低危患者的预后状况。
基础实验证明HO-1可以调控MAPK信号通路中的JNK发挥细胞保护作用。Das等于2006年报道在大鼠心肌缺血再灌注模型中,HO-1通过环鸟苷酸依赖的蛋白激酶G(PKG)可激活JNK从而抑制心肌细胞坏死和凋亡,而应用JNK抑制剂可以阻断HO-1对心肌细胞的保护作用,这说明HO-1可上调磷酸化JNK信号分子水平的表达。为了进一步探讨HO-1对低危MDS患者预后的影响,我们给予不同浓度Hemin进行体外干预,发现随着HO-1蛋白分子表达量的逐渐增加,磷酸化JNK信号分子表达水平也逐渐升高,提示HO-1可能通过调控JNK信号分子活性来调节造血细胞增殖与凋亡的过程。
Nagata于1998年提出JNK主要通过调节铁代谢而影响血红蛋白的合成。在骨髓细胞中JNK被激活后可进一步增强应激性转录因子c-Jun活性,后者可与铁蛋白H基因的ARE区结合,增加铁蛋白表达,维护细胞内铁平衡,促进血红蛋白的稳定而有效合成并诱导红系造血祖细胞的分化。JNK还能通过促进红系爆式集落形成单位(BFU-E)细胞增殖,使细胞周期由G0期过渡到G1期,该过程可能与JNK激活下游转录因子AP-1,诱导Cyclin D1基因的表达有关。Malcovati等[8]在临床研究中发现低危MDS患者血红蛋白水平与预后密切相关,中重度贫血患者中位生存期明显低于轻度贫血患者,通过COX回归分析证明血红蛋白水平的降低是影响患者预后的危险因素。HO-1表达水平上调可激活JNK信号分子活性,从而进一步促进红系造血而有助于改善低危MDS的不良预后。此外,JNK不仅促进红系造血,在骨髓粒系造血细胞中,还可通过磷酸化激活CCAAT/增强子结合蛋白α(C/EBPα)转录因子的活性,后者可能通过上调重组人粒细胞集落刺激因子(G-CSF)受体表达促进粒系祖细胞分化成熟。
HO-1作为一种保护性因子,其对低危MDS患者PFS的延长作用可能与激活JNK信号分子活动而改善MDS无效造血有关。Hemin是HO-1诱导剂,在低危MDS中,Hemin可有效上调HO-1的表达,具有浓度梯度依赖性,Hemin能否作为新的MDS靶向治疗药物有待于进一步探讨。综上所述,HO-1为改善低危组MDS患者预后以及延长患者生存期提供了一个新的研究方向,而且为呈高度异质性的MDS患者个体化治疗提供了有力依据。
[1] de Souza GF, Barbosa MC, Santos TE,et al. Increased parameters of oxidative stress and its relation to transfusion iron overload in patients with myelodysplastic syndromes. J Clin Pathol, 2013,66:996-998.
[2] Song YJ, Zong ZM, Liu HZ, et al. Heme oxygenase-1 regulates the JNK signaling pathway through the MLK3-MKK7-JNK3 signaling module in brain ischemia injury. Brain Res, 2012, 1429:1-8.
[3] Arruda MA, Rossi AG, de Freitas MS, et al. Heme inhibits human neutrophil apoptosis: involvement of phosphoinositide 3-kinases, MAPK, and NF-kappaB. J Immunol, 2004, 173:2023-2030.
[4] Vardiman JW, Thiele J, Arber DA, et al. The 2008 revision of the World Health Organization (WHO) classification of myeloid neoplasms and acute leukemia: Rationale and important changes. Blood, 2009, 114: 937-951.
[5] Orifassa CS, Camara NO. Cytoprotective role of heme oxygenase-1 and heme degradation derived end products in liver injury. World J Hepatol, 2013, 5:541-549.
[6] Wu ML, Ho YC, Yet SF. A central role of heme oxygenase-1 in cardiovascular protection. Antioxid Redox Signal, 2011, 15:1835-1846.
[7] Cao YA, Kusy S, Luong R, et al. Heme oxygenase-1 deletion affects stress erythropoiesis. PLoS One, 2011, 6:e20634.
[8] Malcovati L, Della Porta MG, Strupp C, et al. Impact of the degree of anemia on the outcome of patients with myelodysplastic syndrome and its integration into the WHO classification-based prognostic scoring system (WPSS). Haematologica, 2011, 96:1433-1440.
