人源化抗Aβ抗体治疗APP/PS1转基因鼠的实验研究
2014-08-22马晋段金海邹俊涛汪洋
马晋 段金海 邹俊涛 汪洋
阿尔茨海默病(AD)是一种以进行性记忆力减退和认知障碍为主要临床特征的中枢神经退行性疾病。研究表明,β淀粉样蛋白(β-amyloid,Aβ)沉积形成老年斑是AD病理机制的中心环节。人源化抗Aβ抗体来源于健康人血,制备相对简单,成本低。本研究采用纯化的人源化抗Aβ抗体治疗APP/PS1双转基因鼠,观察抗体对AD转基因鼠脑内老年斑的清除作用、脑内相关的细胞因子的变化以及动物的认知行为学变化,研究人源化抗Aβ抗体治疗APP/PS1双转基因小鼠的免疫治疗效果及免疫类型,进一步阐明抗Aβ抗体的免疫学机制,旨在为抗体进入临床实验奠定理论基础。
材料与方法
一、实验动物
36只SPF级APP/PS1双转基因小鼠,6月龄,雌雄不拘,体质量(45±5)g。品系名称:B6C3-TG(APPSWE,PSEN1DE9)85DBO/J,简称APPSWe,相关基因APP、PS1,购于广东省动物医学实验中心。
二、主要试剂和仪器
人源化抗Aβ抗体由广东省人民医院与本实验室共同制备并保管。HRP-羊抗小鼠IgG购自博士德公司。鼠源性抗Aβ单克隆抗体购自美国Sigma公司。MICROM HM340切片机、MICROM EC350包埋机均为德国Leica公司产品,Morris水迷宫实验仪、Morris水迷宫测试软件为中国科学院产品, Bio-fuge15R低温高速离心机为德国Heraeus Instruments公司产品。
三、 治疗方法
将36只APP/PS1双转基因小鼠分为人源化抗Aβ抗体组、鼠源性单克隆抗体10D5组(阳性对照组)和磷酸盐缓冲液(PBS)对照组(阴性对照组),每组各12只小鼠。人源化抗Aβ抗体组小鼠予腹腔注射人源化抗Aβ抗体40 μg,鼠源性单克隆抗体组予腹腔注射等剂量鼠源性单克隆抗体10D5,PBS对照组则予腹腔注射PBS,3组均为每周注射1次,每次注射体积均为100 μl,共治疗3个月。
四、研究内容
注射前及每次注射后,行Morris水迷宫行为学测试各组小鼠学习记忆能力,实验包含定位航行实验和空间探索实验,分别记录平均潜伏期及跨越平台次数,平均潜伏期越短说明小鼠的学习能力越好,跨越平台次数越多说明小鼠的记忆力越好。
治疗3个月后取小鼠尾静脉血,处死小鼠。选取小鼠含海马及其上方顶叶联合皮质范围进行免疫组织化学染色,观察老年斑数量和分布情况。同时取小鼠脑组织匀浆,取上清液。分别检测小鼠脑组织上清液和血清中TNF-α表达含量。
五、 统计学处理
结 果
一、Morris水迷宫行为学测试结果
1.定位航行实验
实验第7周起,人源化抗Aβ抗体组及鼠源性单克隆抗体组平均逃避潜伏期均比PBS对照组缩短,比较差异均有统计学意义(P均<0.05),见图1。
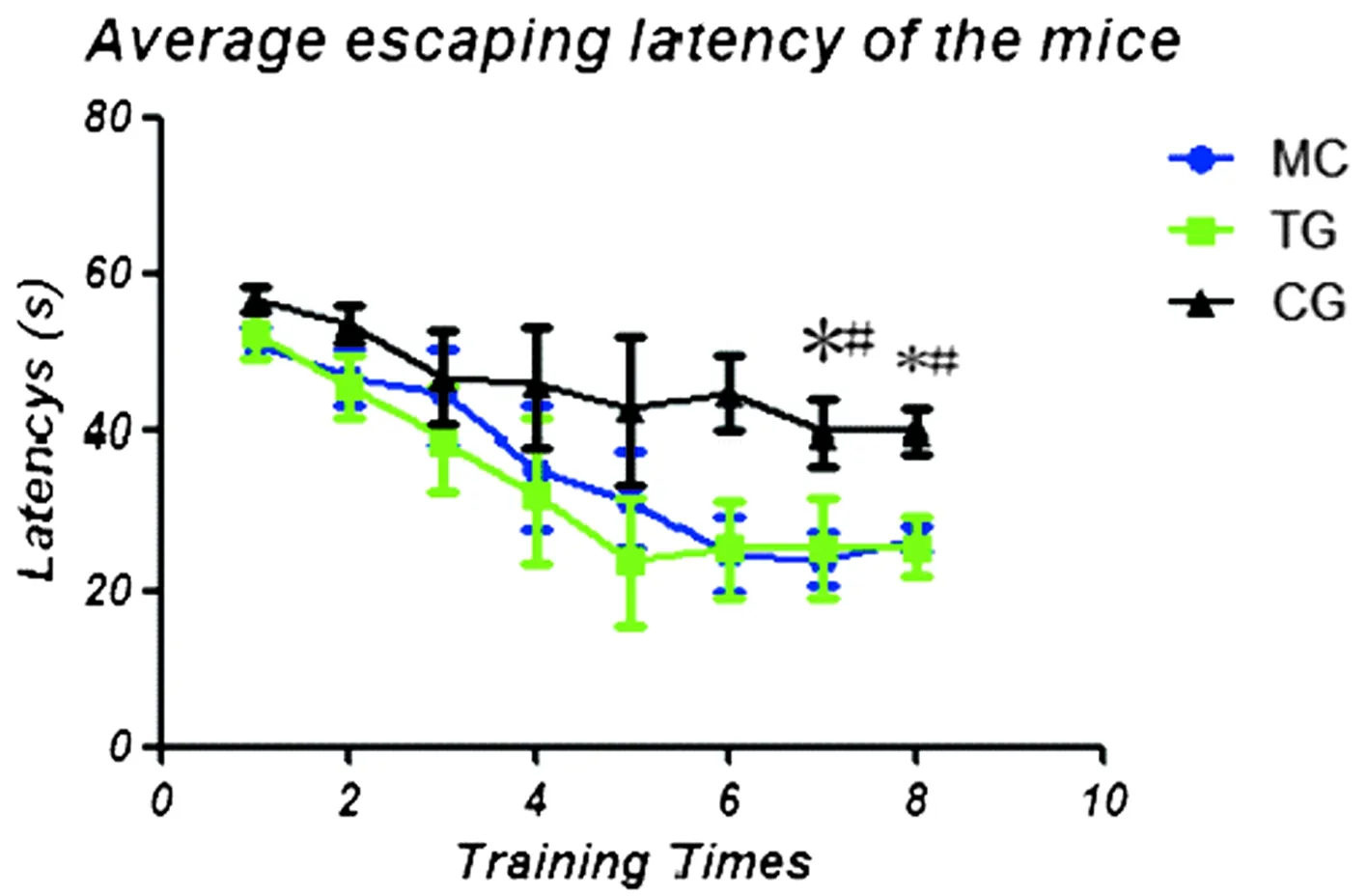
图1 Morris水迷宫行为学测试中3组APP/PS1双转基因小鼠平均逃避潜伏期比较
2.空间探索实验
与对照组相比,人源化抗Aβ抗体组与鼠源性单克隆抗体组跨越平台次数明显增多,比较差异均有统计学意义(P均<0.05),见图2。
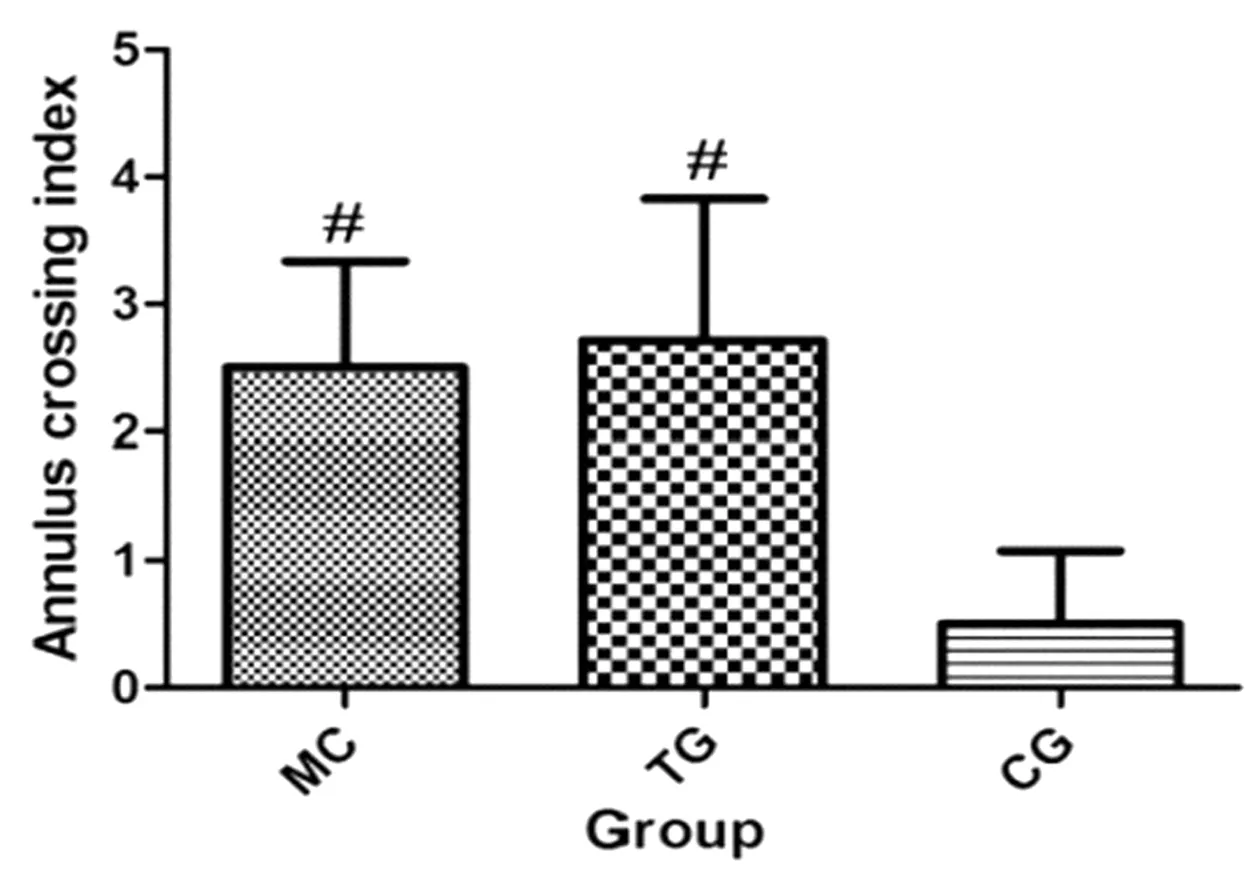
图2 Morris水迷宫行为学测试中3组APP/PS1双转基因小鼠跨越平台次数比较
二、脑内Aβ沉积免疫组织化学染色结果
与PBS对照组比较,鼠源性单克隆抗体组与人源化抗Aβ抗体组大脑皮质、海马区棕色斑块沉积明显形态变小、数量变少、范围分散,见图3。

图3 3组APP/PS1双转基因小鼠脑内Aβ沉积免疫组织化学染色结果
三、血清和脑组织TNF-α检测结果
人源化抗Aβ抗体组与鼠源性单克隆抗体组脑内TNF-α含量均较PBS对照组明显减少(P<0.05),见表1。
讨 论
随着我国逐渐进入老龄化社会,老龄相关性疾病增多,而脑老化导致的认知功能下降及痴呆是影响老年人生活质量的重要因素[1]。传统药物治疗AD具有不良反应大,难以个体化治疗的缺点。被动免疫治疗AD 不需要激发T细胞以产生足够量的抗体,避免了T细胞过度激活导致的炎症反应。 即使发生不良反应,被动免疫治疗可及时终止,避免了机体对抗体的持续暴露。与传统治疗相比,被动免疫治疗便于根据不同的患者调整抗体的剂量,治疗易于个体化。2000年Bard报道,鼠源性单克隆抗体治疗AD可以达到和主动免疫相似疗效的结果。
Rothwell 等(1995年)报道,TNF-α对神经元的营养和毒性作用与其在脑内的浓度、位置及持续时间相关,这与IL-1β对神经元的双重作用相似,TNF-α可以直接产生神经毒性,也可释放其他炎症因子间接损伤神经元。本研究发现,治疗后APP/PS1双转基因小鼠血液及脑内TNF-α含量均明显减少。同时,炎症反应随淀粉样斑块的消退而减少,提示炎症反应和淀粉样斑块形成可能密切相关,此结果与Wirths等[2]报道相似,进一步证明“脑内炎症反应随淀粉样斑块形成而产生”的研究结论。
正常人及AD患者血清中均含抗Aβ抗体。与AD患者相比,正常人血清中的抗体滴度更高,是抗Aβ抗体的“天然多克隆抗体库”。研究发现,血清中抗Aβ抗体可能具有清除老年斑或抑制老年斑形成的作用, 具有与主动免疫诱导出的抗体相似的体外作用,显示出潜在的AD治疗价值[3-4]。进一步研究发现,静脉注射免疫球蛋白(IVIG)中含有高滴度的抗Aβ抗体,而且用有学者使用含抗Aβ抗体的IVIG治疗8例AD患者取得良好疗效,患者的认知功能得以改善,且其记忆下降速度明显减缓[5]。流行病学调查也发现含有抗Aβ抗体的IVIG可以预防AD的发生[6]。一直以来,被动免疫的缺点在于生产单克隆抗体花费巨大,且需要反复注射,针对抗体的免疫反应不确定,而人源化抗Aβ抗体似乎是合理的扬长避短,达到治疗AD的目的可行性方法之一。本研究发现,人源化抗Aβ抗体与鼠源性抗体在治疗AD疗效相近,而在抗体的获取、提纯更具优势。虽然目前针对人源化抗Aβ抗体应用于AD的治疗还有具体结合位点、作用机制和通路、最佳效价没有完全清晰以及远期有无并发症等问题,尚需要进一步去讨论和解决,但总体上看,人源化抗Aβ抗体在免疫治疗AD方面有着得天独厚的优势,避免了合成Aβ单克隆抗体所需要的高昂成本,避开了主动免疫的不良反应,在体外试验有效的基础上,如AD转基因鼠的在体研究能取得成功,将为抗Aβ抗体进入临床实验奠定可靠的基础。
表1 3组APP/PS1双转基因小鼠血清及脑组织TNF-α含量比较
[1] 马芹颖,王彦永,马晓伟,等.快速老化小鼠SAMP8的增龄性老化特征研究. 新医学,2013,44:415-419.
[2] Wirths O,Breyhan H,Marcello A,et al. Inflammatory changes are tightly associated with neurodegeneration in the brain and spinal cord of the APP/PS1 KI mouse model of Alzheimer's disease. Neurobiol Aging,2010,31:747-757.
[3] Sohn JH, So JO, Hong HJ, et al. Identification of autoantibody against beta-amyloid peptide in the serum of elderly. Front Biosci(Landmark Ed), 2009,14: 3879-3883.
[4] Kellner A, Matschke J, Bernreuther C, et al. Autoantibodies against beta-amyloid are common in Alzheimer's disease and help control plaque burden. Ann Neurol, 2009,65: 24-31.
[5] Relkin NR, Szabo P, Adamiak B, et al.18-Month study of intravenous immunoglobulin for treatment of mild Alzheimer disease. Neurobiol Aging, 2009, 30: 1728-1736.
[6] Fillit H, Hess G, Hill J, et al. IV immunoglobulin is associated with a reduced risk of Alzheimer disease and related disorders. Neurology, 2009,73:180-185.
