胰岛素泵治疗非肥胖2型糖尿病合并OSAHS患者的研究
2014-08-22薛萌黄冰吴炎王玉磷
薛萌 黄冰 吴炎 王玉磷
2型糖尿病患者较常出现OSAHS,我国有研究调查显示,在145例住院2型糖尿病患者中,OSAHS的患病率高达78.6%;香港的研究调查了165例糖尿病患者,其OSAHS患病率达53.9%;国外有研究观察了303例2型糖尿病患者,其OSAHS患病率达63%[1-3]。曾有学者怀疑OSAHS在2型糖尿病患者中高发是由于肥胖的因素,现已有多个研究认为OSAHS与高血糖相关,近2年又有针对非肥胖患者的研究发现,OSAHS与糖代谢受损及胰岛素抵抗有关[4-5]。本研究旨在观察非肥胖2型糖尿病合并OSAHS的患者经过胰岛素泵强化降糖治疗后胰岛素抵抗及睡眠呼吸紊乱的改善情况,以期为该类患者治疗方案的选择提供依据。
对象与方法
一、研究对象
选择2012年6月至2013年12月在我科住院的非肥胖2型糖尿病合并OSAHS患者80例为研究对象,所有患者均满足以下条件:①符合1999年WHO的2型糖尿病诊断标准,病程小于10年,年龄35~65岁,GHbA1c为7%~11%,BMI≤25 kg/m2;②符合2011年OSAHS诊断标准,夜间7 h多导睡眠监测提示呼吸暂停反复发作在30次以上或呼吸暂停低通气指数≥5次/小时;③排除上呼吸道感染或梗阻,排除有五官手术史,排除使用呼吸兴奋类药物及有严重肝肾疾病等。控制性别因素后将患者分为胰岛素泵组(40例)和口服药组(40例),两组患者年龄、性别、病程、BMI、空腹血糖、餐后2 h血糖、GHbA1c等比较差异无统计学意义(P>0.05),见表1。
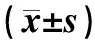
表1 胰岛素泵组与口服药组治疗前基线资料比较
二、方 法
胰岛素泵组给予胰岛素泵持续皮下注射治疗(诺和诺德公司提供门冬胰岛素),分为3餐前追加量和基础量;口服药组给予口服降糖药治疗(磺脲类、格列奈类、阿卡波糖),均治疗4周,每日监测7次指尖血糖,根据血糖调整胰岛素和用药量。
治疗前及治疗后4周均使用美国Alice5多导睡眠监测仪记录晚9时至次晨7时呼吸参数:呼吸暂停低通气指数(AHI)、暂停指数、低通气指数、最长呼吸暂停时间和最低血氧饱和度。
两组患者均于治疗前后检测空腹血糖、胰岛素水平,并使用稳态模型计算胰岛素抵抗指数(HOMA-IR),HOMA-IR= 空腹血糖×空腹胰岛素/22.5[6]。
三、统计学处理
采用SPSS 17.0统计软件处理数据。组间比较采用t检验,治疗前后比较采用配对t检验。以P<0.05为有比较差异有统计学意义。
结 果
一、胰岛素泵组和口服药物组代谢指标的比较
治疗前两组患者BMI、血脂(甘油三酯、总胆固醇、LDL)、尿酸水平比较差异无统计学意义(P>0.05);胰岛素泵组治疗后空腹和餐后2 h血糖水平、HOMA-IR较治疗前下降,比较差异有统计学意义(P<0.05);口服药组治疗后空腹和餐后2 h血糖水平较治疗前下降,比较差异有统计学意义,HOMA-IR改变无统计学意义。两组治疗后血糖及HOMA-IR比较差异有统计学意义(P<0.05)。见表2。
二、胰岛素泵组和口服药物组呼吸参数的比较
胰岛素泵组治疗前后低通气指数、最低血氧饱和度比较差异有统计学意义(P<0.05)。口服药组治疗后各呼吸参数与治疗前比较差异均无统计学意义(P>0.05)。两组治疗后低通气指数、最低血氧饱和度比较差异有统计学意义(P<0.05)。见表3。
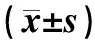
表2 胰岛素泵组与口服药组治疗前后代谢指标比较
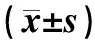
表3 胰岛素泵组与口服药组治疗前后呼吸参数比较
讨 论
目前多个研究显示糖尿病患者发生OSAHS与其血糖控制差有关[7-8]。最近的一项非肥胖者中OSAHS与糖代谢关系的研究表明,OSAHS患者较无OSAHS者的空腹血糖、75 g糖负荷后血糖、GHbA1c水平升高,而且OSAHS的患病率与空腹血糖受损(IFG)、糖耐量异常(IGT)和糖尿病的患病率有明确相关性,从而得出结论:OSAHS与糖代谢受损有关[9]。OSAHS与高血糖相互作用的机制尚未明确,目前认为OSAHS可通过兴奋交感神经系统兴奋、使下丘脑-垂体轴调节紊乱以及引发全身性炎症等因素导致胰岛素抵抗,促进高血糖的发生。而糖尿病所致的自主神经功能失调可增加OSAHS发病风险,形成恶性循环[10]。
许多横断面调查表明,OSAHS和糖尿病患者胰岛素抵抗之间有密切联系[11-12]。Lindberg等[13]的长达11年的前瞻性研究显示,OSAHS患者血氧饱和度下降指数与胰岛素抵抗独立相关。一项针对消瘦者(BMI 22.6 kg/m2)的研究发现,OSAHS组较无OSAHS对照组的胰岛素敏感性低,且有37%者出现高胰岛素分泌现象[4]。另有研究显示非肥胖患者,例如肢端肥大症患者,OSAHS和胰岛素抵抗及血糖控制差亦明确相关[14]。
本研究发现,非肥胖2型糖尿病合并OSAHS患者使用胰岛素泵治疗4周,血糖水平接近正常水平,且治疗后HOMA-IR、低通气指数、最低血氧饱和度较治疗前明显改善。故笔者认为胰岛素泵治疗能有效改善患者胰岛素抵抗、睡眠呼吸紊乱情况。这可能由于胰岛素泵严格地控制了血糖,降低高血糖的毒性作用,改善了胰岛素抵抗,恢复了交感神经活性,因此改善了睡眠呼吸暂停的症状。口服药组治疗后血糖较治疗前也明显下降,但与胰岛素泵组相比仍偏高,且治疗后HOMA-IR、呼吸紊乱参数改善不明显,故考虑其呼吸紊乱症状纠正不理想、疗效较胰岛素泵级差可能与血糖未得到严格控制、胰岛素抵抗改善不理想有关。这提示我们在治疗这类患者时需非常重视血糖的控制,适当使用增敏剂可能有利于胰岛素抵抗的改善。
本研究还发现,胰岛素泵治疗前后最低血氧饱和度、低通气指数有所改善,但AHI并无明显变化,其原因可能为单纯控制血糖并不能改善气道梗阻所造成的呼吸暂停。最近也有研究显示,在糖尿病及非糖尿病患者中,最低的血氧饱和度与血糖控制有相关性,但AHI却与血糖控制无关,与本文研究结果一致[15]。
综上所述,胰岛素泵治疗有助于改善非肥胖2型糖尿病合并OSAHS患者的胰岛素抵抗及呼吸紊乱。但本研究观察时间短,样本量较少,仅为初步探讨,笔者见此类相关研究较少,因此关于各种降血糖方案治疗对OSAHS的疗效尚有待行更多、更大样本量的循证医学研究以进一步证实。
[1] 刘然,陆菊明,刘剑锋,等. 2型糖尿病患者阻塞性睡眠呼吸暂停综合征患病状况及相关因素分析. 中华老年心脑血管病杂志,2013,1:29-31.
[2] Lam DC, Lui MM, Lam JC,et al. Prevalence and recognition of obstructive sleep apnea in Chinese patients with type 2 diabetes mellitus. Chest,2010,138:1101-1107.
[3] Laaban JP, Daenen S, Léger D, et al. Prevalence and predictive factors of sleep apnoea syndrome in type 2 diabetic patients. Diabetes Metab, 2009,35:372-377.
[4] Pamidi S, Wroblewski K, Broussard J, et al. Obstructive sleep apnea in young lean men: impact on insulin sensitivity and secretion. Diabetes Care,2012,35:2384-2389.
[5] Lin QC, Zhang XB, Chen GP, et al. Obstructive sleep apnea syndrome is associated with some components of metabolic syndrome in nonobese adults. Sleep Breath,2012,16:571-578.
[6] Shaban N1, Kenno KA, Milne KJ. The effects of a 2 week modified high intensity interval training program on the homeostatic model of insulin resistance (HOMA-IR) in adults with type 2 diabetes. Sports Med Phys Fitness,2014,54:203-209.
[7] Drager LF, Queiroz EL, Lopes HF, et al. Obstructive sleep apnea is highly prevalent and correlates with impaired glycemic control in consecutive patients with the metabolic syndrome. Cardiometab Syndr,2009, 4:89-95.
[8] Papanas N, Steiropoulos P, Nena E, et al. HbA1c is associated with severity of obstructive sleep apnea hypopnea syndrome in nondiabetic men. Vasc Health Risk Manag, 2009, 5:751-756.
[9] Kim NH, Cho NH, Yun CH, et al. Association of obstructive sleep apnea and glucose metabolism in subjects with or without obesity. Diabetes Care,2013,36:3909-3915.
[10] 中华医学会呼吸病学分会睡眠呼吸学组,中华医学会糖尿病学分会.阻塞性睡眠呼吸暂停与糖尿病专家共识.中华糖尿病杂志,2010,2:1-7.
[11] Bhushan B, Misra A, Guleria R. Obstructive sleep apnea is independently associated with the metabolic syndrome in obese Asian Indians in northern India. Metab Syndr Relat Disord,2010, 8:431-435.
[12] Togeiro SM, Carneiro G, Ribeiro Filho FF, et al. Consequences of obstructive sleep apnea on metabolic profile: a population-based survey. Obesity,2012,21:847-851.
[13] Lindberg E, Theorell-Haglöw J, Svensson M, et al. Sleep apnea and glucose metabolism: a long-term follow-up in a community-based sample. Chest,2012,142:935-942.
[14] Duarte FH, Jallad RS, Amaro AC, et al. The impact of sleep apnea treatment on carbohydrate metabolism in patients with acromegaly. Pituitary,2012,16:341-350.
[15] Tamura A, Kawano Y, Watanabe T, Kadota J. Obstructive sleep apnea increases hemoglobin A1c levels regardless of glucose tolerance status. Sleep Med,2012,13:1050-1055.
