LRRK2活化Rho GTPases信号通路在小胶质细胞吞噬α-突触核蛋白中的作用机制
2014-08-21丁雪冰王雪晶马明明滕军放
丁雪冰 王雪晶 马明明 滕军放
1)郑州大学第一附属医院神经内科 郑州 450052 2)郑州大学帕金森病及相关运动障碍疾病研究所 郑州 450052 3)河南省人民医院神经内科 郑州 450003
LRRK2活化Rho GTPases信号通路在小胶质细胞吞噬α-突触核蛋白中的作用机制
丁雪冰1,2)王雪晶1,2)马明明3)滕军放1,2)
1)郑州大学第一附属医院神经内科 郑州 450052 2)郑州大学帕金森病及相关运动障碍疾病研究所 郑州 450052 3)河南省人民医院神经内科 郑州 450003
目的 探讨小胶质细胞吞噬α-突触核蛋白的分子机制。方法 构建α-Syn寡聚体诱导BV-2细胞活化模型,免疫荧光检测BV-2细胞内α-Syn阳性包涵体的数量。Western blot检测BV-2细胞LRRK2蛋白的表达。Pull down检测BV-2细胞Rac1、Cdc42、RhoA的活性。结果 与对照组相比,α-Syn寡聚体诱导BV-2细胞内α-Syn阳性包涵体数量增加,LRRK2蛋白表达增加及Rac1、Cdc42、RhoA活性增加。结论 小胶质细胞对α-突触核蛋白的吞噬与LRRK2活化Rho GTPases信号通路相关。
LRRK2;Rho GTPases信号通路;小胶质细胞;α-突触核蛋白
帕金森病(Parkinson’s disease,PD)是人类最常见的神经退行性疾病之一[1]。其病理特征为黑质致密部多巴胺神经元变性缺失及残存神经元胞浆中异常聚集的α-突触核蛋白(α-synuclein,α-Syn)阳性路易小体的形成[2]。随着研究的不断深入,学者们发现在α-Syn阳性包涵体胞间播散过程中,小胶质细胞作为重要的传递媒介,在大量吞噬异常聚集的α-Syn后被持续激活,导致神经元损伤[3-4]。由此推测α-Syn阳性包涵体在小胶质细胞间播散在PD进展中起重要作用。
α-Syn寡聚体通过小胶质细胞胞吞作用在相邻细胞之间传递[5],进入受体细胞的α-Syn寡聚体,可以像“朊蛋白”一样作为“种子”诱导正常构象的α-Syn蛋白错误折叠最终形成α-Syn阳性包涵体。通过这种模式α-Syn阳性包涵体在细胞间播散[6],导致神经元的损伤从黑质向其他脑区扩散。而抑制α-Syn寡聚体的胞间传递能够阻断LB的细胞间播散,从而减少神经元的损伤。LRRK2基因(1eucine rich repeat kinase 2 gene,PARK8;OMIM 607060)位于细胞质内,定位于细胞膜、细胞器膜等膜结构,作为分子开关参与细胞信号传导、骨架重塑及膜转运等多种生理过程[7]。我们的前期研究发现LRRK2作为Rho GTPase的调控因子,介导上皮细胞吞噬能力增强。因此LRRK2很可能参与调控小胶质细胞对于α-Syn寡聚体的吞噬。本研究以小胶质细胞吞噬α-Syn寡聚体为切入点,检测LRRK2活化Rho GTPases信号通路在小胶质细胞吞噬α-突触核蛋白中的作用机制,探索PD神经元损伤的病理机制。
1 材料与方法
1.1 材料 BV-2细胞由本实验室保存。DMEM培养基、胎牛血清购于美国GIBCO公司。LRRK2抗体购于美国Cell Signaling公司,α-Syn抗体购于美国 Santa Cruz Biotechnology公司,过氧化物酶标记山羊抗兔IgG购于美国Promega公司,Alexa Fluor 633 标记 Phalloidin购于美国Molecular Probes公司。Rac/Cdc42 Assay Reagent (PAK1 PBD,agarose)或 Rho Assay Reagent (Rhotekin RBD, agarose) 购于美国Millipore公司。人源重组α-Syn冻干粉购于Sigma公司。
1.2 α-Syn寡聚体诱导BV-2细胞活化模型的构建 BV-2细胞以1×106接种到12孔板中培养24 h后,换无血清培养基,实验组中加入终浓度0.5 μM的α-Syn寡聚体,对照组加入相应体积PBS,并于37℃ 5% CO2中孵育24 h。
1.3 免疫荧光检测BV-2细胞内α-Syn阳性包涵体 收获细胞,PBS洗2次。加入-20℃预冷的丙酮于-20℃孵育10 min,再加入0.1% Triton,常温孵育5 min,PBS洗3次。5% BSA 37℃孵育30 min。加入α-Syn抗体(1∶1000)4℃孵育过夜,PBS洗3次。加入Alexa Fluor 488 标记羊抗兔二抗(1∶1000) 4℃孵育3 h,PBS洗3次。加入DAPI(1∶400),常温孵育3 min。于干净的载玻片滴加封片剂,常温下避光晾干过夜,于激光共聚焦显微镜下观察。
1.4 Western blot检测BV-2细胞蛋白表达 构建α-Syn寡聚体诱导BV-2细胞活化模型,提取细胞总蛋白,做SDS-PAGE电泳,将蛋白转移至硝酸纤维滤膜上。用5%脱脂奶粉封闭1 h,PBS洗3次,加入LRRK2及GTP-Rac1、GTP-Cdc42、GTP-RhoA抗体(1∶1000),4℃过夜。加入过氧化物酶标记山羊抗兔IgG(1∶5000)孵育2 h,PBS洗3次,ECL光化学法显色。凝胶成像分析系统分析扫描。
1.5 Pull down检测BV-2细胞Rac1、Cdc42、RhoA活性 0.5 mL预冷的细胞裂解液MLB裂解细胞10 min,离心收集上清。加入GST,冰上孵育10 min,离心收集上清。冰上取1 mL细胞提取液,加入20 μL Rac/Cdc42 Assay Reagent (PAK1 PBD, agarose)或 Rho Assay Reagent (Rhotekin RBD, agarose)冰上孵育2 h。离心去上清,500 μL Wash Buffer 洗涤沉淀,所得蛋白做Western blot检测GTP-Rac1、GTP-Cdc42、GTP-RhoA蛋白表达。
1.6 统计学分析 应用AlphaEaseFC(FluorChem8900)软件分析图像结果。
2 结果
2.1 免疫荧光检测BV-2细胞内α-Syn阳性包涵体 构建α-Syn诱导BV-2细胞活化模型。免疫荧光结果显示,与对照组相比,α-Syn诱导BV-2细胞中α-Syn阳性包涵体数量增高。如图1所示。
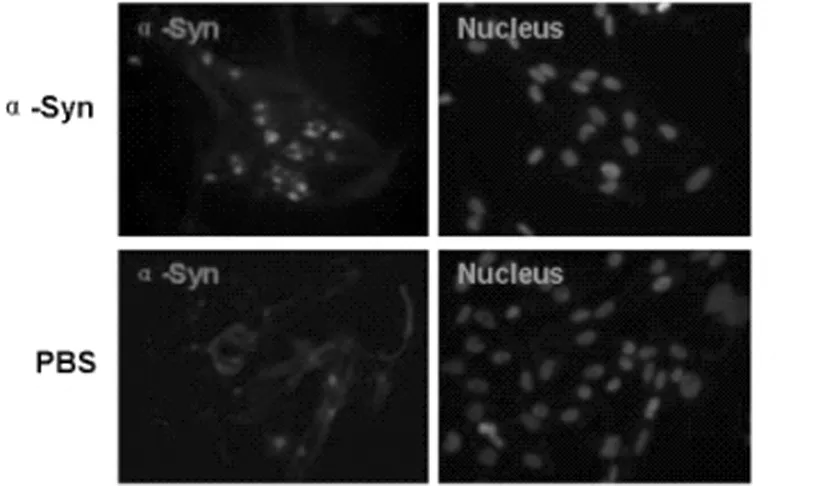
图1 免疫荧光检测BV-2细胞中α-Syn阳性包涵体(免疫荧光×400)
2.2 Western blot检测BV-2细胞LRRK2蛋白表达 Western blot结果显示,与对照组相比,α-Syn诱导BV-2细胞LRRK2蛋白表达增高。如图2所示。
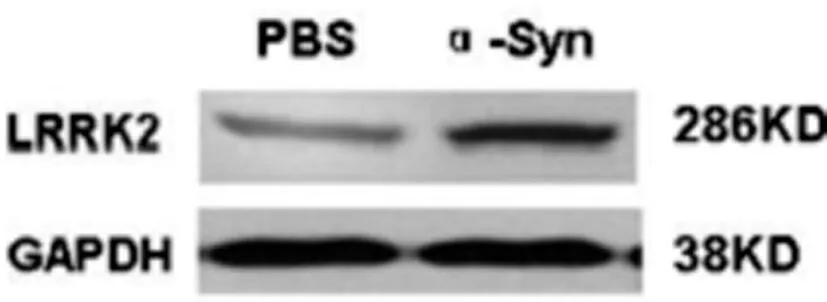
图2 Western blot检测BV-2细胞LRRK2蛋白表达
2.3 Pull down检测BV-2细胞Rac1、Cdc42、RhoA活性 构建α-Syn诱导BV-2细胞活化模型。Pull down结果显示,与对照组相比,α-Syn诱导BV-2细胞中GTP-Rac1、GTP-Cdc42、GTP-RhoA表达增高。表明Rac1、Cdc42、RhoA活性增高。如图3所示。

图3 Pull down检测BV-2细胞Rac1、Cdc42、RhoA活性
3 讨论
研究表明α-Syn阳性包涵体胞间播散介导的小胶质细胞活化,在PD进展中起到重要作用。小胶质细胞是中枢神经系统的重要免疫炎症反应细胞,研究表明,小胶质细胞与DA神经元通过细胞间、细胞分子间的网络式作用相互联系参与了帕金森病的发生发展过程[8,9]。在α-Syn寡聚体的细胞间传递所介导的神经元损伤中,小胶质细胞的活化扮演了重要角色。作为免疫效应细胞,小胶质细胞具有强大的吞噬功能。研究表明小胶质细胞能够吞噬α-Syn寡聚体及单体,作为α-Syn寡聚体传递的重要载体,加速α-Syn阳性包涵体的细胞间播散,促进PD的发展。研究表明,米诺环素、白细胞介素-10等抑制小胶质细胞活化的药物能够减轻PD模型DA神经元损伤。因此,调控小胶质细胞吞噬功能的因子很可能通过促进α-Syn寡聚体的内吞而激活小胶质细胞,介导DA神经元的损伤,从而推动PD的进展。
LRRK2基因是新近在散发性、家族聚集性常染色体显性遗传的帕金森病患者中发现的致病基因。在细胞水平上LRRK2位于细胞质内,参与细胞膜转运等生理过程。LRRK2具有6个主要功能区域,其中ROC区域具有GTPases水解酶活性[10],通过直接结合调控Rho GTPases的活性。研究表明,ROC区域与PD有关的突变(R1441C, R1441G)减弱了GTPase水解活性,增强了与GTP的结合,导致Rho GTPases的活化,引起细胞骨架重塑及神经元结构和功能的改变,这也是LRRK2致病的主要机制[11]。我们的前期研究发现,LRRK2很可能通过调控Rho GTPases信号通路的活化而在上皮细胞吞噬功能中起重要作用。尸检发现路易小体中LRRK2与α-Syn存在共定位。在α-Syn A53T转基因小鼠体内过表达LRRK2会加重表型及病变进展。以上研究表明,LRRK2与α-Syn的相互作用参与了PD的发病过程。
本研究发现小胶质细胞对α-Syn的吞噬与LRRK2的表达上调及Rho GTPases信号通路活化相关。由此我们认为,LRRK2活化Rho GTPases信号通路促进了小胶质细胞吞噬α-Syn寡聚体;调控LRRK2可能成为PD治疗一个新的方向。
[1] MassanoJ.Parkinson's disease: a clinical update[J].Acta Medica Portuguesa,2011, 24(Suppl4):827-834.
[2] Mollenhauer B, Forstl H, Deuschl G,et al. Lewy body and parkinsonian dementia: common, but often misdiagnosed conditions[J]. Deutsches Arzteblatt International, 2010,107(39): 684-691.
[3] Beraud D, Maguire-Zeiss KA. Misfolded alpha-synuclein and Toll-like receptors: therapeutic targets for Parkinson's disease[J]. Parkinsonism & Related Disorders,2012,18 (Suppl1):S17-S20.
[4] Hosoi T, Ozawa K. Molecular approaches to the treatment, prophylaxis, and diagnosis of Alzheimer's disease: endoplasmic reticulum stress and immunological stress in pathogenesis of Alzheimer's disease[J]. Journal of Pharmacological Sciences,2012,118(3): 319-324.
[5] Freundt EC, Maynard N, Clancy EK, et al. Neuron-to-neuron transmission of alpha-synuclein fibrils through axonal transport[J]. Annals of Neurology, 2012, 72(4): 517-524.
[6] Olanow CW, Brundin P. Parkinson's disease and alpha synuclein: is Parkinson's Disease a prion-like disorder[J].Movement Disorders, 2013, 28(1): 31-40.
[7] Biosa A, Trancikova A, Civiero L, et al. GTPase activity regulates kinase activity and cellular phenotypes of Parkinson's disease-associated LRRK2[J]. Human Molecular Genetics,2013, 22(6): 1 140-1 156.
[8] Depboylu C, Stricker S, Ghobril JP,et al. Brain-resident microglia predominate over infiltrating myeloid cells in activation, phagocytosis and interaction with T-lymphocytes in the MPTP mouse model of Parkinson disease[J]. Experimental Neurology,2012,238(2): 183-191.
[9] Tseng YT, Hsu YY, Shih YT, et al. Paeonol attenuates microglia-mediated inflammation and oxidative stress-induced neurotoxicity in rat primary microglia and cortical neurons[J]. Shock,2012, 37(3): 312-318.
[10] Jebelli JD, Dihanich S, Civiero L,et al. GTP binding and intramolecular regulation by the ROC domain of Death Associated Protein Kinase 1[J]. Scientific Reports,2012, 2: 695.
[11] Anand VS, Braithwaite SP. LRRK2 in Parkinson's disease: biochemical functions[J]. The FEBS Journal,2009, 276(22): 6 428-6 435.
(收稿2014-05-10)
The functions and mechanisms of Rho GTPases signaling pathway activation induced by LRRK2 in microglial phagocytosis of α-synuclein
DingXuebing*,WangXuejing,MaMingming,TengJunfang
*DepartmentofNeurology,theFirstAffiliatedHospitalofZhengzhouUniversity,Zhengzhu450052,China
Objective To investigate the mechanism of microglial phagocytosis of α-synuclein.Methods BV-2 cells activation model induced by α-synuclein oligomers was established. Immunofluorescence stain was performed to detect α-synuclein-positive inclusions in BV-2 cells. Western blot was performed to detect LRRK2 expression in BV-2 cells. Pull down was performed to detect Rho GTPases signaling pathway activation in BV-2 cells.Results Compared with the control group,α-synuclein-positive inclusions, LRRK2 expression and Rho GTPases signaling pathway activity in BV-2 cells significantly increased in theα-synuclein group.Conclusion The Rho GTPases signaling pathway activation induced by LRRK2 associate closely with microglial phagocytosis of α-synuclein.
LRRK2; Rho GTPases signaling pathway; Microglia; α-synuclein
国家自然科学基金项目(81301086)
R329.2
A
1673-5110(2014)23-0017-03
