抗结核治疗致药物性肝损伤的危险因素分析
2014-08-15杨永峰
王 芳,杨永峰
0 引言
药物性肝损伤(Drug induced liver injury,DILI)是指药物和/或化学物质经呼吸道、消化道和静脉等途径进入人体而导致的肝脏损伤。随着药物的广泛应用、新药的不断涌现和联合用药的增多,DILI已成为国内外常见且较严重的药源性疾病。目前报道有500~1 000种药物可引起DILI[1],其中抗结核药(异烟肼、利福平、吡嗪酰胺、对氨基水杨酸钠)较为常见[2-5]。
抗结核药物具有不同程度的肝脏毒性,长时间联合应用更加大了肝毒性,导致少数患者因严重肝功能损伤而中断治疗,甚至有极少数患者出现暴发性肝功能衰竭而死亡[6-8]。药物性肝损伤成为抗结核药物治疗中不可忽视的因素,但具体有哪些影响因素尚无定论。笔者分析南京市胸科医院2013年收治住院的451例结核患者的抗结核治疗过程,对可能造成肝损伤的危险因素进行回顾性分析。
1 资料与方法
1.1 一般资料 收集南京市胸科医院2013年451例结核病住院患者,入选标准:结核病诊断明确,接受抗结核治疗,治疗期间有完整的随访资料;排除自身免疫性肝炎、病毒性肝炎等[9]。
抗结核药物所致DILI的诊断标准:依据《抗结核药所致药物性肝损伤诊断与处理专家建议》[10],出现如下血清生化检测指标,即可判断为药物性肝损伤:ALT>2倍正常值上限(ULN)或结合胆红素>2倍ULN;或天冬氨酸转氨酶(AST)、碱性磷酸酶(ALP)和总胆红素同时升高,且至少1项>2倍ULN。
1.2 治疗方案 根据我国《肺结核门诊诊疗规范(2012年版)》,推荐的治疗方案如下:①初治肺结核:2HRZE/4HR或2H3R3Z3E3/4H3R3。②复治肺结核:2HRZES/6HRE或2H3R3Z3E3S3/6H3R3E3或3HRZE/6HRE。有药敏试验结果患者可根据药敏试验结果及既往用药史制订治疗方案。如果患者为多次治疗或治疗失败病例,可根据患者既往治疗史制订经验性治疗方案,获得药敏试验结果后及时调整治疗方案。③耐多药肺结核:6ZAm(Km,Cm)Lfx(Mfx)PAS(Cs,E)Pto/18ZLfx(Mfx)PAS(Cs,E)Pto(括号内为替代药物)。
其中,H:异烟肼,R:利福平,Z:吡嗪酰胺,E:乙胺丁醇,Lfx:左氧氟沙星,Mfx:莫西沙星,Am:阿米卡星,Km:卡那霉素,Pto:丙硫异烟胺,PAS:对氨基水杨酸,Cm:卷曲霉素,Cs:环丝氨酸。
1.3 统计方法 采用SPSS 16.0统计软件对数据进行统计分析,对研究因素进行单因素Logistic回归分析,对有统计学意义的因素再进行多因素Logistic回归分析,用比值比(OR)及95%的可信区间(CI)估计各因素与肝损伤产生的联系强度,P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 调查的451例患者中,男285例,女166例,年龄12~90岁,平均年龄(44.3±19.1)岁。调查变量的构成见表1。
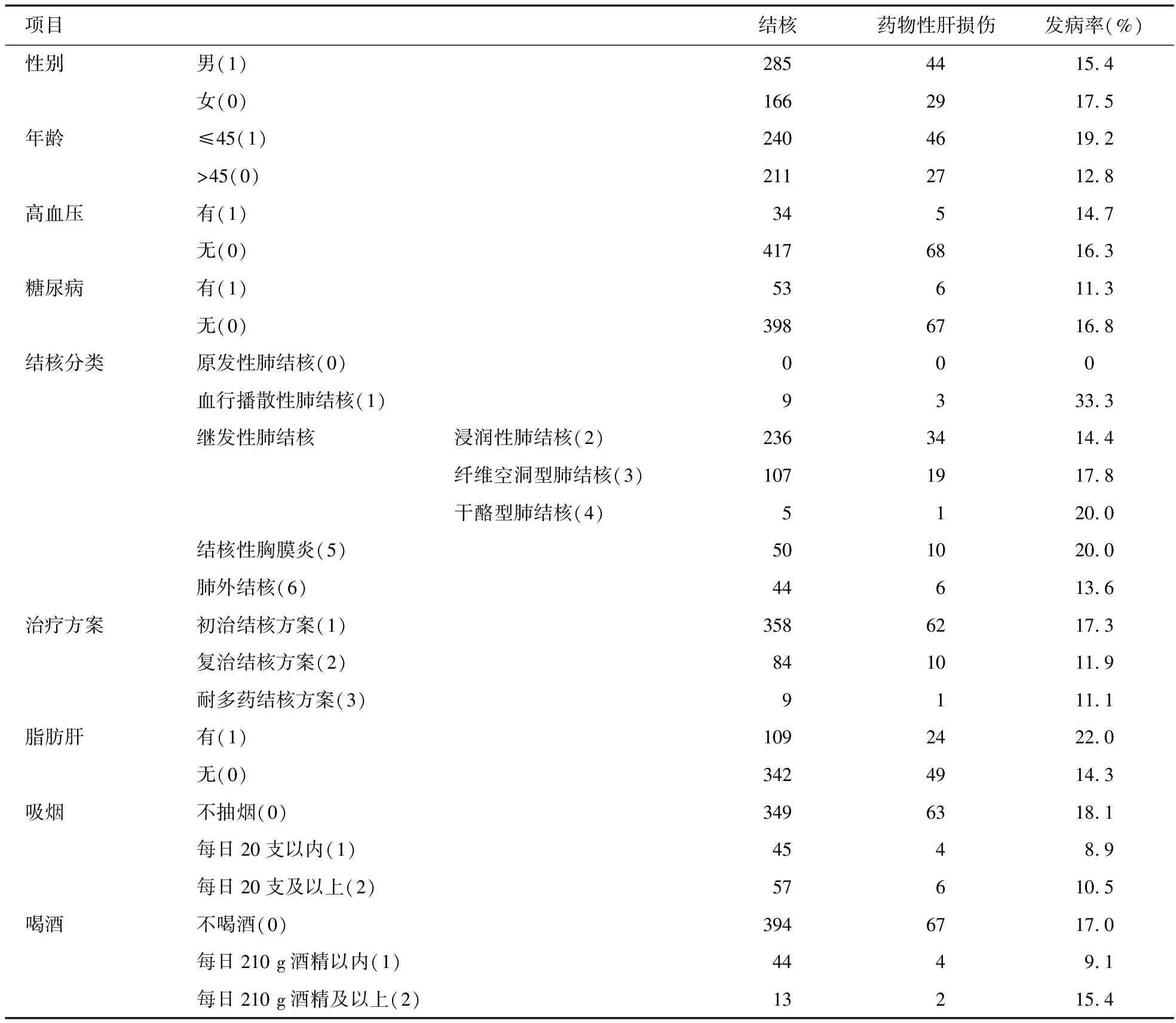
表1 抗结核药物致药物性肝损伤的影响因素分析(例)
2.2 多因素Logistic分析结果 以抗结核治疗是否致药物性肝损伤为因变量(1=药物性肝损伤,0=无药物性肝损伤),以性别、年龄、是否患有高血压、是否患有糖尿病、所患结核类型分类、治疗方案、脂肪肝、吸烟、喝酒等因素为自变量(见表1),在采用多因素Logistic回归模型分析时,根据自变量与抗结核治疗是否致药物性肝损伤的关联情况,逐步去除不显著变量(P>0.05),见表2。结果显示,影响抗结核治疗致药物性肝损伤的因素:脂肪肝和年龄,均为危险因素。
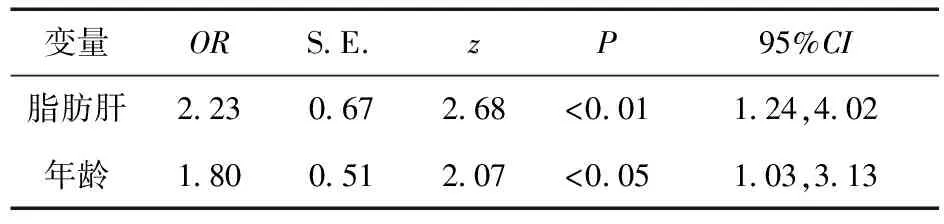
表2 多因素逐步Logistic回归分析
结合表1和表2,与抗结核治疗致药物性肝损伤的因素有关的统计学意义结果:①年龄:年龄是抗结核治疗致药物性肝损伤的危险因素,随着年龄的增大,抗结核治疗致药物性肝损伤在各年龄组所占比例逐渐减少,由≤45岁组的19.2%降至>45岁组的12.8%;②脂肪肝:脂肪肝是抗结核治疗致药物性肝损伤的危险因素,说明脂肪肝的出现,肝脏已具有产生病理损伤的潜在危险,其抗结核治疗致药物性肝损伤率为22.0%,大于无脂肪肝情况的14.3%。
3 讨论
南京市胸科医院所收治的结核患者主要来自江苏、安徽等周边经济欠发达地区,对2013年收治住院的结核病患者进行回顾性分析发现,抗结核治疗致药物性肝损伤是结核病正规化治疗过程的严重不良反应之一,发生率高达16.2%。为此,笔者对与抗结核治疗致药物性肝损伤可能相关的危险因素进行Logistic回归分析,结果显示,年龄(≤45岁)、脂肪肝是抗结核治疗致药物性肝损伤的独立危险因素。
年龄是抗结核治疗致药物性肝损伤的危险因素,随着年龄的增大,抗结核治疗致药物性肝损伤在各年龄组所占比例逐渐减少,由≤45岁组的19.2%降至>45岁组的12.8%。发病年龄以青壮年组(≤45岁)多,结合此组病例资料分析,与结核病以青壮年发病率高可能有关。另外,DILI的年轻化趋势可能与现代社会工作节奏快、竞争压力过大、不良生活习惯(饮酒等)及自我保健不够等因素有关。另外,DILI的主要机制:①药物及其中间代谢产物对肝脏有直接毒性作用,此类为剂量依赖性的DILI,可以预测;②机体对药物的特异质反应,包括过敏性(免疫特异质)及代谢性(代谢特异质),此类DILI与用药剂量和疗程无关,青壮年更易出现此类肝损伤[10]。
出现脂肪肝,说明肝脏具有产生肝损伤的潜在危险,其抗结核治疗致药物性肝损伤率为22.0%,高于无脂肪肝情况的14.3%。出现脂肪肝时,无论肝功能正常与否,其肝脏均存在不同程度的病理损伤。肝脏有疾患时,肝血流灌注障碍,肝血流量减少,使药物清除率下降:肝药酶活性下降,肝固有清除率减少,也损害了药物的清除;肝病患者血浆白蛋白含量下降,使其结合部位性质发生改变,降低了药物与血浆蛋白的结合。这些改变均导致多种药物清除变慢,生物半衰期延长,游离药物浓度增高,从而增加了药效和毒性。抗结核药物可能只是在原有基础上加重了肝脏的损伤。有研究表明,既往有肝病病史的患者在抗结核治疗过程中发生DILI的几率是无肝病病史者的20.86倍[11-13]。
在本组病例中,抗结核治疗致轻度肝损伤时,可不停抗结核药,加用保肝药物治疗,一般肝功能都能恢复正常。抗结核药致重度肝损伤,须及时停用抗结核药物,否则可能导致不可逆的肝功能损伤。
综上所述,对青壮年(≤45岁)人群、脂肪肝患者,应采取勤监测、早发现、早治疗的措施,对于减少抗结核治疗药物性肝损伤的不良反应、改善患者临床症状、减轻患者负担具有重要意义。
参考文献:
[1] 杨颖,王学清,李岩.药物性肝病临床分析[J].实用药物与临床,2009,12(2):82-84.
[2] 肖东楼,马玙,朱莉贞.抗结核药品不良反应诊疗手册[M].北京:人民卫生出版社,2010:14-62.
[3] 卢水华,王琳,肖和平.抗结核药物性肝损害[J].医药导报,2011,30:767-769.
[4] Ball P,Stahlmann R,Kubin R,et al.Safety profile of oral and intravenous moxifloxacin:cumulative data from clinical trials and postmarketing studies[J].Clin Ther,2004,26(7):940-950.
[5] 曹天高,赵肖霞.抗结核药物致肝损害70例临床分析[J].实用药物与临床,2005,8(1):36-37.
[6] 唐神结,高文.临床结核病学[M].北京:人民卫生出版社,2011:191-200.
[7] Rangnekar AS,Fontana RJ.An update on drug induced liver injury[J].Minerva Gastroenterol Dietol,2011,57:213-229.
[8] 吴于青,孙琦,邓国防.抗结核药物性肝炎患者外周血IFN-γ、IL-10的水平分析[J].实用医学杂志,2012,28(4):605-607.
[9] 厉有名.药物性肝损害的临床类型及诊断策略[J].中华肝病杂志,2004,12(7):445-446.
[10]中华医学会结核病学分会.抗结核药所致药物性肝损伤诊断与处理专家建议[J].中华结核和呼吸杂志,2013,36(10):732-736.
[11]孙翠芬,李净,华来庆,等.结核患者药物性肝损害影响因素分析[J].江苏医药,2004,30(12):949-950.
[12]李燕平,杨玉前,张延源,等.肺结核合并乙型肝炎病毒感染药物性肝损伤的临床观察[J].北京医学,2013,35(9):806-807.
[13]刘芳,李波.药物引起肝脏损伤的评价与检测[J].药物分析杂志,2010,30(10):1981-1984.
