金雀异黄素对CIA大鼠促炎和抗炎因子分泌的影响
2014-08-15马莹莹许金鑫王燕茹
马莹莹,张 育,许金鑫,王燕茹
0 引言
类风湿关节炎(RA)是以滑膜增生和进行性关节破坏为特征的慢性炎症性自身免疫性疾病,可导致不可逆转的关节软骨和骨破坏[1-2]。在RA,成纤维样滑膜细胞(FLS)通过许多信号通路对IL-1β、IL-6、IL-8、IL-12、IL-17、IL-18、IL-21、IL-27、肿瘤坏死因子-α(TNF-α)和干扰素-γ(IFN-γ)等促炎因子产生炎症应答,进一步诱导细胞因子和炎症趋化因子以及基质金属蛋白酶(MMP)的表达导致组织损伤[1],这些细胞因子在滑膜细胞增殖和关节血管翳形成中发挥主要作用[2]。除了促炎细胞因子和炎症趋化因子外,许多抗炎因子也与RA的发病相关[3]。
近年来的研究表明,金雀异黄素(Genistein,gen)具有抗癌、抗氧化、抗炎等生物学功能,不仅在分子水平可以抑制酪氨酸特异性蛋白激酶,并且在细胞水平可以诱导细胞凋亡,抑制细胞增殖,抑制破骨细胞和淋巴细胞的功能,发挥抗氧化效应[4-5]。我们的前期实验发现,Gen可以抑制CIA大鼠滑膜细胞IL-1β、TNF-α等炎症因子的表达[6-7]。为进一步探讨Gen对RA的治疗作用,本实验观察了Gen对CIA大鼠分泌的促炎和抗炎因子的影响。
1 材料与方法
1.1 实验药物 金雀异黄素纯品(纯度≥99%)购自上海融合医药科技发展有限公司。按实验要求配成50 μm Gen治疗组、100 μm Gen治疗组、200 μm Gen治疗组。
1.2 实验动物 雌性近交系SD大鼠,清洁级,5~6周龄,平均体重(170±20)g,购于南京医科大学实验动物中心,实验动物使用许可证号:SCXK(苏)2007-0001。
1.3 试剂 Ⅱ型胶原、完全弗氏佐剂购自Sigma公司;LT-α兔抗大鼠多克隆抗体购自武汉博士德生物工程有限公司;IL-4、IL-6、IL-10兔抗大鼠单克隆抗体均购自北京博奥森生物技术有限公司;IL-8兔抗大鼠单克隆抗体购自英国Abcam公司;TGF-β1兔抗大鼠单克隆抗体购自美国Santa Cruz公司;辣根过氧化物酶(HRP)标记的羊抗兔二抗购自武汉博士德生物工程有限公司;单组分四甲基联苯胺(TMB)显色液购于北京索莱宝科技有限公司。
1.4 仪器 酶标仪MK3(ELX800)(BIO-TEK公司)、台式离心机(TDL-5-A)(上海安亭科学仪器厂)、电热恒温水浴箱(DKB-8A)(上海精密实验设备有限公司)、BMJ-III型包埋机(常州中威电子仪器厂)、石蜡切片机(RM2145)(LEICA)、玻片漂烘仪(PHY988)(常州中威电子仪器厂)。
1.5 实验方法
1.5.1 动物模型的建立 60只雌性SD大鼠随机抽样分成2组,分别为编号1~10为空白对照组,剩余50只为造模组。大鼠在清洁级环境中适应喂养1周后,建立CIA大鼠模型。模型组SD大鼠的左后足跖皮内注射1mLⅡ型胶原乳剂,1周后以每只0.1 mL剂量尾根部皮内多点激发注射加强免疫。空白对照组以生理盐水注射,方法同模型组。
1.5.2 动物模型的评价 AI评分和关节肿胀度测定:按常规方法进行评估[7]。
1.5.3 大鼠用药及分组 造模组50只大鼠造模后以SPSS 16.0软件随机抽样分为5组,分别为:模型对照组、50 μm Gen治疗组、100 μm Gen治疗组、200 μm Gen治疗组和MTX阳性对照组。于造模次日开始用药,各Gen治疗组每天胃内灌注Gen混悬液1 mL;MTX阳性对照组于造模后开始用药,每周胃内灌注1次MTX 1 mL,浓度为0.1 mg/mL;而空白组和模型对照组每天灌注等量的生理盐水。
1.5.4 关节滑膜病理检测 治疗后第5周用3%戊巴比妥钠腹腔内注射麻醉各组大鼠,取膝关节置入10%甲醛溶液中固定48 h。常规制片染色,显微镜下观察病理形态并拍照。
1.5.5 间接ELISA法检测Gen对CIA大鼠血清中细胞因子分泌的影响 用方阵滴定试验确定一抗和二抗最佳稀释浓度;用包被缓冲液把血清稀释5倍后加入酶标板中放4 ℃冰箱过夜,次日用PBST洗板3次后加入3%BSA封闭2 h,随后洗板加入稀释好的一抗放孵箱1 h,再次洗板3次后加用酶标二抗37 ℃孵育1 h,洗板后每孔加入单组分TMB显色液100 μL,37 ℃避光显色10~20 min后加入终止液终止显色,用酶标仪检测450 nm波长时各孔的吸光值。
1.6 统计学方法 所有统计学处理在SPSS 16.0及Excel 2003软件中完成,P<0.05为差异有统计学意义。
2 结果
2.1 AI评分 见表1。
2.2 足肢肿胀程度 见图1。
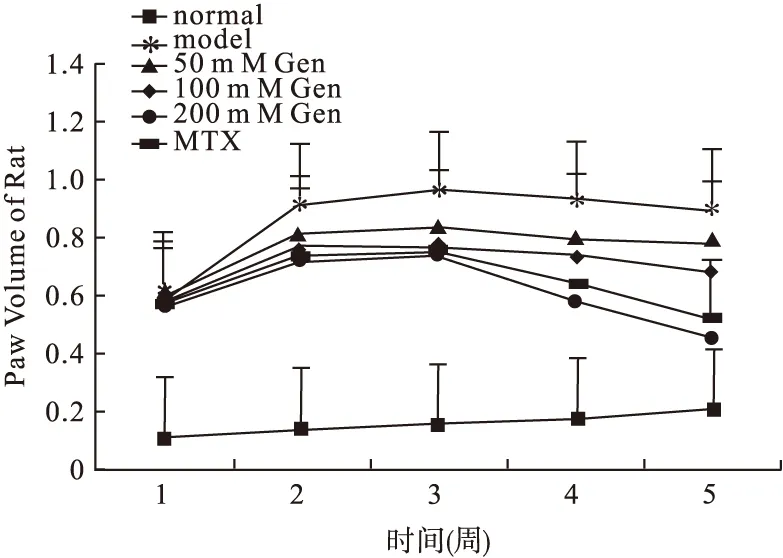
图1 CIA大鼠足爪肿胀度

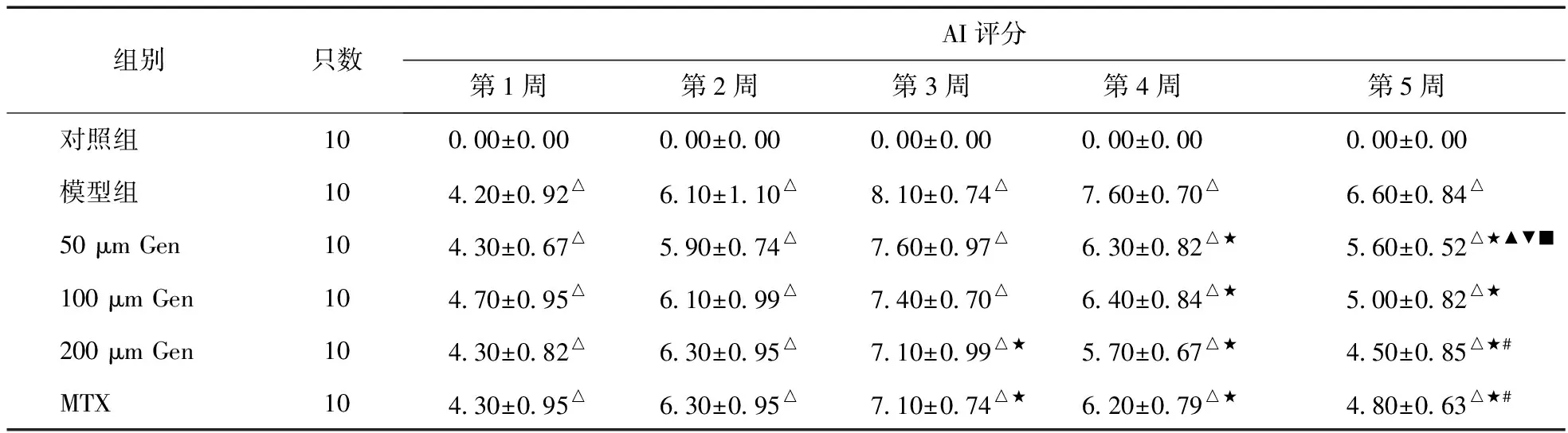
注:与对照组比较,△P<0.05;与模型组比较,★P<0.05;与50 μm Gen组比较,#P<0.05;与100 μm Gen组比较,▲P<0.05;与200 μm Gen组比较,▼P<0.05;与MTX组比较,■P<0.05
2.3 滑膜病理检测 模型对照组大鼠滑膜明显增厚,有大量炎性细胞浸润和纤维组织增生;而空白对照组滑膜未见上述症状。见图2。
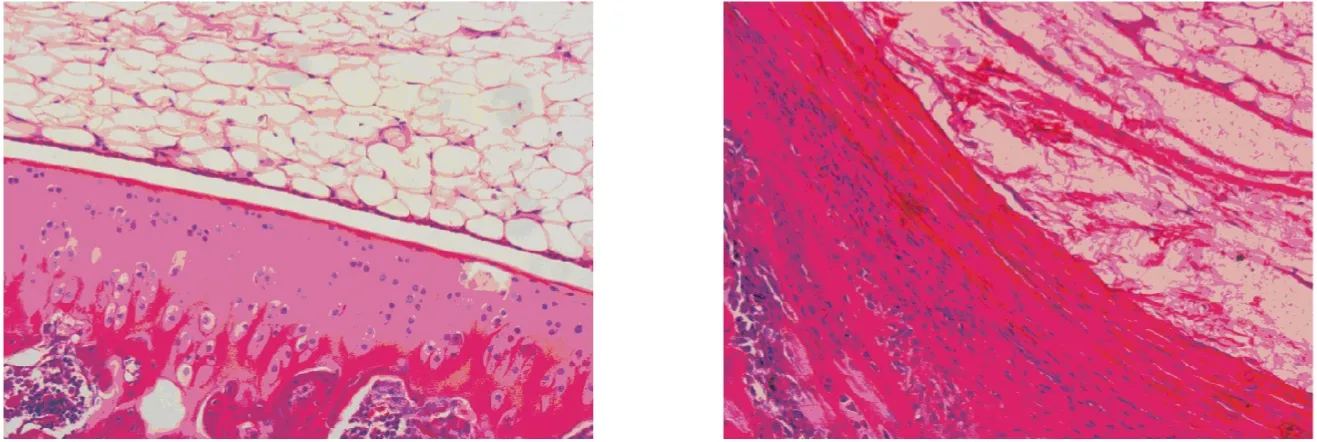
图2 滑膜组织的病理图片(HE×200)
从CIA大鼠的AI评分、足肢肿胀度测定及关节滑膜病检测显示,CIA大鼠造模获得了成功。
2.4 间接ELISA法检测大鼠血清细胞因子表达
2.4.1 Gen对CIA大鼠血清中促炎因子LT-α、IL-6和IL-8表达的影响 模型对照组大鼠血清中IL-6、IL-8、LT-α的分泌明显高于空白对照组(P<0.05),Gen治疗组和MTX阳性对照组与模型对照组相比,上述细胞因子的表达均明显降低。Gen对IL-6和IL-8的抑制作用呈剂量依赖性,随剂量增加,抑制作用逐渐增强。50 μm Gen组对IL-6的抑制作用弱于MTX(0.1 mg/mL)组,而100 μm Gen组、200 μm Gen组对IL-6的抑制作用与MTX组相当。50 μm Gen组和100 μm Gen组对IL-8的抑制作用弱于MTX(0.1 mg/mL)组,200 μm Gen组对IL-8的抑制作用与MTX组相当。三种剂量Gen组对LT-α的抑制作用相当,差异无统计学意义,对LT-α的抑制作用均弱于MTX阳性对照组。见图3~图5。
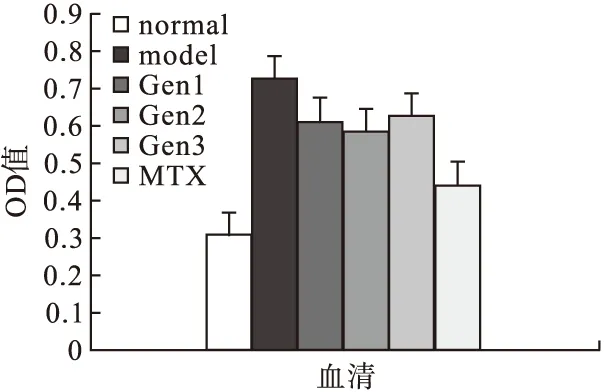
图3 各组大鼠LT-α水平的比较
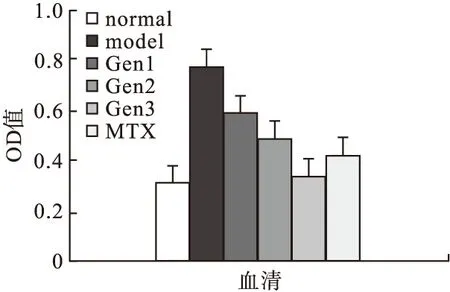
图4 各组大鼠IL-6水平的比较

图5 各组大鼠IL-8水平的比较
2.4.2 Gen对CIA大鼠血清中抗炎因子IL-4、IL-10和TGF-β1表达的影响 模型组大鼠血清中的细胞因子IL-4、IL-10、TGF-β1的表达水平低于空白对照组(P<0.05),Gen和MTX均能上调上述因子的表达;Gen的上调作用呈剂量依赖性,随剂量增加,促进作用增强。50 μM Gen组对IL-4的诱导作用弱于MTX,100 μm Gen组对IL-4的抑制作用与MTX相当,200 μm Gen组与MTX组对IL-4的诱导作用无统计学差异。50 μm Gen组、100 μm Gen组对IL-10的促进作用低于MTX组,而200 μm Gen组对IL-10的上调作用与MTX阳性对照组作用相当。三种剂量Gen治疗组与MTX组对TGF-β1的诱导作用均存在差异,50 μm Gen组、100 μm Gen组的Gen对TGF-β1的诱导作用均弱于MTX组,而200 μm Gen组对TGF-β1的诱导作用比MTX组强。见图6~图8。
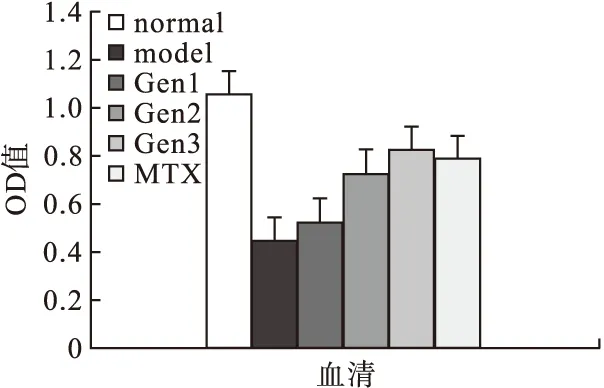
图6 各组大鼠IL-4水平的比较
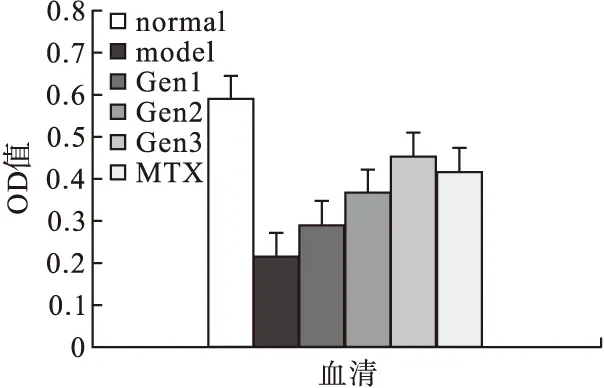
图7 各组大鼠IL-10水平的比较
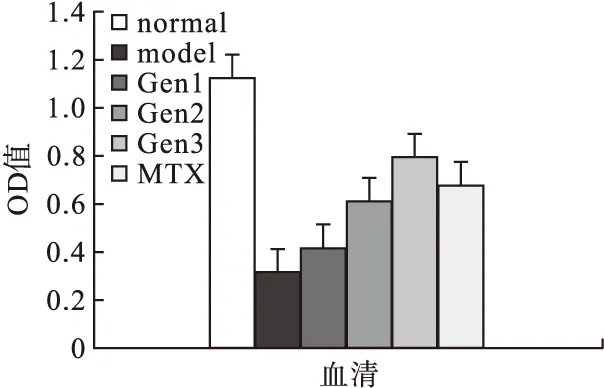
图8 各组大鼠TGF-β1水平的比较
3 讨论
RA是以关节滑膜组织慢性炎症为特征的自身免疫性疾病,可引起软骨破坏和骨侵蚀。CIA是一个被公认的类风湿关节炎的动物模型[8]。本实验应用Ⅱ型胶原构建CIA大鼠模型,造模后出现关节肿胀伴活动受限,观察AI评分、后肢容积以及关节滑膜组织病理发现,造模组与空白对照组比较有统计学差异,提示造模成功。
在RA中IL-1β、TNF-α和IL-6等促炎因子在RA关节中高度表达,且在RA的发病机制中发挥主要作用。FLS经上述促炎因子刺激后,可产生炎症趋化因子、MMPs、前列腺素E2(PGE2)和环氧化酶-2(COX-2),这些均进一步促进炎症、滑膜增生和软骨破坏[9]。LT-α又称TNF-β,属于TNF超家族,有研究发现,在RA FLS中LT-α可活化有丝分裂原相关蛋白激酶(MAPK)细胞外信号调节激酶(ERK1/2)和P38,以及磷酸肌醇3激酶(PI3K/AKT),这些信号通路可以促进细胞增殖[1]。而且在CIA动物模型中,用单克隆抗体阻断LT-α后,病情明显缓解,提示LT-α参与RA的病理过程。LT-α通过活化巨噬细胞产生促炎因子IL-6、IL-8、MMP-3来产生作用。IL-6、IL-8可活化巨噬细胞产生炎症反应,而MMP-3在RA中直接导致关节破坏[1,10]。本实验数据表明,CIA模型组大鼠血清中IL-6、IL-8、LT-α的分泌明显高于空白对照组,进一步证实了上述促炎因子参与RA的炎症过程,在RA滑膜炎症的发病机制中可能起着重要的作用。
在RA中FLS、白细胞和淋巴细胞分泌的促炎和抗炎因子的失调与关节炎症和软骨破坏有关[3]。许多研究表明,IL-4在RA发病过程中通过抑制细胞反应和炎性细胞因子而起抗炎作用,IL-4还可抑制滑膜细胞的增殖,抑制成纤维样滑膜细胞中血管内皮生长因子的产生[11-12]。另外,IL-10可下调RA的炎症应答,IL-10通过抑制核因子κB而抑制TNF-α、IL-2、IFN-γ的产生,还可抑制Th1细胞介导的淋巴细胞活性,抑制NO的合成和PGE2的产生[11]。TGF-β1是RA滑膜炎和滑膜增生的主要抑制因子,关节滑膜中TGF-β1的增加与关节炎的病理改变有关,可以抑制局部炎症细胞核淋巴细胞的功能[13]。本实验中发现,CIA模型组大鼠血清中IL-4、IL-10、TGF-β1的表达明显低于空白对照组,提示上述抗炎因子在RA的病理过程中,分泌减少,导致促炎因子和抗炎因子的失调,使得RA的炎症病理过程进一步发展。
Gen作为酪氨酸激酶抑制剂,可以有效抑制脂多糖(LPS)诱导的NF-κB的活化,在体外试验中可同时抑制NF-κB相关的细胞因子(IL-6、IL-8、TNF-α)的产生[5]。Gen在抑制脾细胞增生中发挥作用,可降低INF-γ的水平,刺激IL-4的分泌,且Gen在免疫调节中的作用在于保持Th1/Th2的平衡。本研究结果表明,Gen能下调促炎因子IL-6、IL-8、LT-α的分泌,200 μM Gen组对IL-6、IL-8的抑制作用与MTX相当,而各Gen治疗组对LT-α的抑制作用均弱于MTX;Gen能上调抗炎因子IL-4、IL-10、TGF-β1的分泌。100 μM Gen组对IL-4的上调作用与MTX相当;200 μM Gen组对IL-10的上调作用与MTX相当;200 μM Gen组对TGF-β1的上调作用强于MTX,提示Gen可能通过抑制RA炎症因子的释放,增加抗炎因子的表达来改善关节炎大鼠滑膜炎症。
参考文献:
[1] Calmon-Hamaty F,Combe B,Hahne M,et al.Lymphotoxin-α stimulates proliferation and pro-inflammatory cytokine secretion of rheumatoid arthritis synovial fibroblasts[J].Cytokine,2011,53(2):207-214.
[2] Lee SW,Kim JH,Park MC,et al.Alleviation of rheumatoid arthritis by cell-transducible methotrexate upon transcutaneous delivery[J].Biomaterials,2012,33(5):1563-1572.
[3] Bader RA,Wagoner KL.Modulation of the response of rheumatoid arthritis synovial fibroblasts to proinflammatory stimulants with cyclic tensile strain[J].Cytokine,2010,51(1):35-41.
[4] Ji G,Yang Q,Hao J,et al.Anti-inflammatory effect of genistein on non-alcoholic steatohepatitis rats induced by high fat diet and its potential mechanisms[J].Int Immunopharmacol,2011,11(6):762-768.
[5] De Paula ML,Rodrigues DH,Teixeira HC,et al.Genistein down-modulates pro-inflammatory cytokines and reverses clinical signs of experimental autoimmune encephalomyelitis[J].Int Immunopharmacol,2008,8(9):1291-1297.
[6] 高波,张育,马莉,等.金雀异黄素对Ⅱ型胶原诱导型关节炎大鼠成纤维样滑膜细胞分泌白细胞介素1β和肿瘤坏死因子α的影响[J].中西医结合学报,2009,7(7):636-641.
[7] 许金鑫,张育,张学增,等.金雀异黄素对CIA大鼠炎症及细胞因子影响的研究[J].实用临床医药杂志,2010,14(19):1-5.
[8] Ebina K,Oshima K,Matsuda M,et al.Adenovirus-mediated gene transfer of adiponectin reduces the severity of collagen-induced arthritis in mice[J].Biochem Biophys Res Commun,2009,378(2):186-191.
[9] Umar S,Zargan J,Ahmad S,et al.Modulation of the oxidative stress and inflammatory cytokine response by thymoquinone in the collagen induced arthritis in Wistar rats[J].Chem Biol Interact,2012,197(1):40-46.
[10]Boissier MC,Assier E,Falgarone G,et al.Shifting the imbalance from Th1/Th2 to Th17/treg:The changing rheumatoid arthritis paradigm[J].Joint Bone Spine,2008,75(4):373-375.
[11]徐晓玲,梁瑞霞,黄君健,等.细胞因子在类风湿关节炎发病机制中的作用[J].生物技术通讯,2008,19(1):111-114.
[12]Wallis SK,Cooney LA,Endres JL,et al.A polymorphism in the interleukin-4 receptor affects the ability of interleukin-4 to regulate Th17 cells:a possible immunoregulatory mechanism for genetic control of the severity of rheumatoid arthritis[J].Arthritis Res Ther,2011,13(1):R15.
[13]马丽辉,乔振华,李小峰,等.异基因骨髓间充质干细胞移植对类风湿关节炎大鼠血清IL-1、TNF-α、TGF-β1表达的影响[J].中华临床免疫和变态反应杂志,2011,5(1):10-16.
