金银花-山银花水提液不同配比体外抗氧化作用研究
2014-08-15蒋宝平樊晓峰
田 磊,蒋宝平,何 苗,李 申,樊晓峰*
0 引言
金银花作为常用中药材,具有清热解毒、凉散风寒的功效。《中国药典》2000年版及之前版本将金银花和山银花作为一个品种收载,2005年版和2010年版将其分开收载[1]。金银花为忍冬科植物忍冬LonicerajaponicaThunb.的干燥花蕾或带初开的花;山银花为忍冬科植物灰毡毛忍冬L.macranthoidesHand.-Mazz.、红腺忍冬L.hypoglaucaMiq.、华南忍冬L.confusaDC.或黄褐毛忍冬L.fulvotomentosaHsu et S.C.Cheng的干燥花蕾或带初开的花[2]。金银花和山银花都含有黄酮类和有机酸类成分,具有清除人体超氧离子自由基的作用,在抗衰老、改善血管功能与提高机体免疫力等方面均具有重要作用[3],但金银花较山银花昂贵。因此,能否用山银花代替金银花,或者两者混合使用是否能实现单用金银花的效果是临床关注的问题,目前,二者以不同的配比合用之后抗氧化作用如何变化,未见相关文献报道。本研究选择金银花和山银花水提液的不同配比(1∶0、2∶1、1∶1、1∶2、0∶1),比较金银花和山银花水提液合用后体外抗氧化作用,为合理应用金银花和山银花提供一定的依据。
1 材料
1.1 药品与试剂 中药金银花、山银花购自亳州市豪门中药饮片有限公司,金银花经鉴定为忍冬科植物忍冬LonicerajaponicaThunb.的干燥花蕾或带初开的花,山银花经鉴定为忍冬科植物灰毡毛忍冬L.macranthoidesHand.-Mazz的干燥花蕾或带初开的花。
盐酸(上海中试化工总公司,批号:20100913),邻苯三酚(遵义林源医药化工有限责任公司,批号:101120),水杨酸(成都市科龙化工试剂厂,批号:20100804),无水乙醇(南京化学试剂有限公司,批号:11031410288),硫酸亚铁(上海久亿化学试剂有限公司,批号:20100108),双氧水(成都市科龙化工试剂厂,批号:20110114),DPPH (ALDRICH公司,批号:D913-2),改良型RPMI-1640培养基(Hyclone,批号:NWCO387),胎牛血清(Fetal Bovine Serum,FBS,浙江天杭生物科技有限公司,批号:100517),双抗(青霉素—链霉素,GiBCO,USA,批号:15140),噻唑蓝(MTT,Amresco,批号:0793),二甲基亚砜(Dimethyl sulfoxide,DMSO,Sigma,批号:D5879),胰蛋白酶(Trypsin,USA,Sigma,批号:27250018),PBS粉末(福州迈新恒武技术开发有限公司,批号:11030202Y)。乳酸脱氢酶(LDH)检测试剂盒(批号:20110625),一氧化氮(NO)检测试剂盒(批号:20110625),微量丙二醛(MDA)检测试剂盒(批号:20110625)。
1.2 细胞株 人脐静脉内皮细胞(HUVECS),南京凯基生物技术发展有限公司。
1.3 仪器 JA-1203电子天平:上海天平仪器厂;电热恒温鼓风干燥箱:上海精宏实验设备有限公司;AY120型分析天平:Shimadzu corporation,Japan;酶标仪:SPECTRA MAX190型酶联免疫检测仪,Molecular Devices;CHK-213倒置显微镜,OLYMPUS;5% CO2培养箱,Forma311,USA;ELS-10T生命科学型超纯水机,南京易普易达科技发展有限公司;立式压力蒸汽灭菌器,上海申安医疗器械厂。
2 方法
2.1 药品的提取 金银花和山银花的水提液采用文献方法[4]提取。根据预试验结果,将金银花与山银花水提液按照1∶0、2∶1、1∶1、1∶2、0∶1混合制成混合液,并按实验要求配制成所需浓度。
2.2 抗氧化活性筛选方法
2.2.1 DPPH·自由基清除率的测定[5]配制浓度为0.1 mmol/L的DPPH无水乙醇溶液,待测样品以无水乙醇溶解并稀释成不同浓度的溶液。按以下计算公式中的方法加样,室温下反应30 min,在波长517 nm处测定吸光值。每样重复3次,取平均值,按下式计算自由基清除率:K= [1-(Ai-Aj)/Ac]×100%,式中Ai为2 mL DPPH溶液加2 mL待测溶液的吸光值;Aj为2 mL待测溶液加2 mL乙醇的吸光值;Ac为2 mL DPPH溶液加2 mL乙醇的吸光值。
2.2.2 羟自由基(·OH)清除率的测定[6]在试管中依次加9 mmol/L水杨酸—乙醇溶液0.5 mL,0.5 mL不同浓度的待测样品,9 mmol/L Fe2+溶液(现配)0.5 mL,3.5 mL蒸馏水,最后加入8.8 mmol/L H2O25 mL启动Fenton反应,37 ℃反应30 min,摇匀后于510 nm处测定吸光值A1。每样重复3次,取平均值,下列公式计算羟自由基的清除率:K=[1-(A1-A2)/A3]×100%。式中A1为加入9 mmol/L Fe2+溶液测得的吸光值;A2为以0.5 mL 蒸馏水代替9 mmol/L Fe2+溶液测得的吸光值;A3为0.5 mL蒸馏水代替待测样品测得的吸光值。
2.2.3 超氧阴离子(O2-·)清除率的测定[6]采用邻苯三酚自氧化法测定对超氧阴离子自由基的清除作用。取10 mmol/L PBS缓冲液4.5 mL (pH 8.3)与100 μL不同浓度的待测样品混合,于25 ℃恒温15 min,取混合液3 mL加入45 mmol/L 邻苯三酚100 μL,摇匀,反应3 min后于420 nm处测定吸光值A1。每样重复3次,取平均值,按下式计算超氧阴离子自由基的清除率:K= [1-(A1-A2)/A3]×100%,式中A1为4.5 mL PBS缓冲液加100 μL待测样品,加100 μL邻苯三酚溶液的吸光值;A2为4.5 mL PBS缓冲液加100 μL10 mmol/L HCl加100 μL蒸馏水的吸光值;A3为4.5 mL PBS缓冲液加100 μL邻苯三酚加100 μL蒸馏水的吸光值。
2.2.4 内皮细胞的培养和过氧化氢造模浓度筛选[7]HUVECs按照常规方法培养,取细胞浓度为1×105/mL,接种于96孔板,待细胞长满单层融合后,弃去上清,加入不同浓度的过氧化氢使其终浓度为300、200、150、100、50 μmol/L,空白对照组不加任何溶液,继续培养12 h后弃去培养基,每孔加入终浓度为0.5 mg/mL的MTT溶液,37 ℃孵育4 h后弃去MTT溶液,每孔加入200 μL DMSO后室温振摇10 min,使结晶充分溶解。选择490 nm,在酶标仪上测定每孔的吸光值。按抑制率公式,计算H2O2对HUVECs细胞的生长抑制作用。生长抑制率(%)=(空白组OD-给药组OD)/(空白组OD-调零孔OD值)×100%。
2.2.5 药物对HUVECs上清中LDH、NO含量的影响[8]将细胞浓度调整为1×105/mL,接种于24孔板上继续培养,待细胞长满单层融合后弃去上清,以含0.5%血清的培养液培养12 h,使其同步化生长用于试验。分组:空白对照组,用无血清的1640培养液;模型组,无血清的培养液+60 μmol/L H2O2作用12 h;不同浓度样品组,加入含有不同浓度样品的培养液预孵2 h后,换为含有60 μmol/L H2O2的培养液作用12 h,收集培养液试剂盒检测。
3 结果与分析
3.1 金银花-山银花水提液不同配比清除DPPH·自由基的能力 金银花-山银花水提液不同配比均具有清除DPPH·自由基的能力,其不同配比清除DPPH·的IC50值分别为10.41、5.68、6.18、20.99、4.28 mg/mL。根据IC50值的大小,金银花-山银花不同配比清除DPPH·自由基的能力大小顺序为:0∶1>2∶1>1∶1>1∶0>1∶2。见图1。
3.2 金银花-山银花水提液不同配比清除羟自由基(·OH)的能力 通过Fenton反应体系产生·OH,可以测定各提取液对·OH的清除能力。由于药液带有颜色,为了排除药液本身对实验结果的干扰,浓度控制在250 mg/mL范围内。本研究结果表明,金银花-山银花不同配比均具有清除·OH的能力,其不同配比在浓度允许范围内清除·OH能够达到的最大抑制率的顺序依次为:2∶1>0∶1>1∶1>1∶2>1∶0。见图2。
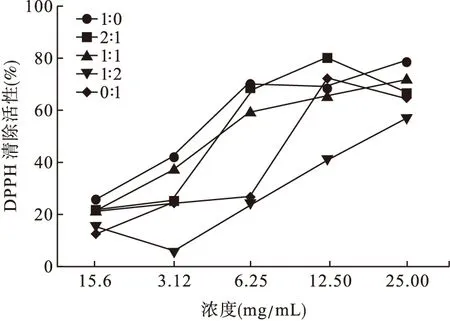
图1 不同配比清除DPPH·自由基的能力

图2 不同配比清除羟自由基的能力
3.3 金银花-山银花水提液不同配比清除超氧阴离子(O2-·)的能力 本研究采用硝基四氮唑蓝还原法,通过检测吸光度的变化确定提取物清除O2-·的能力大小。由于药液带有颜色,为了排除药液本身对实验结果的干扰,将浓度控制在250 mg/mL范围内。结果显示,金银花-山银花不同配比均具有清除O2-·的能力,其不同配比在浓度允许的范围内清除O2-·能够达到的最大抑制率的顺序依次为:1∶0>2∶1>1∶1>1∶2>0∶1。见图3。
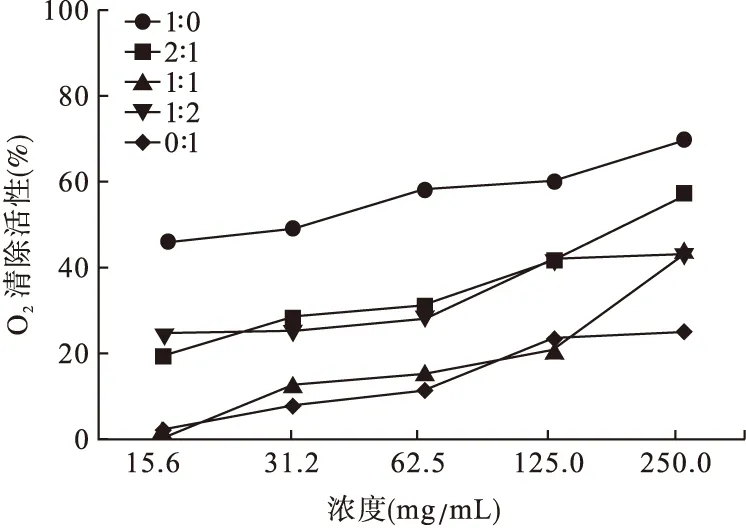
图3 不同配比清除超氧阴离子的能力
3.4 金银花-山银花水提液不同配比对H2O2诱导HUVECs细胞损伤的影响
3.4.1 H2O2浓度的筛选 计算不同浓度的H2O2对HUVECs细胞的生长抑制率并计算半数抑制率后,将H2O2浓度最终确立为60 μmol/L,见表1。

表1 不同浓度H2O2对HUVECs细胞增殖抑制率的影响
3.4.2 金银花-山银花水提液不同配比对H2O2诱导HUVECs细胞损伤的影响 H2O2损伤后,模型组细胞活力明显下降,不同浓度药物干预后,细胞H2O2的损伤程度较模型组低。H2O2损伤后,模型组细胞LDH释放量明显增加,不同浓度药物干预后可明显减少HUVECs细胞释放LDH。H2O2损伤后,模型组细胞上清中NO含量减少,药物干预后使细胞上清中NO含量增加。各指标结果综合显示,金银花-山银花水提液能够对抗H2O2诱导的HUVECs细胞损伤,作用强弱依次为:1∶0>2∶1>1∶2>1∶1>0∶1。见表2。

表2 金银花-山银花水提液不同配比对抑制HUVEC细胞H2O2损伤的作用及对细胞中LDH和NO的影响(n=3)
4 讨论
1,1-二苯基-2-苦肼基自由基(DPPH·)有单电子,在517 nm处有强吸收,其醇溶液呈紫色的特性。当有自由基清除剂存在时,由于与其单电子配对而使其吸收逐渐消失,其褪色程度与其接受的电子数量成定量关系,所以,可用分光光度计进行快速的定量分析。超氧阴离子自由基(O2-·)、羟基自由基(·OH)等活性氧自由基是在机体代谢过程中产生的。在某些病理情况下,许多疾病,如动脉粥样硬化、心脑血管疾病、中枢神经系统功能障碍、糖尿病、癌症及肝脏的化学毒性反应、衰老、休克、炎症等病理过程的发生都直接或间接与自由基的损伤有关[9-11]。体外抗氧化实验结果显示,金银花-山银花水提液不同配比各剂量组均具有抗氧化作用,其中金银花-山银花2∶1组综合效果最佳。
血管内皮细胞功能与心血管的发生和发展密切相关。H2O2是经典的氧化剂,可使多种细胞氧化损伤,促进羟自由基的产生,诱导细胞膜脂质过氧化反应。本实验采用60 μmol/L H2O2作用于HUVECs细胞,细胞活力明显下降,金银花-山银花不同配比组干预后可以明显抑制H2O2的损伤,抑制效果以金银花-山银花1∶0组最强,2∶1组次之。LDH反映细胞膜完整性和细胞收到损伤与死亡程度[12]。内皮细胞合成的NO是一种内源性抗氧化剂,能抑制多种凋亡刺激因素引起的细胞损伤[13]。本研究结果显示,金银花-山银花不同配比能够使受损细胞NO的含量增加、LDH释放减少,其中金银花-山银花1∶0组作用最强,2∶1组次之。
综上所述,金银花-山银花不同配比均有一定的抗氧化作用,尤其是金银花-山银花2∶1配比体外抗自由基、抗氧化及保护H2O2损伤的HUVECs细胞的作用最佳,为金银花及山银花的应用提供了一定的理论依据。
参考文献:
[1] 中国药典委员会.中华人民共和国药典(一部)[S].2010年版.北京:中国医药科技出版社,2010,28:205.
[2] 王芳,蒋跃平,王晓良,等.金银花的化学成分研究[J].中国中药杂志,2013,38(9):1378-1385.
[3] 王芳,高松.金银花、山银花药理学研究现状[J].辽宁中医药大学学报,2013,15(4):237-239.
[4] 高红宁.微滤-超滤法精制金银花水提液[J].中国实验方剂学杂志,2011,10(17):54-55.
[5] 陈瀚,李进,李祥,等.板蓝根不同提取部位的体外抗氧化活性[J].中国实验方剂学杂志,2012,18(9):184-186.
[6] 陈莉,肖永成,林晶.刺山柑果实醇提取物的体外抗氧化活性[J].福建中医药大学学报,2010,20(5):44-46.
[7] Zhai L,Zhang P,Sun RY,et al.Cytoprotective effects of CSTMP a novel stilbene derivative against H2O2 induced oxidative stress in human endothelial cells[J].Pharmacol Rep,2011,63(6):1469-1480.
[8] 王晓斌,于锋,刘飞.丹酚酸B对内皮细胞氧化损伤的保护作用及机制研究[J].东南大学学报,2008,27(1):42-46.
[9] 黄美艳,唐于平,尚尔鑫,等.当归-川芎药对不同制法与配对抗氧化活性相互作用研究[J].中国中药杂志,2013,32(8):234-238.
[10]朱玲娜,唐丽琴.糖尿病肾病中氧化应激对炎症细胞因子的影响[J].安徽医药,2012,16(9):1226-1229.
[11]Lagouge M,Larsson NG.The role of mitochondrial DNA mutations and free radicals in disease and ageing[J].J Intern Med,2013,273(6):529-543.
[12]Ren C,Bao YR,Meng XS,et al.Comparison of the protective effects of ferulic acid and its drug-containing plasma on primary cultured neonatal rat cardiomyocytes with hypoxia/reoxygenation injury[J].Pharmacogn Mag,2013,9(35):202-209.
[13]黄波,陈畅.NO的功能及其作用机制[J].生物物理学报,2012,28(3):173-184.
