干扰素治疗慢性病毒性肝炎引起甲状腺功能异常的危险因素分析
2014-08-15牟建立
牟建立
0 引言
慢性病毒性肝炎是感染性疾病中常见多发的一种,主要为乙型肝炎和丙型肝炎,二者是造成肝细胞癌及肝硬化的主要原因[1]。目前,肝炎的治疗药物以干扰素(IFN)为主,其免疫调节和抗病毒效果较好,但不良反应也较为明显。研究表明,约有14%的患者因不良反应而中断治疗,40%用药需减量[2]。甲状腺功能异常是因IFN治疗而出现的各类不良反应中最为常见的一种。本研究旨在探讨慢性病毒性肝炎患者接受IFN治疗后甲状腺功能异常的临床特征,并结合病毒及生化指标对其危险因素进行分析。
1 资料与方法
1.1 临床资料 选择2010年5月至2012年4月在我院治疗的385例慢性乙型、丙型肝炎患者为研究对象,平均年龄(38.9±13.6)岁,男女比例为1.5∶1。患者慢性病毒性肝炎的临床诊断、抗病毒治疗相关适应证均与中华医学会感染病学分会、肝病学分会共同修订的《慢性乙型肝炎防治指南》、《丙型肝炎防治指南》中的相关标准相符合[3-4]。本组患者接受IFN治疗前既往半年内均无免疫调节剂及抗病毒药物治疗史;均排除HCV、HBV、HIV重叠感染,遗传性肝病,自身免疫性肝病及甲状腺功能异常。入组的患者中,155例为慢性乙型肝炎,存在HBV明确感染家族史占51.5%,对其中86例患者实施HBV基因型检测,C基因型患者57例,占66.3%;230例患者为慢性丙型肝炎,有明确输血史患者占57.7%,接受HCV基因型检测者为161例,其中基因Ⅰ型占72.0%。
1.2 IFN治疗与临床生化指标的检测 患者应用派罗欣(聚乙二醇干扰素α-2α)皮下注射180 μg,隔日1次,治疗共48周。丙型肝炎患者同时接受利巴韦林抗病毒治疗。
分别在抗病毒治疗前2周及治疗过程中每4~12周对患者病毒载量、肝功能及血常规进行检测,同时对甲状腺自身抗体以及甲状腺功能指标进行观察。若患者临床甲功或甲状腺血清学功能指标异常应定期检测,每4周1次;甲状腺功能相关血清学指标为游离甲状腺素(FT4)、超敏促甲状腺素(sTSH)、游离三碘甲状腺原氨酸(FT3),其参考值正常范围:9.01~19.04 pmol/L、0.35~4.94 mU/L、0.62~6.49 pmol/L;甲状腺抗体包括抗球蛋白抗体(TGAb)及过氧化酶抗体(TPOAb),参考值范围:<4.11 U/mL、<5.61 U/mL、<5.0 U/L。甲状腺功能减退及亢进相关诊断标准由sTSH>4.94 mU/L或<0.35 mU/L来界定。参照干扰素诱导甲状腺炎相关分类标准并结合甲状腺抗体阳性与否,将甲状腺功能亢进深化区分为破坏性甲状腺炎及Graves病;减退类型则分为非自身免疫性功能减退及桥本甲状腺炎[5]。
1.3 统计学方法 采用SPSS 18.0统计学软件处理本组数据,组间率及均数比较分别采用χ2检验和t检验,通过Logistic回归分析获取独立危险因素,并对其比值比进行计算,P<0.05为差异有统计学意义。
2 结果
2.1 IFN致甲状腺功能的异常率及临床类型 本组患者接受IFN治疗后,甲状腺功能发生异常者共32例,占8.3%,包括甲状腺功能减退与亢进各16例,其中桥本甲状腺炎10例、破坏性甲状腺炎8例、Graves病8例及非自身免疫性甲状腺功能减退6例。临床症状较为显著的甲状腺功能异常患者10例,6例Graves病患者伴有消瘦、焦虑及心悸等临床症状,无突眼、甲状腺肿大等表现;4例桥本甲状腺炎患者中,伴有性欲减退、畏寒、乏力、心动过缓、腹胀等临床表现。
2.2 IFN治疗受甲状腺功能异常症状的影响及病情转归 本组32例甲状腺功能异常患者中,接受内分泌治疗者9例,IFN停用者3例。6例Graves病患者给予抗甲状腺药物,停用IFN者2例;3例桥本甲状腺炎患者给予甲状腺素片治疗,其中停用IFN者1例。甲状腺功能出现异常患者发生时间最早在治疗第2个月,最迟则在结束治疗后7个月,中位异常时间为治疗过程中的第7个月;持续时间1~11个月不等,中位持续时间为4个月。治疗结束后,进行为期1年的随访,所有患者甲状腺功能均恢复至正常。
2.3 IFN致甲状腺功能异常的危险因素分析 慢性病毒性肝炎经IFN治疗后,其中353例患者甲状腺功能处于正常水平(91.7%);32例甲状腺功能发生异常(8.3%)。甲状腺功能正常组基线及治疗12、36及48周后,甲状腺抗体阳性率显著低于异常组(P<0.05)。见表1。甲状腺功能正常组基线TGAb及TPOAb水平显著低于异常组(P<0.05)。见表2。
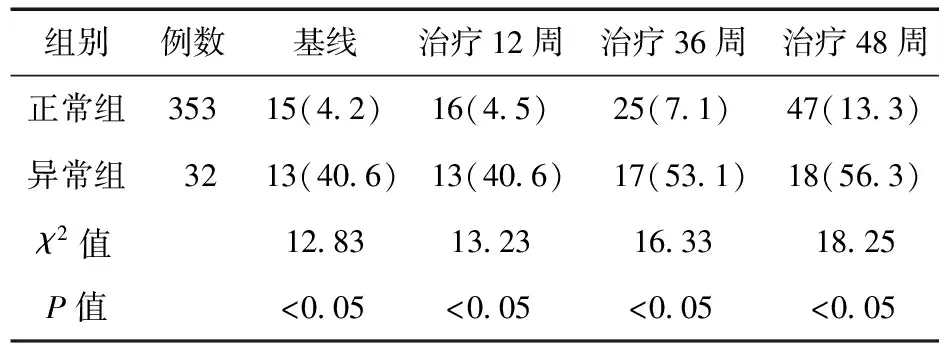
表1 干扰素治疗中肝炎患者甲状腺自身抗体阳性率改变(例,%)
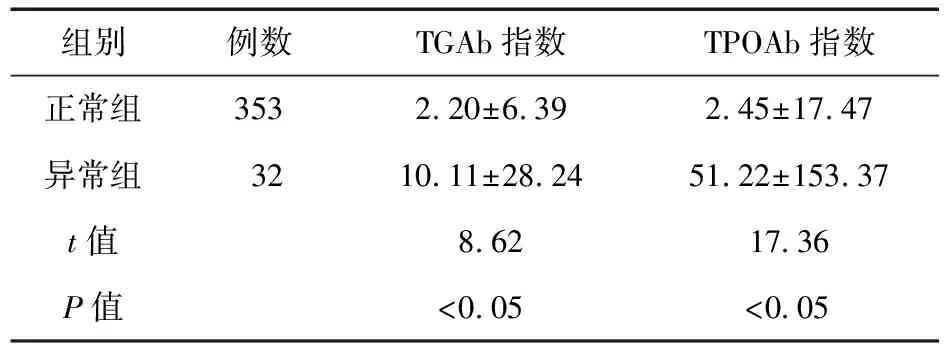
表2 两组基线TGAb、TPOAb水平的变化情况(U/mL)
利用甲状腺功能正常及异常患者之间的年龄、性别、肝炎病毒分型、病毒基因分型、临床疗效、基线甲状腺自身抗体、甲状腺激素指标的比较,经Logistic回归分析发现,IFN治疗造成甲状腺功能发生异常的因素中,基线TPOAb (OR=2.742,95%CI[1.003,1.008])和性别(OR=3.656,95%CI[1.223,10.931])为慢性病毒性肝炎患者接受IFN治疗后,甲状腺功能发生异常的独立危险因素。
3 讨论
上世纪80年代,Fentiman等在应用IFN治疗乳腺癌患者的过程中,对于甲状腺类疾病与IFN之间的关系有一定认识[6]。此后不断出现相关报道,患者接受IFN治疗后,甲状腺疾病发病率较高[7]。据前瞻性调查表明,在丙型肝炎患者中至少40%的病例在接受IFN治疗过程中出现甲状腺自身抗体,其中病情进展为甲状腺临床型疾病者约占15%[8]。同时,由于与IFN治疗中不良反应的常见症状相互重叠,与甲状腺功能异常的相关诊断因为各种原因被推迟,最终造成严重并发症。所以,应用IFN治疗时,应充分认识和掌握甲状腺功能异常的临床特征[9],并给予针对性处理措施,这对于慢性病毒性肝炎的临床治疗中高应答率的获得具有积极意义。
甲状腺炎分为非自身免疫性及自身免疫性两种[10],其发生机制可能为甲状腺组织直接受到IFN作用及继发性免疫介导影响。自身免疫性甲状腺炎多受到自身抗体升高影响,以自身免疫性甲状腺功能减退或亢进为主要表现,这两种表现分别对应于桥本甲状腺炎及Graves病,或甲状腺仅仅生成自身抗体(Tab阳性)而临床则无任何症状[11-12]。在甲状腺自身免疫性的各种形式中,最常见的一种即为临床不伴有任何症状的甲状腺抗体性,IFN可导致预存甲状腺自身免疫性加重,或直接在IFN治疗阶段形成,从而显著提高甲状腺抗体水平。本研究发现,慢性病毒性肝炎患者经IFN治疗后,8.3%的患者甲状腺功能发生异常,且异常组甲状腺抗体阳性率TGAb及TPOAb水平更高。随着治疗时间的延长,甲状腺抗体阳性率也逐渐升高。此类患者大多处于甲状腺炎的临床前期,因而需要在各个阶段对患者甲状腺功能加以密切监测。此外,本研究发现,TPOAb水平及性别为IFN导致甲状腺功能异常的独立危险因素。王丽旻等[13]研究也表明,α-干扰素治疗慢性乙肝后,可并发甲状腺功能减低,并且桥本甲状腺炎为临床表现的TPOAb阳性为显著危险因素。本组3例患者有桥本甲状腺炎,虽然部分可代以甲状腺素进行治疗并可实现好转,继续接受IFN治疗,但仍有患者因症状过于严重而被迫中断治疗。
综上所述,在IFN影响下的慢性病毒性肝炎甲状腺异常主要包括破坏性甲状腺炎、Graves病、非自身免疫性甲状腺功能减退及桥本甲状腺炎,其中桥本甲状腺炎及Graves病的症状较为明显,患者可能需停止IFN治疗或接受内分泌治疗。慢性病毒性肝炎患者在行IFN治疗前后应对甲状腺自身抗体及功能指标予以严密监测,特别是预存TPOAb抗体以及女性患者。
参考文献:
[1] 钱静,刘勇钢.甲状腺与肝脏疾病关系的研究进展[J].世界华人消化杂志,2009,17(12):1167-1170.
[2] 胡欣,汤桂芳.干扰素治疗肝炎引起甲状腺功能异常临床分析[J].临床荟萃,2009,24(14):1270-1271.
[3] 中华医学会肝病学分会、感染病学分会.慢性乙型肝炎防治指南[J].中华肝脏病杂志,2005,13(12):881-891.
[4] 中华医学会肝病学分会,中华医学会传染病与寄生虫病学分会.丙型肝炎防治指南[J].中华医学杂志,2004,84(9):71-76.
[5] 李跃松,朱亚妮,殷政芳,等.血清甲状腺过氧化物酶抗体在自身免疫性甲状腺疾病诊断中的应用[J].检验医学,2012,27(3):195-198.
[6] 张爱民,陈铿,谭行华,等.聚乙二醇干扰素α-2a治疗慢性乙型肝炎引起甲状腺功能异常临床分析[J].中华实验和临床病毒学杂志,2012,26(3):218-220.
[7] 热西旦木·吾斯曼.两种方式治疗甲状腺疾病的疗效比较[J].中国社区医师(医学专业),2013,15(10):38.
[8] 桑艳红.干扰素-α所致甲状腺功能异常6例诊治分析[J].中国现代医生,2010,48(21):121-122.
[9] 尤丽,朱秀丽,刘赛,等.促甲状腺素在非肥胖多囊卵巢综合征患者中的临床应用[J].中国实用医药,2013,8(21):60-61.
[10]杜亚奇,刘东屏.29例自身免疫性肝炎合并其他自身免疫性疾病临床比较分析[J].中国医师进修杂志,2012,35(28):44-45.
[11]刘艳辉.干扰素治疗慢性肝炎对甲状腺功能影响的实验室分析[J].临床和实验医学杂志,2012,11(7):505-506.
[12]黄雁翔,陈新月,马丽娜,等.慢性丙型肝炎抗病毒治疗患者甲状腺功能异常及其影响因素[J].中华肝脏病杂志,2012,20(3):216-220.
[13]王丽旻,张鸿飞,董漪,等.α干扰素治疗慢性乙肝并发甲状腺功能减低母女二例报告[J].中华实验和临床病毒学杂志,2011,25(4):291.
