硫化氢联合亚低温对肢体缺血再灌注后大鼠心肌损伤的影响
2014-08-15常国江刘志成章以杰田苗苗宋晓丽
常国江,刘 涛*,刘志成,章以杰,林 俊,田苗苗,宋晓丽,王 彬
0 引言
肢体缺血再灌注在临床中较为常见,如断肢再植及骨科中长时间应用止血带等,随着肢体缺血时间的延长,除造成肢体自身的缺血再灌注损伤,还可通过血流转移到远隔组织器官如心脏,造成一种间接损伤[1],因此,如何减轻肢体缺血再灌注远隔器官的损伤,是临床急需解决的难题。内质网应激反应(ERS)是细胞对内外环境变化的一种适应性反应,有助于细胞和生命个体的存活;然而,应激过度可引起细胞凋亡,导致疾病。研究显示,内质网应激反应参与肢体缺血再灌注所致心肌损伤的病理过程[2]。亚低温是保护缺血器官最有效的方法之一[3-6]。研究显示,亚低温治疗可有效减少心搏骤停及心肺复苏对心肌的损伤,降低心肌耗氧量,改善心功能[7]。硫化氢(H2S)作为第三种气体信号分子,在心血管系统中的研究价值倍受关注。研究显示,H2S可明显减轻急性缺血所致的心肌损伤,改善心功能,起到心肌保护作用[8]。但H2S联合亚低温对肢体缺血再灌注大鼠心肌细胞内质网应激反应的影响尚无相关报道,本研究拟评价H2S联合亚低温对肢体缺血再灌注后大鼠心肌损伤的影响。
1 资料与方法
1.1 分组 健康雄性Wistar大鼠60只(青岛大学医学院实验动物中心提供),体重260~300 g,采用随机数字表法,将其随机分为5组(n=12):假手术组(S组)、肢体缺血再灌注组(IR组)、硫氢化钠组+IR组(H组)、亚低温组+IR组(M组)和硫氢化钠联合亚低温+IR组(HM组)。
1.2 方法 参照文献[9]提供的方法制备肢体缺血再灌注动物模型:以橡皮止血带绑扎双后肢根部造成肢体缺血3 h,之后松开止血带使肢体血流再灌注3 h,应用激光多普勒(PriFlux 5001型,Perimed)监测血流被阻断为缺血成功标志。S组动物给予同样的麻醉操作,只是用弹力橡皮带环绕大鼠双后肢,但不结扎。IR组动物使双后肢缺血3 h后再灌注3 h。H组和HM组动物于再灌注前10 min腹腔注射NaHS(28 μmol/kg),其余组注射等容量生理盐水,而M组和HM组于双下肢缺血后将大鼠置于冰袋上行体表降温,使直肠温于15 min内降至32~33 ℃,并维持3 h;其余组采用白炽灯维持直肠温36~37 ℃。再灌注3 h,腹腔注射2%戊巴比妥钠50 mg/kg麻醉下,开胸分离并切左心室心肌组织,PBS清洗,以40 g/L多聚甲醛固定,石蜡包埋。
取固定的心肌组织,石蜡包埋切片,HE染色,光镜下观察心肌组织形态学变化情况。
TUNEL细胞凋亡按试剂盒说明书用TUNEL原位法测定凋亡指数。细胞核呈棕褐色或棕黄色颗粒且具备凋亡细胞形态学特征判定为凋亡细胞。Image.Pro Plus v 5.1图像分析软件自动选取最有意义的5个视野,每个视野计算阳性细胞所占全部细胞的百分数,最后计算均值,获得凋亡细胞的百分率,用凋亡指数表示。凋亡指数(%)=(凋亡细胞核计数/总细胞核计数)×100%。
Western blot法测定葡萄糖调节蛋白(GRP78)和半胱氨酸蛋白水解酶(Caspase-12)蛋白表达,取-80 ℃冻存心肌标本加入裂解液中,剪碎后移入1.5 mL EP 管中,4 ℃ 12 000 r/min离心25 min,取上清液进行蛋白定量。SDS-PAGE电泳,浓缩胶电压80 V,分离胶电压120 V,半干法将蛋白质转移到PVDF膜上,恒压电泳95 V,室温1 h,4 ℃孵育过夜,按0.1 mL/cm2膜面积加入1∶500一抗,杂交2 h,封闭液漂洗后按0.1 mL/cm2膜面积加入1∶500二抗,摇床杂交2 h,漂洗后加显色剂,避光显色2~5 min,条带出现,终止反应。以β-actin作为内参,进行比较。采用吸光度扫描分析软件Quantity one(Bio Rad公司,美国)测定每条带的吸光度值。将相对吸光度值作为统计学分析的原始数据,去除蛋白不均衡降解造成的误差。
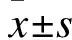
2 结果
2.1 光镜下心肌组织形态学变化 光镜下S组心肌纤维排列整齐,细胞核均匀一致,纹理清晰;IR组心肌细胞肿胀、变性,细胞质红染,细胞核减少,可见坏死纤维断裂,纤维间隙增宽,周围炎性细胞浸润和红细胞渗出;H组和M组心肌纤维排列较整齐,间隙减小,细胞轻度肿胀;HM组心肌纤维排列基本恢复正常,细胞边界清晰,排列规则,稍显疏松。见图1。
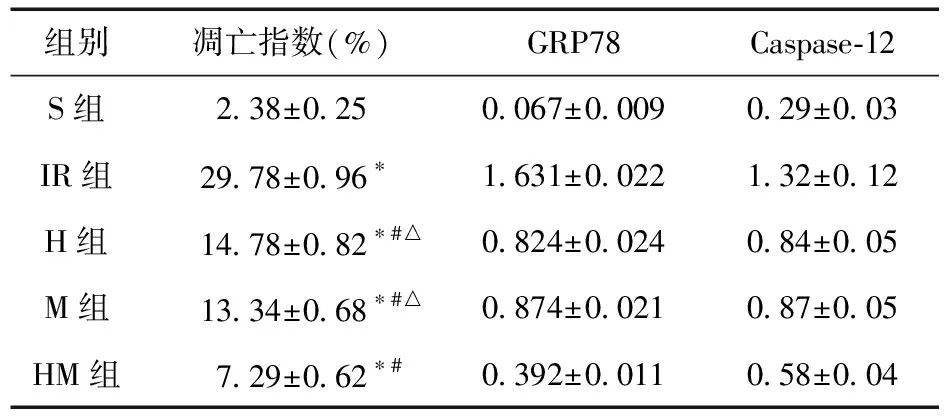
2.2 大鼠心肌组织凋亡指数GRP78和Caspase-12蛋白表达比较 与S组比较,IR组、H组、M组和HM组心肌细胞凋亡指数升高,GRP78和Caspase-12蛋白表达上调(P<0.05);与IR组比较,H组、M组和HM组心肌细胞凋亡指数降低,GRP78和Caspase-12蛋白表达下调(P<0.05);与NaHS组和M组比较,HM组心肌细胞凋亡指数降低,GRP78和Caspase-12蛋白表达下调(P<0.05);NaHS组和M组的心肌细胞凋亡指数、GRP78和Caspase-12蛋白表达比较差异无统计学意义(P>0.05),见表l。

图1 肢体缺血再灌注后大鼠心肌组织形态学变化的光镜观察(HE,×200)
表1各组大鼠心肌组织凋亡指数、GRP78和Caspase-12的蛋白表达比较(n=12)
注:*与S组比较,P<0.05;#与IR组比较,P<0.05;△与HM组比较,P<0.05
3 讨论
本研究参照文献[9]采用橡皮带环绕结扎大鼠双后肢3 h,再灌注3 h的方法建立大鼠肢体缺血再灌注模型。光镜下IR组心肌细胞肿胀、变性,细胞质红染,细胞核减少,可见坏死纤维断裂,纤维间隙增宽,周围炎性细胞浸润和红细胞渗出,提示肢体缺血再灌注诱发心肌损伤模型制备成功。
本研究参照文献[10]选择腹腔注射NaHS(28 μmol/kg)。参照文献[11]采用体表降温的方法使大鼠直肠温于再灌注开始15 min内降至32~33 ℃,并维持3 h。本研究结果表明,H2S联合亚低温可减轻肢体缺血再灌注大鼠心肌细胞损伤,且保护作用强于两者单独应用。
GRP78是内质网分子伴侣,对内质网内环境极度敏感,很多能引起内质网应激变化的因素都能直接或间接引起GRP78表达的改变,如高血糖、高血压、氧化应激、炎症等因素都可引发其蛋白大量释放[12]。Caspase-12仅存在于内质网膜上,是以酶原的形式位于内质网的细胞质面,适度的内质网应激,有利于细胞内钙和蛋白质加工等稳态恢复正常,增强细胞耐受应激刺激的能力;持续而严重的内质网应激,触发内质网相关性细胞凋亡,造成细胞损伤,因此,Caspase-12是内质网应激所致凋亡途径中的关键凋亡蛋白[13-14]。本研究选用GRP78和Caspase-12作为反映内质网应激反应的指标,结果表明,H2S联合亚低温可通过下调心肌细胞GRP78和Caspase-12蛋白表达,降低心肌细胞凋亡指数,减轻大鼠肢体缺血再灌注心肌损伤。亚低温下调心肌细胞GRP78和Caspase-12蛋白表达的机制可能是:肢体缺血再灌注时,ATP合成减少致使离子转运功能障碍、大量自由基的产生及Ca2+稳态破坏等均可导致新合成的蛋白质蛋白组装折叠抑制[15],启动内质网应激反应。未折叠蛋白聚集于内质网腔内致使GRP78优先与内质网腔内未折叠蛋白结合,从而与跨膜蛋白PERK、IRE1和ATF6解离,激活下游的信号通路,即通过激活生长停止和DNA损伤诱导基因153和Caspase-12等引起细胞凋亡[16]。GRP78表达水平上调可抑制与PERK、IRE1和ATF6的解离,从而抑制以上3个通路的信号转导,从而减少细胞凋亡[17]。H2S减轻肢体缺血再灌注后大鼠心肌损伤,可能与以下几个方面有关:①通过兴奋KATP通道[18]。H2S是目前所知的唯一的内源性气体性的平滑肌KATP通道开放剂,可使K+外流增加,心肌细胞膜超极化,缩短动作电位时程,从而影响电压门控式Ca2+通道,使其活性减低,故Ca2+内流减少,细胞内Ca2+超载降低,减轻缺血缺氧时心肌细胞的损伤[19]。②H2S也可以直接抑制血管平滑肌上的电压门控式Ca2+通道,降低细胞内Ca2+超载。③通过激活蛋白激酶C及丝裂素活化蛋白酶系统而发挥抗炎症抗氧化应激的保护作用[20]。是否还有其他机制有待进一步研究。
综上所述,H2S联合亚低温可减轻肢体缺血再灌注后大鼠心肌损伤,其机制与下调心肌细胞GRP78和Caspase-12蛋白表达、减轻内质网应激反应有关。
参考文献:
[1] 潘伟,贾俊海.缺血预处理对糖尿病大鼠心肌缺血再灌注损伤的影响[J].中国全科医学,2009,12(4):649.
[2] 张改改,唐朝枢.内质网应激反应在心血管疾病中的作用[J].心血管病学展,2010,31(6):861-863.
[3] 刘洁,刘安雷,刘业成,等.亚低温对复苏后大鼠脑细胞凋亡相关因子的影响[J].协和医学杂志,2013,4(3):269-274.
[4] 苗海锋,石铸,吴志强,等.局部亚低温治疗对蛛网膜下腔出血患者血流动力学参数及内皮素-1、降钙素基因相关肽的影响[J].中国医师杂志,2013,15(7):878-881.
[5] 熊向东.头颅亚低温联合奥扎格雷和血塞通治疗急性脑梗死疗效观察[J].中国医药,2012,7(2):146-147.
[6] 姚爱敏,杜宝琴,郝亚平,等.亚低温治疗缺氧缺血I生脑病新生儿血清神经元特异性烯醇化酶及行为神经评分的变化及意义[J].中国小儿急救医学,2013,20(3):308-310.
[7] 陈玮.亚低温治疗对心搏骤停复苏后心肌酶cTnI、CK、CK-MB及心功能的影响[J].中国实用医药,2013,8(1):7-9.
[8] 刘芳,张建新,李兰芳,等.硫化氢对大鼠急性心肌缺血损伤后心功能的影响[J].中国药理学通报,2010,26(10):1334-1338.
[9] 赵立军,门秀丽,董淑云,等.骨骼肌缺血预适应对肢体缺血再灌注后心肌的远端保护作用[J].中国医科大学学报,2008,37(2):168-170.
[10]任青爱,谢晓华,张海峰.硫化氢对截肢创伤后心肌线粒体功能的保护作用[J].心脏杂志,2009,21(3):340-342.
[11]Zhao H,Steinberg GK,Sapolsky RM.General versus specific actions of mild-moderate hypothermia in attenuating cerebral ischemic damage[J].J Cereb Blood Flow Metab,2007,27(12):1879-1894.
[12]王国贤,李瑞芳,商淑慧,等.α-硫辛酸对糖尿病大鼠内质网应激相关分子GRP78和Caspase-12表达的影响[J].解放军医学院学报,2013,34(1):82-85.
[13]Li Y,Lv Z,Liu X,et al.Hypoxic postconditioning inhibits endoplasmic reticulum stress-mediated cardiomyocyte apoptosis by targeting PUMA[J].Shock,2013,39(3):299-303.
[14]Minamino T,Kitakaze M.ER stress in cardiovascular disease[J].J Mol Cell Cardiol,2010,48(6):1105-1110.
[15]周树保,屠伟峰.肢体缺血再灌注继发心肌损伤机制的研究现状[J].实用医学杂志,2009,25(5):810-811.
[16]Kerbiriou M,LeDrévo MA,Férec C,et al.Coupling cystic fibrosis to endoplasmic reticulum stress:Differential role of Grp78 and ATF6[J].Biochim Biophys Acta,2007,1772(11-12):1236-1249.
[17]蔡文杰,琚立华,朱依纯.硫化氢的治疗性应用研究进展[J].中国药理学通报,2009,25(7):854-856.
[18]王文玉.硫化氢对大鼠心脏缺血/再灌注损伤的保护作用以及心肌细胞Bax和Bcl-2表达的影响[J].免疫学杂志,2010,26(10):923-924.
[19]汪晓筠,樊海宁.硫化氢对铁超载下大鼠肝星状细胞氧化应激损伤的保护作用[J].实用医学杂志,2012,28(12):1960-1963.
[20]王洪瑾,李毅.硫化氢与氧化应激[J].医学研究生学报,2011,24(4):433-436.
