羟丁酸钠对离体大鼠缺血再灌注损伤心肌的影响
2014-08-15于冬梅曹惠鹃张铁铮
于冬梅,张 倩,周 锦,曹惠鹃,张铁铮*
0 引言
缺血/再灌注(Ischemia reperfusion,IR)常可诱发心律失常、心肌抑制、心肌梗死和血管功能障碍。由自由基引发的脂质过氧化反应是其重要的发生机制。8-异前列腺素能准确地评估氧化应激状态,是可靠的脂质过氧化标志物[1-2]。羟丁酸钠是一种非巴比妥类静脉麻醉药,因其对呼吸系统抑制小,且对心血管系统有轻度的兴奋作用,所以可用于危重患者和心血管手术的麻醉,但是这类患者是发生围术期心肌缺血的高危人群。有研究表明,羟丁酸钠能抑制氧化应激反应[3-5],减轻脑缺血再灌注损伤[6-8],但是对于心肌缺血再灌注损伤的研究较少,因此,本研究拟通过观察羟丁酸钠对大鼠离体心肌缺血再灌注心肌8-异前列腺素的影响,评价其对脂质过氧化的作用。
1 材料与方法
1.1 实验动物及分组 24只成年Wistar大鼠(沈阳军区总医院动物实验中心提供),雌雄均有,体重240~300 g,随机分为心肌缺血再灌注(IR)组、1 mmol/L羟丁酸钠(RL)组、2.5 mmol/L羟丁酸钠(RM)组和10 mmol/L羟丁酸钠(RH)组,每组6只。
1.2 模型制备及分组处理 用10%水合氯醛(0.35 mL/100 g)、肝素1 000 U/kg腹腔注射,将大鼠麻醉和抗凝后,在无菌条件下摘取心脏,于0~4 ℃ Kerbs-H (K-H)液内迅速进行主动脉插管并连接Langendorff逆灌装置(2 min内)。K-H液(mmol/L)成分:NaCl 118、KCl 4.7、CaCl22.5、KH2PO41.2、MgSO41.2、NaHCO325、葡萄糖 11。以95%O2和5%CO2饱和的K-H液行恒温[(37±0.2) ℃]、恒压(90 cm H2O)灌注10 min,四组应用K-H液,含1 mmol/L、2.5 mmol/L和10 mmol/L羟丁酸钠的K-H液分别灌注10 min,然后夹闭主动脉,全心停止灌注25 min,再灌注30 min。
1.3 标本采集和测定 用全自动免疫分析仪检测冠脉流出液的乳酸脱氢酶(Lactate dehydrogenase,LDH)活性;灌注末取心尖部心肌组织,按照1∶9的比例加入生理盐水制成10%心肌组织匀浆。按照试剂盒说明书采用ELISA法检测心肌组织8-异前列腺素含量;黄嘌呤氧化酶法测定心肌组织超氧化物歧化酶(Superoxide dismutase,SOD)含量;2.5%戊二醛固定左心室心肌组织,生理盐水冲洗后,硝酸兰固定,磷酸盐缓冲液漂染,饿酸固定,逐级脱水、浸透、包埋、切片,并经枸橼酸铅、醋酸铀双染,透射电镜下观察心肌组织超微形态学改变。
2 结果
2.1 大鼠冠脉流出液LDH、心肌组织8-异前列腺素和SOD的变化 与IR组比较,RL组8-异前列腺素、LDH和SOD差异均无统计学意义(P>0.05);RM组8-异前列腺素和SOD差异亦无统计学意义(P>0.05),LDH含量明显降低(P<0.05);RH组8-异前列腺素及LDH明显升高(P<0.05),SOD差异无统计学意义(P>0.05)。见表1。
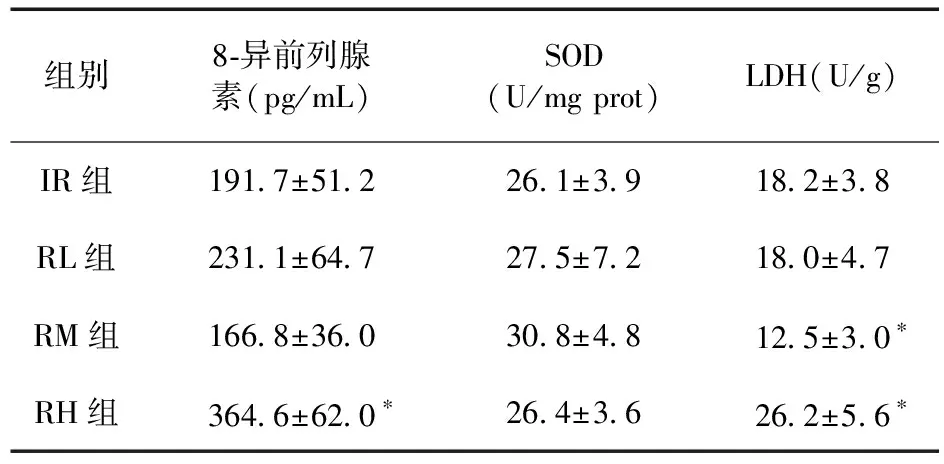
表1 各组大鼠8-异前列腺素、SOD及LDH含量变化(n=6)
2.2 心肌超微结构变化 IR组和RL组部分肌丝溶解,线粒体嵴减少,细胞水肿,外膜破损;RM组心肌纤维排列不够规则,肌丝部分间隙增宽,部分线粒体嵴减少;RH组心肌纤维排列紊乱,肌丝溶解,细胞核形不规则,线粒体嵴减少,外膜破损及空泡样变。见图1。


图1 心肌组织电镜观察结果(×4 000)
3 讨论
羟丁酸钠具有毒性低、对呼吸和循环影响小的优点,可用于麻醉的诱导和维持。由于羟丁酸钠的作用时间较长,近年来在麻醉方面的应用有所减少,但是其在心血管麻醉的应用价值不可忽视。羟丁酸钠能维持冠状动脉疾病患者稳定的血流动力学,即使是左室功能损害严重的冠脉搭桥患者,以羟丁酸钠麻醉诱导,平均动脉压的下降也只<10%,而且不影响心率和心室充盈压。羟丁酸钠复合芬太尼用于冠脉搭桥手术,不仅能提供充分的镇静和遗忘作用,还能增强芬太尼的镇痛效应,有利于维持心肌的氧供需平衡,避免加重心肌缺血[9],因此,冠脉搭桥患者应用羟丁酸钠麻醉是有益的。由于羟丁酸钠能自由通过血脑屏障,在化学结构上与中枢神经递质γ-氨基丁酸(GABA)相似,所以能产生拟GABA样的作用,调节多巴胺、去甲肾上腺素、阿片样物质等神经递质的释放,通过兴奋中枢交感通路,升高平均动脉压和心率[10]。由于羟丁酸钠的血药浓度在0.5~1.5 mmol/L呈浅睡眠,1.5~2.5 mmol/L呈中等睡眠,>2.5 mmol/L呈深睡眠,本研究选择了1、2.5、10 mmol/L用以模拟亚临床浓度、临床浓度和超临床浓度。
氧化应激是体内氧化和抗氧化失衡的一种状态,能激活炎症反应通路和损伤内皮细胞,与心血管疾病过程密切相关[11-12]。有研究表明,自由基和非自由基活性产物是导致心肌缺血再灌注损伤的重要介质[13]。虽然自由基在调节细胞生长、粘附、分化、凋亡等方面起重要的作用,但是当大量生成而超过抗氧化系统的清除能力时,自由基可以与脂质、蛋白质、核酸、碳氢化合物等大分子物质发生过氧化反应,尤其是细胞膜的多聚不饱和脂肪酸,一旦触发即引起一系列的链式反应,从而导致细胞和器官损伤[14]。8-异前列腺素主要是自由基催化花生四烯酸生成的脂质过氧化产物。外界因素并不能影响只含有少量脂质标本的8-异前列腺素含量,且在37 ℃放置5 d其含量也未见改变,说明其化学性质非常稳定。8-异前列腺素不仅是氧化损伤的标志物,也是一种促进氧化损伤的介质,更能早期准确评估氧化应激状态[15]。SOD能催化超氧阴离子转化成氧气和过氧化氢,是抗氧化损伤的第一道防线。本研究结果显示,IR、RL和RM组8-异前列腺素和SOD含量差异均无统计学意义,提示低、中浓度的羟丁酸钠不能改善心肌缺血再灌注损伤引起的氧化应激反应。而RM组的冠脉流出液LDH含量较IR 组明显降低,心肌超微结构的损伤也有所减轻,说明RM组对缺血再灌注心肌有保护作用。众所周知,阿片受体在心肌保护方面发挥着重要的作用。羟丁酸钠能增加心肌强啡肽含量,激动阿片受体,从而模拟缺血预处理,产生心肌保护作用。并且能降低钙通道活性,抑制钙内流,因而抑制细胞内钙超载导致的心肌缺血再灌注损伤。另外,羟丁酸钠也是一种能量底物,能减少细胞代谢,降低组织氧需[5]。本研究中RH组8-异前列腺素、LDH明显高于IR组,心肌超微结构损伤加重,表明10 mmol/L羟丁酸钠促进了心肌的脂质过氧化反应,并加重了缺血再灌注损伤。
综上所述,临床相关浓度的羟丁酸钠能够减轻心肌缺血再灌注损伤,具有较好的心肌保护作用,但是其保护机制与抑制氧化应激反应、减少脂质过氧化物的生成无关。而高于临床浓度组则加重心肌缺血再灌注损伤,其机制还需进一步研究。
参考文献:
[1] Morrow JD.Quantification of isoprostanes as indices of oxidant stress and the risk of atherosclerosis in humans[J].Arterioscler,Thromb Vasc Biol,2005,25:279-286.
[2] Carnevale R,Iuliano L,Nocella C,et al.Relationship between platelet and urinary 8-Iso-PGF2α levels in subjects with different degrees of NOX2 regulation[J].J Am Heart Assoc,2013,2(3):e000198.
[3] Wendt G,Kemmel V,Patte-Mensah C,et al.Gamma-hydroxybutyrate,acting through an anti-apoptotic mechanism,protects native and amyloid-precursor-protein-transfected neuroblastoma cells against oxidative stress-induced death[J].Neuroscience,2014,263C:203-215.
[4] Mamelak M.Alzheimer′s disease,oxidative stress and gammahydroxybutyrate[J].Neurobiol Aging,2007,28(9):1340-1360.
[5] Mamelak M.Sporadic Alzheimer′s disease:the starving brain[J].J Alzheimers Dis,2012,31(3):459-474.
[6] 李梅,谷淑玲,秦伟,等.羟丁酸钠对大鼠脑缺血一再灌注后c-fos表达的影响[J].徐州医学院学报,2005,25(1):25-28.
[7] Sadasivan S,Maher TJ,Quang LS.Gamma-Hydroxybutyrate (GHB),gamma-butyrolactone (GBL),and 1,4-butanediol (1,4-BD) reduce the volume of cerebral infarction in rodent transient middle cerebral artery occlusion[J].Ann N Y Acad Sci,2006,1074:537-544.
[8] Gao B,Kilic E,Baumann CR,et al.Gamma-hydroxybutyrate accelerates functional recovery after focal cerebral ischemia[J].Cerebrovasc Dis,2008,26(4):413-419.
[9] 张铁铮,李林,卢玉平,等.羟丁酸钠复合麻醉用于冠状动脉旁路手术时血液动力学和氧代谢的变化[J].中华麻醉学杂志,2004,24(8):630-631.
[10]Hicks AR,Kapusta DR,Varner KJ.Mechanisms underlying the sympathomimetic cardiovascular responses elicited by γ-hydroxybutyrate[J].J Cardiovasc Pharmacol,2004,44:631-638.
[11]Elahi MM,Kong YX,Matata BM.Oxidative stress as a mediator of cardiovascular disease[J].Oxid Med Cell Longev,2009,2:259-269.
[12]Higashi Y,Noma K,Yoshizumi M,et al.Endothelial function and oxidative stress in cardiovascular diseases[J].Circ J,2009,73:411-418.
[13]Ji L,Fu F,Zhang L,et al.Insulin attenuates myocardial ischemia/reperfusion injury via reducing oxidative/nitrative stress[J].Am J Physiol Endocrinol Metab,2010,298:E871-E880.
[14]Ray PD,Huang BW,Tsuji Y.Review Reactive oxygen species (ROS) homeostasis and redox regulation in cellular signaling[J].Cell Signal,2012,24(5):981-990.
[15]Montuschi P,Barnes PJ,Roberts LJ,et al.Isoprostanes:markers and mediators of oxidative stress[J].FASEB J,2004,18:1791-1800.
