他克莫司胶囊微生物限度检查法验证的探讨
2014-08-15占景华石鹤坤钟渊福董智聪胡永狮
占景华,石鹤坤,钟渊福,董智聪,胡永狮*
0 引言
他克莫司(Tacrolimus,FK-506)最早由日本藤泽药品工业公司探索研究所于1984年自日本筑波山土壤中分离的筑波链霉菌(Streptomyces tsskibaensis)NO9993的发酵液中提取,是含氮23元环的大环内酯类强效免疫抑制剂[1]。目前,已广泛应用于肝脏、胰腺、肾脏、心脏和肺等实体器官移植后的抗排异治疗,其药理作用是有效抑制T细胞激活,与内源性细胞受体(FKBP12)结合形成一个亲免素immunophilins复合物,从而发挥药理作用[2]。
由于他克莫司是一种上市不久的新型免疫抑制剂,所以关于他克莫司胶囊的检测方法报道相对较少,为了保证他克莫司胶囊的微生物限度检测法的准确性和可靠性,减少患者健康潜在的危害,保证在生产、贮存、销售过程中的质量,现按照2010版《中国药典》二部附录微生物限度检查法有关规定[3],通过系列试验,考察了他克莫司胶囊的抑菌活性和微生物检查法,并建立适合于该制剂的微生物限度检查方法,为制剂的进一步开发提供依据。
1 试验材料
1.1 样品 他克莫司胶囊分别由杭州中美华东制药有限公司(批号:13401,样品1)、安斯泰来制药有限公司(批号:OD5606A,样品2)、浙江海正药业股份有限公司(批号:20130311,样品3)提供。
1.2 验证用菌种 枯草杆菌CMCC 63202-4a(第三代),金黄色葡萄球菌CMCC 26003-28(第三代),大肠埃希菌CMCC 44102-22(第三代),白色念珠菌CMCC(F)98001(第三代),黑曲霉CMCC(F)98003(第三代),均由中国药品生物制品检定所提供。
1.3 培养基 营养琼脂培养基、玫瑰红钠琼脂培养基、真菌琼脂培养基、改良马丁培养基、胆盐乳糖培养基、营养肉汤培养基、真菌培养基、溴化十六烷基三甲铵琼脂培养基和甘露醇氯化钠琼脂培养基均由中国药品生物制品检定所生产,按使用说明书配制。
1.4 设备 ES-315全自动灭菌锅(TOMY)、SW-CJ-1FD医用净化工作台(苏州康莱特净化工程有限公司)、ZW-2008集菌仪(温州维科生物实验设备有限公司)、KBF220一次性使用集菌过滤培养器(温州维科生物实验设备有限公司)、恒温培养箱(THERMO)。
2 方法
2.1 菌液制备 分别接种金黄色葡萄球菌、大肠埃希菌、枯草芽孢杆菌的新鲜培养物至营养肉汤培养基中,经30~35 ℃培养18~24 h后,分别取金黄色葡萄球菌、大肠埃希菌、枯草杆菌的肉汤培养物1 mL+9 mL 0.9%无菌氯化钠溶液,10倍稀释至106~107,细菌数约为50~100 cfu/mL,做活菌计数备用。
接种白色念珠菌的新鲜培养物至改良马丁培养基中,经23~28 ℃培养24~48 h后,取白色念珠菌液体培养物1 mL+9 mL 0.9%无菌氯化钠溶液,10倍稀释至104~107,菌数约为50~100 cfu/mL,做活菌计数备用。
接种黑曲霉的新鲜培养物至改良马丁琼脂斜面培养基中,经23~28 ℃培养5~7 d后,取黑曲霉斜面培养物,加3~5 mL 0.9%无菌氯化钠溶液将孢子洗脱,吸出孢子悬液1 mL +9 mL 0.9%无菌氯化钠溶液,10倍稀释至104,菌数约为50~100 cfu/mL,做活菌计数备用。
2.2 供试液制备 称取样品5 g,加0.5%吐温80蛋白胨水氯化钠缓冲液至45 mL,作为1∶10供试液。
2.3 回收率测定(平皿计数法)
2.3.1 常规法 试验组:取1∶10供试液1 mL、50~100个/mL试验菌液1 mL同时加入平皿中,立即倾注15~20 mL温度不超过45 ℃的培养基中,待凝固后,置培养基观察结果,同时平行3个平皿。供品对照:取1∶10供试液各1 mL分别加入至平皿中,立即倾注15~20 mL温度不超过45 ℃的培养基,待凝固后,置培养观察结果。稀释剂对照:取稀释液1 mL替代供试品,加入50~100个试验菌,按试验组的供试液制备方法和菌落计数方法测定其菌数。
2.3.2 0.2 mL/皿稀释法 取1∶10的供试液1 mL分注于5个平皿(即0.2 mL/皿)中,于每皿中分别加入1 mL含有50~100个的试验菌,立即倾注45 ℃相应的培养基,每株试验菌平行制备3个平皿,按平皿法测定其菌数。
2.3.3 薄膜过滤法 试验组:每管分别取已制成的1∶10供试液10 mL,全量过滤(蠕动泵转速160 r/min),用无菌pH 7.0氯化钠-蛋白胨缓冲液冲洗500 mL或1 L,等瓶底留冲洗液20 mL左右时,分别加入各试验菌液1 mL,混匀,过滤,取出滤膜,菌面朝上贴于营养琼脂培养基或玫瑰红钠琼脂培养基上,35 ℃培养48 h观察结果或25 ℃ 72 h观察结果。稀释剂对照组:取稀释剂各100 mL,分别加入上述试验菌,使菌浓度为50~100 cfu/mL,按试验组的方法进行菌落计数。供试品对照组:按试验组方法处理,但不加菌液。
2.3.4 计算方法 试验组的菌回收率(%)=[(试验组平均菌落数-供试品对照组平均菌落数)/菌液组平均菌落数]×100%
3 结果
3.1 他克莫司胶囊微生物检测回收率(常规法)(1∶10) 他克莫司胶囊3个样品常规平皿培养法微生物限度检查的验证结果见表1。从表1可以看出:采用常规方法检验他克莫司胶囊供试品,人工污染5株代表菌株,该供试品对金黄色葡萄球菌、枯草杆菌、大肠埃希菌、白色念珠菌、黑曲霉回收率试验均低于70%,有一定抑菌作用,不能采用常规方法检验。根据验证试验结果,确定他克莫司胶囊微生物限度检查法为细菌数和霉菌数测定均不能采用常规方法检验。

表1 他克莫司胶囊微生物检测回收率(常规法)(1∶10)
3.2 他克莫司胶囊微生物检测回收率(常规法)0.2 mL稀释法 他克莫司胶囊3个样品稀释法0.2 mL/皿微生物限度检查的验证结果见表2。从表2可以看出:采用稀释法0.2 mL/皿检验他克莫司胶囊供试品,人工污染5株代表菌株,该供试品对枯草杆菌的回收率高于70%;而对金黄色葡萄球菌、大肠埃希菌、白色念珠菌、黑曲霉回收率试验均低于70%,有一定抑菌作用,不能采用稀释法0.2 mL/皿检验。根据验证试验结果,确定他克莫司胶囊微生物限度检查法为细菌数和霉菌酵母菌数测定均不能采用稀释法0.2 mL/皿检验。

表2 他克莫司胶囊微生物检测回收率(常规法)0.2 mL稀释法
3.3 他克莫司胶囊微生物检测回收率(薄膜过滤法1∶10,冲洗500 mL) 他克莫司胶囊3个样品薄膜过滤法(1∶10)微生物限度检查的验证结果见表3。上述试验结果表明,他克莫司胶囊微生物限度检查菌落计数采用薄膜过滤法供试液1∶10,冲洗500 mL,除黑曲霉外,试验组的各试验菌回收率均在70%以上。

表3 他克莫司胶囊微生物检测回收率(薄膜过滤法1∶10,冲洗500 mL)
3.4 他克莫司胶囊微生物检测回收率(薄膜过滤法1∶100、1∶1 000,冲洗500 mL) 见表4、表5。表4结果显示,采用薄膜过滤法供试液1∶100;冲洗500 mL,供试品对黑曲霉回收率低于70%。表5结果显示,采用薄膜过滤法供试液1∶1 000;冲洗500 mL,供试品对黑曲霉回收率高于70%。
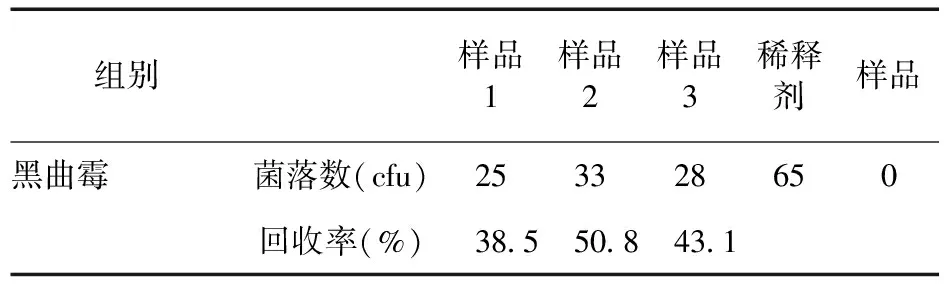
表4 他克莫司胶囊微生物检测回收率(薄膜过滤法1∶100,冲洗500 mL)
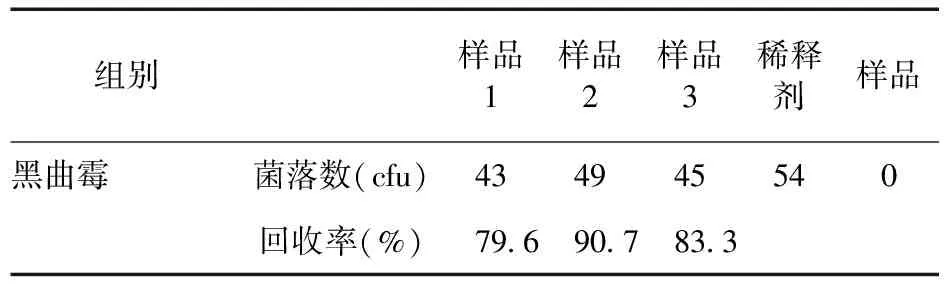
表5 他克莫司胶囊微生物检测回收率(薄膜过滤法1∶1 000,冲洗500 mL)
4 结论
微生物限度方法验证是确认供试品在所采用的检查方法和检验条件下无抑菌作用,以保证供试品污染的微生物能被充分检验出来[4]。药物具有抑菌成分的进行微生物限度检查时,要求供试品本身在试验的条件下有效排除其抑菌作用,使其在不干扰染菌的限度检验,结果方属有效[5]。
他克莫司胶囊按照2010年版《中国药典》微生物限度检查法验证方法验证,结果如下,细菌总数:取供试品5 g,加无菌0.5%吐温80的pH 7.0氯化钠-蛋白胨缓冲液至45 mL,振摇混匀,制成1∶10供试液;取供试液1 mL,全量过滤(蠕动泵转速160 r/min),用无菌pH 7.0氯化钠-蛋白胨缓冲液500 mL冲洗,取出滤膜菌面朝上贴于营养琼脂培养基,35 ℃培养48 h,计数菌落。霉菌和酵母菌:另取1∶10供试液1 mL,加入到100 mL的无菌pH 7.0氯化钠-蛋白胨缓冲液,取1 mL,全量过滤(蠕动泵转速160 r/min),用无菌pH 7.0氯化钠-蛋白胨缓冲液500 mL冲洗,取出滤膜菌面朝上贴于玫瑰红钠琼脂培养基,25 ℃培养72 h,计数菌落。
在菌落计数方法验证中,大肠埃希菌代表革兰阴性菌,金黄色葡萄球菌代表革兰阳性菌,枯草芽孢杆菌代表芽孢杆菌,白色链球菌代表酵母菌,黑曲霉代表霉菌,因此,该验证方法较能体现出检测方法的准确性,减少检测方法误差[6-7]。建议不同检测样品进行微生物限度检测都必须进行方法验证,避免采用单一常规法或膜过滤法进行微生物限度检测,使实验科学合理,提高工作效率,更加规范性。
参考文献:
[1] 徐亲民.他克莫司胶囊的工业化研究[J].国外医药:抗生素分册,2000,21(4):151-155.
[2] 周立明,张莉,赵晓娟,等.他克莫司自微乳的制备和质量评价[J].中国医院药学杂志,2012,32(24):1975-1979.
[3] 中华人民共和国药典委员会.中国药典[S].2010年版.北京:化学工业出版社,2010:附录107-115.
[4] 谢委,马永贵,张光勋,等.阿托伐他汀钙片微生物限度检查方法学验证[J].中国药师,2013,1(3):471-473.
[5] 黄依玲.医院制剂微生物限度检查方法的重新验证[J].中国现代药物应用,2013,7(9):3-4.
[6] 由亚宁,任安民,斐为芝.药品微生物验证枯草芽孢杆菌实验菌液制备方法的探讨[J].西北药学杂志,2007,22(6):345.
[7] 范兵,杜娟,陈林芳.黄藤片微生物检验方法验证中加菌方法的比较研究[J].儿科药学杂志,2007,13(1):37-38.
