肝转运体的生理变化对中草药研究的影响*
2014-08-15朱琼妮侯玮钰陆远富
刘 杰, 朱琼妮, 侯玮钰, 陆远富
(1. University of Kansas Medical Center, Kansas City KS 66160,USA;2. 遵义医学院药理学教研室暨教育部-贵州省共建基础药理重点实验室,贵州 遵义 563099)
中草药的药物相互作用在中国传统中药的研究过程中越来越重要[1-3],当中草药药物提取物与处方药或者非处方药物合用时药物间的相互作用更加明显[2]。中草药与其它药物的合用可能会影响药物的药物代谢动力学与药物效应学,从而增加/减弱它们的效果或者毒性作用[1,4-6]。其中,药动学在中草药与药物的相互作用中占主要地位。药动学包括吸收、分布、代谢及排泄,药物代谢的主要器官在肝脏,而肝转运体介导药物的出胞和入胞,在药物相互作用中起重要作用。
1 吴茱次碱对肝脏药物代谢酶和转运体的影响
1.1 药物代谢酶和转运体 药物代谢主要发生在肝脏[7],主要分为两个步骤:①I相代谢反应,约90%以上的药物在这相反应中被氧化、还原或水解。催化I相反应的酶主要为肝微粒体中的细胞色素P450 (CYP450) 酶;②II相代谢反应,即结合反应,药物在这相反应中与一些内源性物质(如葡萄糖醛酸、谷胱甘肽、甘氨酸、硫酸等)结合或经甲基化、乙酰化后排出体外[8],II相酶在中草药与药物相互作用中同样发挥很重要的作用[8]。药物转运体又称III相,主要分为两类:一类为转运底物进入细胞的有机阳离子转运体(organic cation transporter, OCT)、有机阴离子多肽转运体(organic anion-transporting polypeptide OATP)等;另一类为ATP依赖释放能量的ABC结合式转运体(ATP binding cassette transporter, ABC transporter),包括多药耐药蛋白(multidrug resistance protein, MRP),乳腺癌耐药蛋白(breast cancer resistance protein BCRP)等[9]。药物转运体近年来被认为是中草药合用其它药物相互作用的基础之一[10]。 中草药与其他药物的合用可导致药物转运蛋白的诱导或抑制,从而影响自身和合用药物的效应[11]。药物转运体对药物的影响与药物疗效、药物相互作用、药物不良反应及药物解毒等密切相关[12],然而目前对转运体介导的中草药与药物相互作用的研究却较少。
1.2 吴茱萸次碱对药物代谢酶和转运体的影响 转运体介导药物的体内的吸收、分布、代谢和排泄,从而进一步影响药物的体内过程[10],这是中草药与药物相互作用的一个重要基础[5,13],如吴茱萸次碱合并用药时,可加速咖啡因[14],长效茶碱[15],扑热息痛[16]和黄连总生物碱[17]的排泄。转运体对其是否产生影响却不明确,故我们研究了中药吴茱萸的提取物吴茱萸次碱对小鼠肝脏药物代谢I,II,III相的影响,结果发现吴茱萸次碱不仅诱导I相代谢酶系P450和相关II相代谢酶,同时III相转运体也是吴茱萸次碱的重要靶点[18], 研究发现吴茱萸次碱明显的诱导有机阴离子转运多肽家族(Oatp1a1, Oatp1a4, Oatp1b2 和 Oatp2b1)的表达,从而增加药物的肝细胞摄入和代谢,进而促进经肝脏代谢并结合的药物通过胆汁或肾排出体外。吴茱萸次碱也能诱导外排转运体多药耐药相关蛋白(Mrp1,Mrp2,Mrp3,Mrp4)的表达。以Mrp2为例,它是多药耐药蛋白相关家族的一员,主要负责与葡萄糖醛酸或谷胱甘肽结合的内源性及外源性物质的外排[10,19],是中草药与药物相互作用机制中的重要一员。吴茱萸次碱能诱导Mrp2的表达,提示吴茱萸次碱可促进经葡萄糖醛酸和谷胱甘肽结合的产物经胆汁排泄,进而影响中草药与药物的相互作用。肝脏I、II、III 相药物代谢系统,并以吴茱萸次碱为例,显示药物的作用部位及产生的相应作用(见图1)。

图1 吴茱萸次碱对肝脏I相、II相和III相药物代谢的影响示意图
2 年龄和性别对肝脏药物转运体表达的影响
2.1 生理病理状态对肝脏转运体的影响 药物转运体是一类定位于细胞膜上的跨膜转运蛋白,广泛的分布在小肠,肝,肾,脑等器官。药物吸收入血后经肝细胞的血管侧膜摄取进入肝细胞,经过代谢反应后通过胆管侧膜排入胆汁,血管侧膜和胆管侧膜存在很多药物转运体,包括介导摄入或排出肝脏的转运体以及介导排出肝脏的转运体[10]。研究发现肝脏生理病理条件下,尤其是在胆汁淤积和炎症反应过程中药物转运体的改变非常明显[20],且转运体的改变很可能与其mRNA转录时相关核转录因子受到抑制或诱导有关[10,21]。
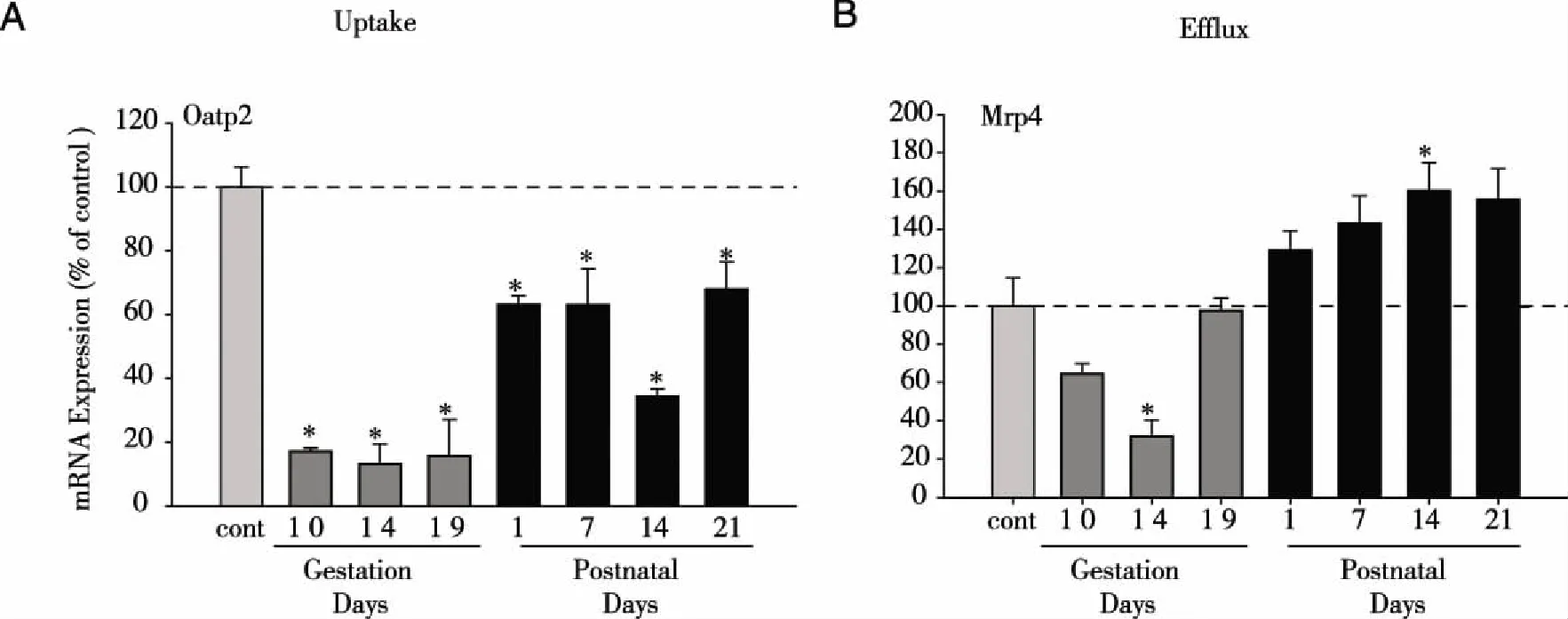
2.2 年龄和性别对摄入转运体Oatp2表达的影响 在给药过程中,不同年龄阶段,不同性别以及时间对体内药物浓度均有较大的影响。有研究表明在正常小鼠不同年龄阶段转运体的表达各不一样[23]。有机阴离子转运多肽对多种内、外源性物质在生物体内的摄取、清除具有重要作用[24],如正常大鼠大脑和肝脏药物摄入的有机阴离子转运多肽Oatp2的表达与年龄因素相关,大鼠脑内Oatp2表达随发育年龄增加表达呈下降趋势,而肝内Oatp2的表达则随发育年龄的增长加而增加[25]。我们最近的研究表明(见图2),在SD大鼠出生2 d到60 d的8个时间点内,肝脏Oatp2的表达随发育年龄的增长而增加,这也符合肝功能随年龄增长不断成熟的生理特点。新生儿期肝内Oatp2的低表达是为降低肝内毒性物质堆积所造成的肝脏损害,另外雄性动物Oatp2的表达明显比雌性动物高,然而在雄性的老龄SD大鼠动物中(180 d,540 d),Oatp2呈下降的趋势这也与老龄动物肝脏各项生理功能下降的趋势相符合。

注:A:表示与雌性大鼠比较*P<0.05;B:表示与60 d比较*P<0.05。 图2 不同年龄阶段SD大鼠有机阴离子转运多肽2(Oatp2)和多药耐药蛋白4(Mrp4)的mRNA表达的变化
2.3 年龄和性别对外排转运体Mrp4表达的影响 Mrp4为ATP能量依赖性跨膜蛋白,分布在基底膜的外侧,其在在睾丸、卵巢内表达最高[10,26],主要调节各种抑制细胞生长药物、抗病毒药物、抗生素及心血管药物在体内的再分布和肾脏的排泄,在细胞信号传导和保护细胞中起关键作用[27]。Mrp4在雄性大鼠生长发育过程中随着时间的增加而增加(见图2),尤其与出生前2 d(-2 d)比较,出生后21 d到60 dMrp4增加了10~40倍,在第35天达到最高值,是出生前2 d(-2)d的40倍。雌性大鼠肝脏Mrp4表达则相对较低,且其变化相对较小。老龄雄鼠(540 d)肝脏Mrp4的表达显著降低至60 d鼠龄的35.7%,表明幼鼠与老龄大鼠体内Mrp4的表达相对成年鼠的表达要低很多。
以上结果提示临床在幼年和老年,转运体的表达变化也可能导致药物在肝脏内蓄积而不能有效排除体外,进而导致药物毒性增加。因此,药物转运体的生理改变可影响药物相互作用并与机体疾病有密切的关联[22]。
3 妊娠和哺乳动物肝脏转运体的表达
3.1 妊娠肝内胆汁淤积与肝脏转运体 妊娠和哺乳期的胎鼠及幼鼠对营养的需求及其他生理变化显著[28-29],在此期间胆酸和胆固醇也有适应性的变化[29-31],这些生理变化也会影响肝脏药物代谢I,II,II相的相关基因的表达[32-33]。妊娠肝内胆汁淤积(ICP)是一种发生在第三妊娠晚期的肝脏疾病[34],许多研究表明其与胆汁酸代谢异常有关。充分了解胆汁酸的合成,运输,和转运将帮助我们揭示ICP病理学。因此我们研究了妊娠和哺乳期SD大鼠肝脏转运体的表达情况。
3.2 孕期和哺乳期肝脏转运体的表达 Oatp2和Mrp4是分别介导胆汁酸的摄取和外排的转运体。在小鼠体内孕期和哺乳期胆汁酸转运体下调[32],我们研究发现大鼠体内也有同样的现象[35](见图3A、B)。Oatp2不仅是重要的胆汁酸摄入转运体[32],同时对药物和其他异体物质的摄取也发挥重要的作用[10](见图3A)。Mrp4是主要的胆汁酸外排转运体[32],其在大鼠孕期表达下降,在孕晚期有轻微的升高,但在哺乳期则表达升高,见图3B。孕期和哺乳期Oatp2和Mrp4的变化可能是机体对幼鼠和胎鼠的保护作用的一种适应性反应。
了解转运体在孕哺期的表达对ICP的防治有重要的意义[35],并对孕哺期的合理用药有重要的指导意义。
注:与空白对照组比较比较*P<0.05。 图3 孕期和哺乳期SD大鼠有机阴离子转运多肽2(Oatp2)和多药耐药蛋白4(Mrp4)的表达
4 时辰对肝脏转运体的影响
4.1 生物钟和药物代谢 临床药物给药时间不同可能导致药物效果的不同。昼夜节律是许多种生物行为和生理水平周期性波动的现象,而昼夜节律产生和维持的分子基础是时钟基因的节律性表达[36]。研究发现昼夜节律在生物学和药理学的研究中极为重要[37-38],我们的研究工作表明细胞色素P450的表达呈明显的昼夜节律性变化[37],并影响不同时间给予扑热息痛的毒性反应[35]。
4.2 生物钟和肝转运体 肝脏内的摄取和排除转运体随着年龄的变化有明显的差异,那么转运体是否也存在昼夜节律性变化?我们最近研究发现Mrp2在正常大鼠体内也存在明显的昼夜节律变化(见图4)。从06:00到18:00时,Mrp2的表达逐渐升高,其中雌鼠在18:00时升至峰值,是06:00时表达的6倍,然后Mrp2的表达在22:00时骤然下降到与06:00时相似的水平。且Mrp2昼夜的表达也具有雌雄差异性,雌鼠肝脏内的表达高于雄鼠。Mrp2是ABCC外排转运家族中的一员,与Mrp1有较高的同源性和功能特点,在大鼠肝脏中主要分布在肝细胞的胆管侧面,协同底物从肝细胞向外排泄[40-41],MRP2有较宽的内源性和外源性的底物谱,是人体内负责将胆酸盐和胆红素等成分排入胆汁的载体,具有保护肝细胞及避免因胆汁蓄积引起的肝毒性的作用,Mrp2的昼夜变化提示Mrp2介导转运的药物在不同的时间给药会发生相应的变化。
因此,1 d内不同时间给药可影响药物的相互作用,也是时辰药理的一个重要研究内容。
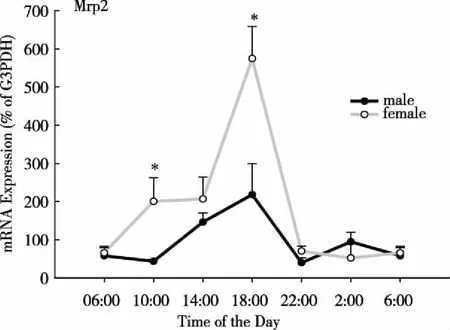
注:与雄性鼠比较*P<0.05。 图4 1 d内不同时间阶段多药耐药蛋白2(Mrp2)表达的变化
5 展望
肝脏转运体存在明显的年龄,时辰差异,并在孕期及哺乳期有明显的变化,提示在不同的发育阶段,老龄化对药物代谢有很大的影响。这对儿童、老年、孕妇等特殊人群的用药具有指导意义。以此为切入点,在临床药物“增效减毒研究”中具有重要意义。同时药物转运体是药物相互作用的重要基础,国内中草药的使用比较广泛,也常因中草药与其它药物或食物合用等发生相互作用,从而影响药效或药物的毒性作用。因此,在药物相互作用的研究中, 应该充分考虑肝脏转运体的年龄、性别、时辰等生理因素的影响。
[参考文献]
[1] Liu C X, Yi X L, Si D Y, et al. Herb-drug interactions involving drug metabolizing enzymes and transporters[J]. Curr Drug Metab, 2011, 12(9):835-849.
[2] Mukherjee P K, Ponnusankar S, Pandit S, et al. Botanicals as medicinal food and their effects on drug metabolizing enzymes[J]. Food Chem Toxicol, 2011, 49(12): 3142-3153.
[3] 李利生,刘娟,王安武, 等. 淫羊藿苷对大鼠肝药物代谢II相酶和药物转运体的影响[J].遵义医学院学报,2012, 35(1):13-16.
[4] Guengerich F P.Role of cytochrome P450 enzymes in drug-drug interac-tions[J]. Adv Pharmacol,1997,43:7- 35.
[5] Choi Y H,Chin Y W,Kim Y G.Herb-drug interactions: focus on metabolic enzymes and transporters[J].Arch Pharm Res,2011, 34(11):1843-1863.
[6] Xu S, Peng J, Li Y, et al.Pharmacokinetic comparisons of rutaecarpine and evodiamine after oral administration of Wu-Chu-Yu extracts with different purities to rats[J].J Ethnopharmacol,2012, 139(2): 395-400.
[7] 韩向辉, 马越鸣. 中药调控药物代谢酶和转运体活性及表达研究进展[J]. 中国中医药信息杂志, 2013, 20(1): 103-106.
[8] 严广利, 王喜军. 基于药物代谢酶和转运体蛋白的中药方剂配伍规律研究[J]. 世界科学技术中医药现代化,2008, 10(5): 25-29.
[9] 高利臣, 张伟, 范岚, 等. 炎症影响药物转运体表达及活性研究进展[J]. 中国药理学通报, 2011, 27(1): 7-10.
[10] Klaassen C D, Aleksunes L M. Xenobiotic, bile acid, and cholesterol transporters: function and regulation[J]. Pharmacol Rev,2010, 62(1): 1-96.
[11] König J,Müller F,Fromm M F.Transporters and drug-drug interactions: important determinants of drug disposition and effects[J].Pharmacol Rev,2013, 65(3): 944-966.
[12] 刘克辛. 转运体介导的药物相互作用与临床安全用药[J]. 大连医科大学学报,2012, 34(1) :1-8.
[13] Li L, Hu H, Xu S, et al. Roles of UDP-glucuronosyltransferases in phytochemical metabolism of herbal medicines and the associated herb-drug interactions[J]. Curr Drug Metab,2012, 13(5): 615-623.
[14] Noh K, Seo Y M, Lee S K,et al. Effects of rutaecarpine on the metabolism and urinary excretion of caffeine in rats[J]. Archives Pharmacal Research,2011,34(1):119-125.
[15] Lee S K, Bista S R, Jeong H, et al. The effects of rutaecarpine on the pharmacokinetics of acetaminophen in rats[J]. Archives Pharmacal Research,2007,30(12):1629-1634.
[16] Ueng Y F, Tsai T H, Don M J,et al.Alteration of the pharmacokinetics of theophylline by rutaecarpine, an alkaloid of the medicinal herb Evodia rutaecarpa, in rats[J]. Journal of Pharmacy and Pharmacology,2005,57(2):227-232.
[17] Ma B L, Yao M K, Han X H, et al. Influences of Fructus evodiae pretreatment on the pharmacokinetics of Rhizoma coptidis alkaloids[J]. European Journal of Physiology,2011,137(3):1395-1401.
[18] Zhu Q N, Zhang D, Jin T, et al. Rutaecarpine effects on expression of hepatic phase-1, phase-2 metabolism and transporter genes as a basis of herb-drug interactions[J]. J Ethnopharmacol,2013,147(1):215-219.
[19] Nies A T, Keppler D. The apical conjugate efflux pump ABCC2 (MRP2) [J].Pflugers Arch,2007,453(5): 643-659.
[20] Elferink M G, Olinga P, Draaisma A L, et al. LPS-induced downregulation of MRP2 and BSEP in human liver is due to a posttranscriptional process[J]. Am J Physiol Gastrointest Liver Physiol,2004, 287(5):1008-1116.
[21] 刘涛, 刘克辛. 药物转运体的变化对肝脏疾病的影响[J]. 中华临床医师杂志,2011, 5(10): 2982-2985.
[22] 孟强, 刘克辛. 转运体在肝脏中的作用[J]. 世界华人消化杂志, 2011,19(9): 881-886.
[23] Cui J Y, Gunewardena S S, Yoo B, et al. RNA-Seq reveals different mRNA abundance of transporters and their alternative transcript isoforms during liver development[J]. Toxicol Sci,2012, 127(2): 592-608.
[24] Kim R B.Organic anion-transporting polypeptide (OATP) transporter family and drug disposition[J]. Eur J Clin Invest,2003,33(Suppl 2):1-5.
[25] 郭艺, 蒋丽. 大鼠体内有机阴离子多肽2表达的年龄特征[J]. 第四军医大学学报,2009, 30(18):1700-1702.
[26] Ravna A W, Sager G. Molecular modeling studies of ABC transporters involved in multidrug resistance[J]. Mini Rev Med Chem,2009,9(2):186-193.
[27] Russel F G, Koenderink J B, Masereeuw R. Multidrug resistance protein 4 (MRP4/ABCC4): a versatile efflux transporter for drugs and signalling molecules[J]. Trends Pharmacol Sci,2008, 29(4): 200-207.
[28] Carlin A, Alfirevic Z. Physiological changes of pregnancy and monitoring[J]. Best Pract Res Clin Obstet Gynaecol,2008, 22(5): 801-823.
[29] Athippozhy A, Huang L, Wooton-Kee C R,et al. Differential gene expression in liver and small intestine from lactating rats compared to age-matched virgin controls detects increased mRNA of cholesterol biosynthetic genes[J]. BMC Genomics,2011,3:12:95.doi:10.1186/1471- 2164-12-95.
[30] Wooton-Kee C R,Cohen D E,Vore M.Increased cholesterol 7alpha-hydroxylase expression and size of the bile acid pool in the lactating rat[J]. Am J Physiol Gastrointest Liver Physiol,2008,294(4):G1009-16.
[31] Abu-Hayyeh S, Martinez-Becerra P, Sheikh Abdul Kadir S H, et al.Inhibition of Na+-taurocholate Co-transporting polypeptide-mediated bile acid transport by cholestatic sulfated progesterone metabolites[J]. J Biol Chem,2010, 285(22): 16504-16512.
[32] Aleksunes L M, Yeager R L, Wen X,et al. Repression of hepatobiliary transporters and differential regulation of classic and alternative bile acid pathways in mice during pregnancy[J]. Toxicol Sci,2012,130(2): 257-268.
[33] Shuster D L, Bammler T K, Beyer R P,et al. Gestational age-dependent changes in gene expression of metabolic enzymes and transporters in pregnant mice[J]. Drug Metab Dispos,2013,41(2): 332-342.
[34] Abu-Hayyeh S, Papacleovoulou G, Williamson C. Nuclear receptors, bile acids and cholesterol homeostasis series - bile acids and pregnancy[J]. Mol Cell Endocrinol,2013,368(1-2): 120- 128.
[35] Zhu Q N, Xie H M, Zhang D, et al. Hepatic bile acids and bile acid-related gene expression in pregnant and lactating rats[J].Peer J,2013, 1: e143.
[36] Liu S, Cai Y N, Xie S, et al. Exepression of clockgene in C57 mouse seperipheral tissues[J]. Basic clinmed,2007, 27(12): 1305-1308.
[37] Lu Y F, Jin T, Xu Y, et al. Sex differences in the circadian variation of cytochrome P450 genes and corresponding nuclear receptors in mouse liver[J]. Chronobiol Int,2013,30(9):1135-1143.
[38] 金涛, 张丹, 徐懿乔, 等. 昆明钟小鼠细胞色素氧化酶CYP1A基因表达的昼夜节律变化[J].中国药理学与毒理学杂志,2013, 27(3): 406-410.
[39] Xu Y Q, Zhang D, Jin T, et al. Diurnal variation of hepatic antioxidant gene expression in mice[J]. PLoS One,2012, 7(8): e44237.
[40] Keppler D. Multidrug resistance proteins (MRPs, ABCCs): importance for pathophysiology and drug therapy[J]. Handb Exp Pharmacol,2011,(201):299-323.
[41] 高纯颖, 陈笑艳, 钟大放.转运体在药物经肝脏清除过程中的作用[J]. 药学学报,2012, 47(5):565-572.
