淫羊藿苷通过降低MMP-9抗自发性高血压大鼠心室重构*
2014-08-15王颖婉李叶丽李意奇张丽梅徐尚福杨丹莉
王颖婉,李叶丽,李意奇,张丽梅,徐尚福,杨丹莉
(遵义医学院 药理学教研室暨贵州省基础药理重点实验室,贵州 遵义 563099)
心室重构可见心肌细胞肥大、凋亡、心肌细胞外基质(ECM)堆积,胶原量增加,胶原网受到破坏,心肌组织纤维化等,表现为心肌肥厚、心腔扩大、心脏的收缩和舒张功能障碍。心室重构是导致心力衰竭的关键因素,是心脏疾病走向终末期的一个必然阶段[1]。因此,防治心室重构已成为近年来研究的热点。由于ECM的降解依赖基质金属蛋白酶(MMPs),所以MMPs在心室重构的过程中发挥着重要的作用[2]。
淫羊藿具有“补肾阳,祛风湿,益气力,强心力”等功效。淫羊藿苷(Icariin,Ica)是淫羊藿的主要活性成分之一,具有降血压、抗肿瘤、增强免疫力、调节内分泌及抗骨质疏松等作用[3]。本研究拟观察淫羊藿苷是否具有抗自发性大鼠心室重构的作用,及该效应是否与MMP-9有关。
1 材料与方法
1.1 动物 14周龄雄性自发性高血压大鼠(SHR),14周龄同源正常的京都大鼠(WKY),SPF级,体重260~300 g,购于北京维通利华实验动物技术有限公司,许可证号SCXK(京)2012-0001。
1.2 试剂及仪器 淫羊藿苷(纯度 ≥ 98 %)购于南京泽朗医药有限公司;RNA 逆转录试剂盒购自宝生物工程(大连)有限公司; MMP-9、TIMP-1 mRNA引物由宝生物工程(大连)有限公司合成;real-time RT-PCR 扩增仪,美国BIO-RAD 公司;通用酶标仪,美国BIO-RAD 公司。
1.3 分组及给药 21只14周龄雄性SHR大鼠随机分为模型组、Ica低剂量组(20 mg/kg)、Ica高剂量组(40 mg/kg),每组7只,7只WKY大鼠为空白对照组。所有大鼠适应性喂养1周后,Ica低、高剂量组灌胃给药,每日2次,至26周龄,空白和模型组给予等体积双蒸水,实验结束后处死全部动物,取标本备用。
1.4 观察指标及检测
1.4.1 大鼠血清中Ⅰ、Ⅲ型胶原含量的检测 采用ELISA方法检测大鼠血清中Ⅰ、Ⅲ型胶原含量。腹主动脉取血2 mL,置于促凝管中,离心后取上清,稀释标准品、加样、温浴、洗涤、加酶、洗涤、显色、测定。计算出大鼠血清中Ⅰ、Ⅲ型胶原含量。
1.4.2 病理学观察 取各组大鼠心脏组织,置于10%福尔马林固定48 h后,经脱水、包埋、切片和HE染色,观察心肌形态学改变。
1.4.3 心肌组织中MMP-9、TIMP-1因子 mRNA的表达 每组各取心脏标本7例,采用real-time RT-PCR法检测。MMP-9、TIMP-1的mRNA 序列引物,由宝生物工程(大连)有限公司合成(见表1)。目的基因表达相对定量法:以PCR扩增过程中荧光信号强度达到阈值所需的循环数(cycle threshold,Ct值)为统计参数,依次计算平均Ct值=(Ct1 + Ct2)/2(重复管);dCt =平均Ct值-中间值;基因的表达=2-dCt;相对定量=目的基因的表达/内参基因的表达×100,将空白对照组的mRNA 表达量设定为100。
表1用于Real time RT-PCR的引物序列
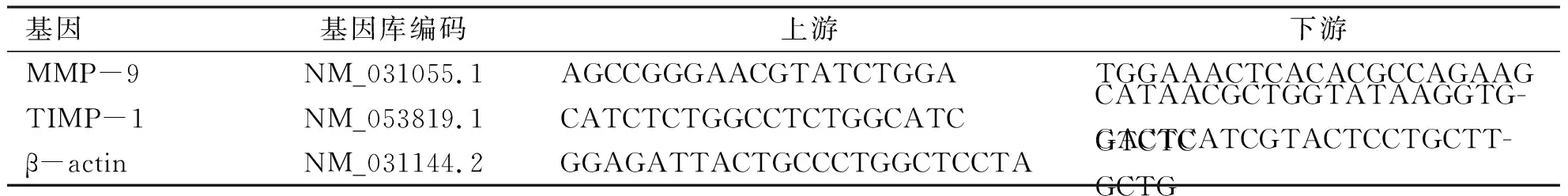
基因基因库编码上游下游MMP-9NM_031055.1AGCCGGGAACGTATCTGGATGGAAACTCACACGCCAGAAGTIMP-1NM_053819.1CATCTCTGGCCTCTGGCATCCATAACGCTGGTATAAGGTG-GTCTCβ-actinNM_031144.2GGAGATTACTGCCCTGGCTCCTAGACTCATCGTACTCCTGCTT-GCTG

2 结果
2.1 各组大鼠Ⅰ、Ⅲ型胶原含量的结果 与空白组WKY大鼠相比,模型组SHR大鼠的Ⅰ、Ⅲ型胶原含量明显上升(P<0.01),与模型组相比,Ica低、高剂量组的Ⅰ、Ⅲ型胶原含量明显下降(P<0.01或P<0.05),且Ica低高剂量组间无差异。

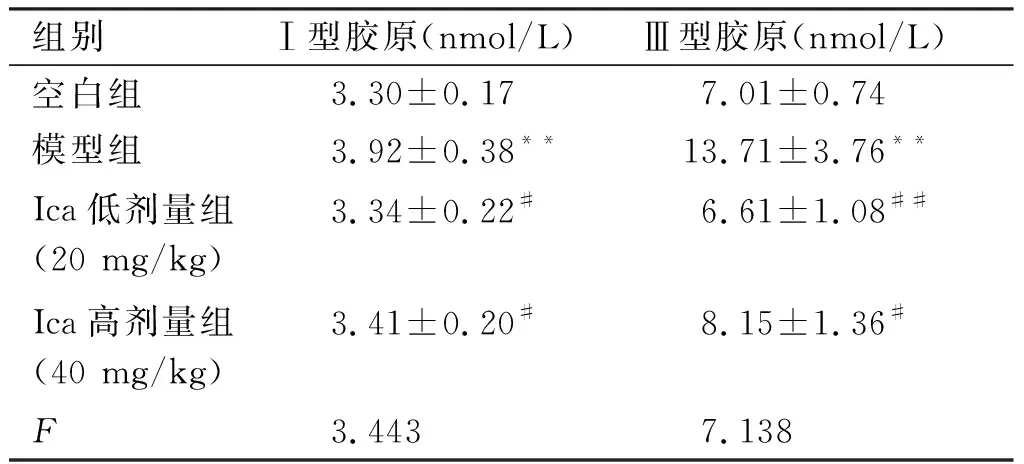
组别Ⅰ型胶原(nmol/L)Ⅲ型胶原(nmol/L)空白组3.30±0.177.01±0.74模型组3.92±0.38**13.71±3.76**Ica低剂量组(20 mg/kg)3.34±0.22#6.61±1.08##Ica高剂量组(40 mg/kg)3.41±0.20#8.15±1.36#F3.4437.138
注:与空白对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
2.2 病理学观察 HE染色显示,与空白组相比,模型组心肌细胞肥大、延长,排列紊乱,胶原聚集,血管周围纤维化和心肌间质纤维化明显增加。与模型组相比,Ica低、高剂量组心肌细胞排列较整齐,血管周围纤维化及间质纤维化均减轻(见图1)。
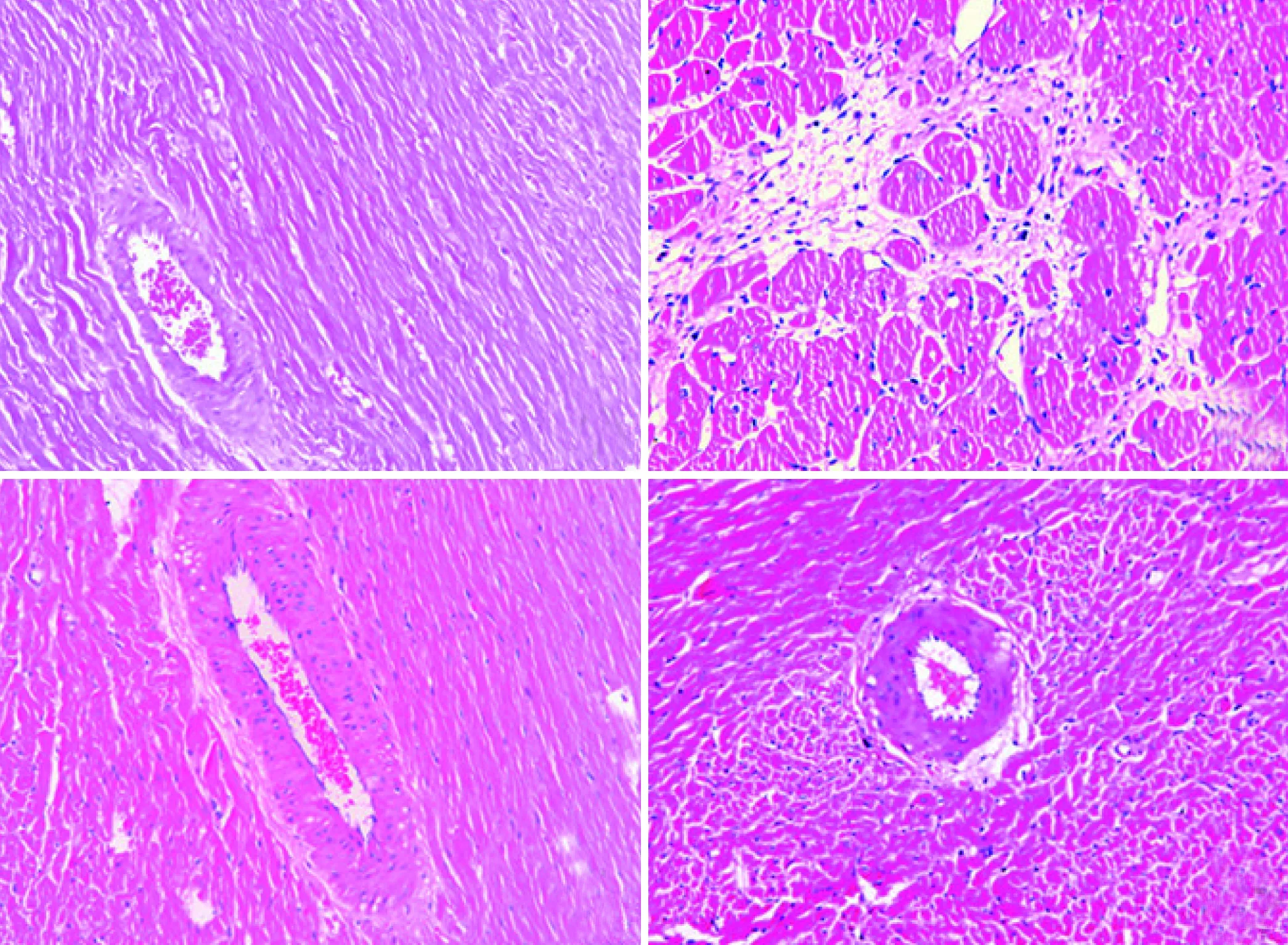
注:A:空白组;B:模型组;C:低剂量组;D:高剂量组。 图1 淫羊藿苷对SHR大鼠左室心肌病理学的影响(HE× 200)
2.3 心肌组织中MMP-9、TIMP-1因子mRNA的表达 与空白组相比,模型组MMP-9、TIMP-1 mRNA的表达明显上调(P<0.01)。与模型组相比,Ica低、高剂量组MMP-9 mRNA的表达明显下调(P<0.01或P<0.05),TIMP-1 mRNA的表达明显上调(P<0.01或P<0.05),且Ica低高剂量组间无差异(见表3)。


组别MMP-9TIMP-1空白组100±14.14100±9.38模型组255.21±11.45**150.64±5.83**Ica低剂量组(20 mg/kg)173.96±12.32#275.06±17.98#Ica高剂量组(40 mg/kg)155.87±2.87##250.26±3.68##F7.713 21.291
注:与空白对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
3 讨论
SHR大鼠与人类原发性高血压的发病过程和机理非常相似,此鼠高血压自发率为100%,还能继发高血压性心血管病变。WKY大鼠是SHR大鼠同源血压正常的京都大鼠。有研究表明,SHR大鼠在24周龄时即可明显发生血管周围纤维化和间质纤维化[4]。本研究中14周龄雄性SHR大鼠喂养至26周龄,模型组大鼠血清Ⅰ、Ⅲ型胶原含量明显上升,病理学HE染色结果显示心肌细胞肥大、延长,排列紊乱,胶原聚集,血管周围纤维化和间质纤维化,可认为心室重构模型制模成功。而Ica低、高剂量组给药至26周龄时,心肌细胞排列较模型组整齐,血管周围纤维化程度及间质纤维化减少,大鼠血清Ⅰ、Ⅲ型胶原含量较模型组明显下降。因此,可以认为Ica具有抗自发性高血压大鼠心室重构的作用。
心肌中MMPs是特异性降解心肌细胞外基质(ECM)成分的酶家族,是影响心室重构的重要因素。有实验表明,MMPs的升高与左心室重构有密切的关系[5]。Spinale 等对37例扩张型心肌病患者进行研究,发现左心室MMPs 的含量较空白组高2倍。MMP-9是基质金属蛋白酶-9,又称明胶酶B,是MMPs中分子量最大的酶。在纤维化早期MMP-9是分解ECM的主要酶,可引起ECM退化,导致心肌排列紊乱及收缩功能异常[6]。MMP-9除降解基质组分外,还能调控胶原合成,正常的胶原蛋白可被MMP-9分解,并被缺乏连接结构的纤维代替,最终纤维化增加伴随MMP-9升高[7]。本研究中,模型组大鼠MMP-9的表达明显升高,而Ica低、高剂量组大鼠较模型组MMP-9的表达均明显降低。提示Ica抗SHR心室重构的机制可能与降低MMP-9的表达有关。基质金属蛋白酶抑制剂-1(TIMP-1),是MMP-9内源性抑制剂,通过与之结合,特异性抑制MMP-9的活性。有研究表明,增加TIMP-1的表达可减少成纤维细胞的形成[8]。本研究结果显示,Ica可明显增加TIMP-1的表达,减少心肌血管周围纤维化和间质纤维化的形成。但值得注意的是,模型组的TIMP-1表达也升高,这可能与MMP-9的显著升高,代偿性地激活TIMP-1有关,但随着病程的延续和加重,TIMP-1代偿性的升高并不能完全抑制MMP-9的表达。综上,Ica抗SHR心室重构的机制可能与降低MMP-9、升高TIMP-1的表达有关。
[参考文献]
[1] Karaahmet T,Tigen K,Dundar C,et al. The effet of cardiac fibrosis on left ventricular remodeling,diastolic function,and N-terminal pro-B-type natriuretic peptide
levels in patients with nonischemic dilated cardiomyopathy [J] . Echocardiography,2010,27(8):854-960.
[2] 商卓,王文. 基质金属蛋白酶与压力超负荷致心室重构的研究进展 [J]. 现代医学,2010,38(3):324-327.
[3] 李利生,刘娟,王安斌,等. 淫羊藿苷对大鼠肝药物代谢Ⅱ相酶和药物转运体的影响. 遵义医学院学报[J]. 2012,35(1):13-16.
[4] 于学军,戚文航,顾德官,等.自发性高血压大鼠左室肥厚及心肌纤维化的动态变化[J]. 高血压杂志,1999,7(2):159-162.
[5] 刘军锋,贾克刚,刘运德. 基质金属蛋白酶与心脏重构及心肌病理损害的研究进展[J].中国老年心血管病杂志, 2007,7(9):499-500.
[6] Li M,Yang G,Xie B,et al. Changes in matrix metalloproteinase-9 levels during progression of atrial fibrillation [J]. J int Med Res,2014,42(1):224-230.
[7] Roten L,Nemoto S,Simsic J,et al . Effects of gene deletion of the tissue inhibitor of the matrix metalloproteinase-Type 1 ( TIMP-1) on left Ventricular geometry and function in mice [J].J Mol Cell Cardiol,2000,32(1):109 - 120.
[8] Kinoshita T,Ishikawa Y,Arita M,et al. Antifibrotic response of cardiac fibroblasts in hypertensive hearts through enhanced TIMP-1 expression by basic fibroblast growth factor [J]. Cardiovasc Pathol,2014,23(2):92-100.
