青蒿素类衍生物结构修饰研究进展
2014-08-11路娟陈莉房碧晗宗传杰陈曦
路娟,陈莉,2,房碧晗,3,宗传杰,2,陈曦
(1.中国医学科学院药用植物研究所,北京 100193;2.黑龙江中医药大学,黑龙江哈尔滨 150040;3.佳木斯大学,黑龙江 佳木斯 154007)
青蒿素(Artemisinin)是1972年从菊科植物黄花蒿(Artemisia annua L.)中提取的新型抗疟药[1],是中国唯一被世界卫生组织认可的按西药研究标准研究开发的植物药,也是第一个真正得到全球公认的重要产品,1979年确认了其结构,它是一种新型倍半萜内酯,具有过氧键和内酯环,有一个包括过氧桥在内的1,2,4-三噁烷结构单元[2-3],其分子结构式如图1所示。

图1 青蒿素化学结构式
虽然青蒿素对疟疾的治疗具有高效、副作用低和对抗药性疟疾有效等优点,但是青蒿素亲水亲油性都较差,很难制成合适的剂型,使用不方便,造成生物利用度低和复燃率高等问题[4]。因此,化学工作者对青蒿素进行侧链的改造,母环的修饰,并对合成的衍生物进行活性的研究,希望筛选出疗效更为优良的药物[5-7]。目前,已成功合成了成百上千种青蒿素衍生物,但是成功用于临床的并不多。
Gabor A.Balint[2],沈丹丹[8]等对 2007 年之前的青蒿素衍生物已进行了较好的总结,本文对青蒿素的具有代表性的衍生物和近几年青蒿素衍生物的进展进行全面综述。
1 青蒿素衍生物目前已上市药物
70年代末,李英等首先将青蒿素催化加氢得到双氢青蒿素(1,图2),双氢青蒿素作为青蒿素体内的有效代谢产物,抗疟作用是青蒿素的4~8倍,作为一类全新结构的抗疟药,双氢青蒿素具有迅速、安全、高效、低毒且与大多数抗疟药无交叉抗性等特点。但是双氢青蒿素的水溶性差和半衰期短导致的生物利用度低和抗疟复燃率高的缺点,在一定程度上限制了其临床应用。
以双氢青蒿素为中间体,在酸的催化下形成蒿甲醚(2,图2)[9]。蒿甲醚经临床研究证实不仅保持了青蒿素的特点,而且具有了油溶和水溶的特点,显示了比青蒿素更好的化学稳定性,能使复燃率有所降低。其油溶性较大的特点使得它可以制成针剂,对抢救危重疟疾病人非常有利。蒿甲醚于1981年通过鉴定,1995年载入《国际药典》,已被WHO列为治疗凶险型疟疾的首选药。蒿甲醚对疟原虫红内期有强大、快速的杀灭作用,能迅速控制临床发作及症状,抗疟作用比青蒿素强10~20倍。

图2 蒿甲醚和青蒿琥酯的合成路线
李英等[10]用吡啶作为催化剂,双氢青蒿素与酸酐或酰氯作用,合成了碳酸酯、羧酸酯类衍生物,青蒿琥酯(3,图2)是目前唯一有效的青蒿素水溶性衍生物,具有多种给药特点,并且成功应用于临床[11]。
2 青蒿素轭合物
近几年的文献报道中,青蒿素类化合物的结构修饰较多的运用了轭合物的设计这一理念,运用药物拼合原理和药物前药原理,将两个药物的药效团经共价键结合成单一分子,以期获得毒副作用减小,药理作用相加的新药,从而实现单分子多功效,能够显著提高药物的作用[12-14]。
2.1 与抗病毒类药物形成轭合物

图3 青蒿素与抗病毒及抗肿瘤类药物形成的轭合物
为了考察轭合物间隔臂的长短对抗病毒活性的影响,孙政进[15]以双氢青蒿素为先导物,采用不同长度的柔性直链脂肪二元酸为间隔臂,同时为了考察青蒿素与不同的抗病毒药物形成的轭合物对抗病毒作用的影响,选择了AZT、d4T、双氢青蒿素为取代基与双氢青蒿素形成轭合物,除此之外,还设计了具有抗肿瘤作用的去氢姜酮作为取代基,合成了16个目标化合物(如图3所示),并初步探讨了此类轭合物的抗病毒作用。
2.2 与抗肿瘤类药物形成轭合物
2.2.1 糖苷类物质对青蒿素的结构修饰
糖类物质是生物体内的重要的活性物质,具有很多生理功能,并且糖本身具有良好的溶解性能和药理功能,为了改善青蒿素的水溶性,提高其抗肿瘤活性,任彦荣[4]分别采用化学合成和酶催化合成的方法对青蒿素进行糖基化修饰(如图4所示),通过体外活性筛选得到半乳糖-青蒿素对人宫颈癌Hela细胞具有较好的抑制活性和诱导细胞凋亡的作用,抑制效果优于对照组青蒿素。在体外抗肿瘤活性筛选的基础上,建立了小鼠宫颈癌U14动物模型,对瘤体的体积和质量、生存时间变化及毒性进行研究,并对糖基化青蒿素衍生物的抗肿瘤活性做出了较全面的评价,两种制备方法得到的产物质量抑瘤率分别为47.7%和55.9%,而根据中药疗效评价规定的指标——抑瘤率30%以上,判定该药物具有一定的抗肿瘤作用。因此,糖基化青蒿素具有一定的抑瘤作用,且酶法制备的产物活性稍高。
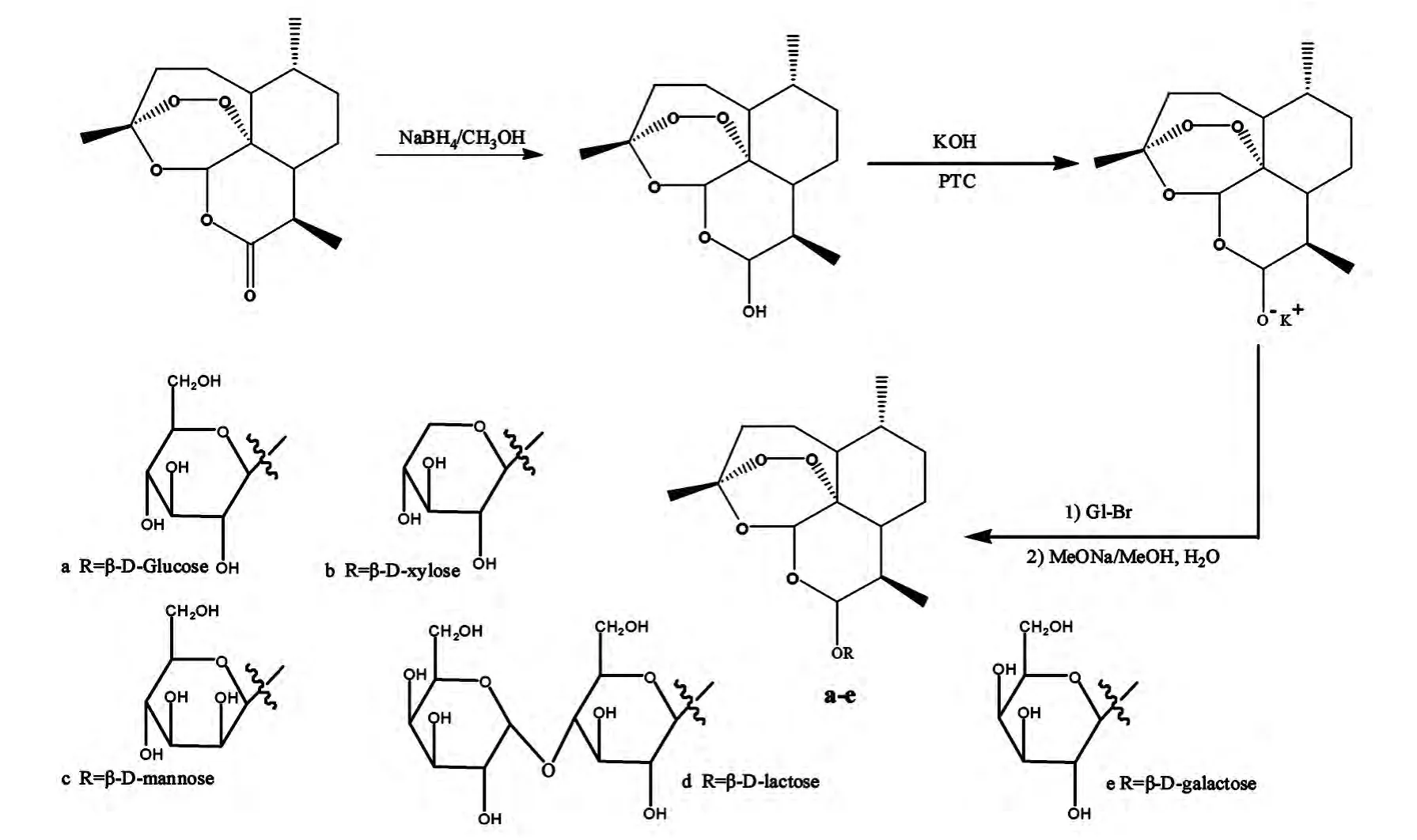
图4 青蒿素的糖基化修饰
2.2.2 二十二碳六烯酸对青蒿素的结构修饰
二十二碳六烯酸(DHA)是多元不饱和脂肪酸的一种,其本身具有一定的抗肿瘤效果,并且具有肿瘤细胞靶向性,已经广泛用于合成靶向抗肿瘤药物。

图5 二十二碳六烯酸双氢青蒿素酯的合成路线
采用MTT法考察二十二碳六烯酸双氢青蒿素酯(图5)的体外抗肿瘤活性,二十二碳六烯酸双氢青蒿素酯对人Burkitt淋巴瘤细胞株CA46、人T淋巴细胞白血病细胞株Molt4和小鼠淋巴瘤细胞P388三种肿瘤细胞株具有显著的增殖抑制作用,IC50值分别为0.024,0.076 和 0.105mg/L,抑制作用明显优于青蒿素和双氢青蒿素[16-17]。
2.2.3 茄尼醇衍生物、非甾体抗炎药和NO供体对青蒿素的结构修饰
茄尼醇衍生物[18]、非甾体抗炎药[19]和 NO 供体[20-21]都具有一定的抗肿瘤活性,为了进一步提高青蒿素的抗肿瘤活性,孟丽丽等[17]采用药物拼合的原理,将这些药物分子引入到青蒿素结构中,得到了一系列具有多重抗肿瘤机制的新型青蒿素类拼合药物。
茄尼醇具有包括抗肿瘤作用在内的多种生物活性,广泛应用于合成具有抗肿瘤活性的茄尼醇衍生物,以青蒿琥酯作为母核,将茄尼醇分子引入到青蒿素结构中,对青蒿素的抗肿瘤活性起到协同增强作用,如图6路线a所示。
5-单硝酸异山梨醇是一种硝酸盐类NO供体,一氧化氮供体能在体内释放出NO分子,而NO可以增强巨噬细胞对肿瘤细胞的毒性,抑制肿瘤细胞的增殖,抑制血管的生成和转移并加速肿瘤细胞的凋亡。选用DCC/DMAP作为催化体系,将青蒿琥酯的侧链羧基和5-单硝基异山梨醇的羟基成酯,反应方程式如图6中路线b所示。
布洛芬和阿司匹林是典型的非甾体抗炎药,近年来发现这类药物还具有抗肿瘤作用,对多种肿瘤细胞都有抑制效果。以二氢青蒿素作为反应母核,将布洛芬和阿司匹林分子引入青蒿素的结构中,得到两种青蒿素类拼合物,反应方程式如图7中c和d所示。
采用MTT法考察青蒿素类拼合物1、2和3的体外抗肿瘤活性,三个新型青蒿素类拼合物对人Burkitt淋巴瘤细胞株 CA46、人 T淋巴细胞白血病细胞株Molt4和小鼠淋巴瘤细胞P388三种肿瘤细胞株均具有显著的增殖抑制作用,除了化合物3对小鼠淋巴瘤细胞P388的抑制作用小于青蒿素和双氢青蒿素外,其余化合物的抑制作用明显优于青蒿素和双氢青蒿素。
2.2.4 聚乙二醇对青蒿素的结构修饰
聚乙二醇(PEG)修饰技术是一种用于改进药物体内药动学性质的新方法。PEG化可在一定程度上改变药物的性质,应用于增加药物稳定性和溶解度、提高生物利用度、提高受体亲和力、延长体内半衰期等。PEG对小分子药物的修饰,可以把它的许多优良性质也随之转移到结合物中,使该聚合物具有优异的生物相容性,在体内能溶于组织液中,能被机体迅速排出体外而不产生任何毒副作用,因此在医学上的应用受到了广泛的重视[22-26]。

图6 茄尼醇(a)和5-单硝酸异山梨醇(b)对青蒿琥酯的结构修饰

图7 布洛芬和阿司匹林对二氢青蒿素的结构修饰
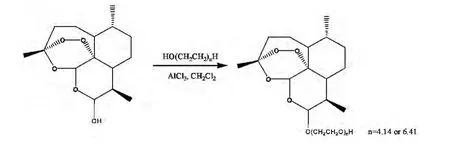
图8 聚乙二醇对二氢青蒿素结构修饰
由于双氢青蒿素较难溶于水且在水中易结晶的缺点,郭伟等[27]采用小分子量的聚乙二醇对双氢青蒿素C10位羟基进行结构修饰(如图8所示),并对其结构进行了表征,但是修饰后化合物的活性未进行相关报道。
张建新等[28]以双氢青蒿素为原料,采用低分子量的聚乙二醇对其进行结构修饰(如图9所示),得到一系列新的青蒿素衍生物,并对这些化合物进行了免疫抑制活性的筛选。通过对T细胞丝裂原伴刀豆蛋白和B细胞丝裂原诱导T细胞和B细胞增殖反应的测定,合成的大多数化合物都有体外免疫抑制活性。
双取代的青蒿素醚类化合物活性高于单取代化合物的抑制活性,在1×10-6~1×10-7mol/L浓度时,抑制率可达80%~90%左右,显著高于青蒿素和青蒿琥酯。
3 青蒿素非轭合物
Lombard MC 等[29-30]合成了两种青蒿素 -4 - 氨基喹啉二聚体(如图10所示),并考察了这两种化合物在小鼠体内对于文氏疟原虫是否有抗疟作用。二聚体1在连续给药(给药剂量腹腔注射2.5mg/kg和口服50mg/kg)4天后,第5天进行检测,疟原虫的量小于1%,而二聚体2腹腔注射7.5mg/kg和口服25mg/kg 4天后,第5天检测也可以起到相同的作用。通过这两种化合物的药代动力学的研究发现,其抗疟活性可能与这两种化合物的活性代谢物有关。与抗肿瘤药物依托泊甙相比,针对TK10、UACC62和MCF7细胞株,二聚体1表现出了更好的抗肿瘤活性。因此,二聚体1中的1,3-二氨基丙烷可以作为青蒿素分子间的最佳的间隔臂。
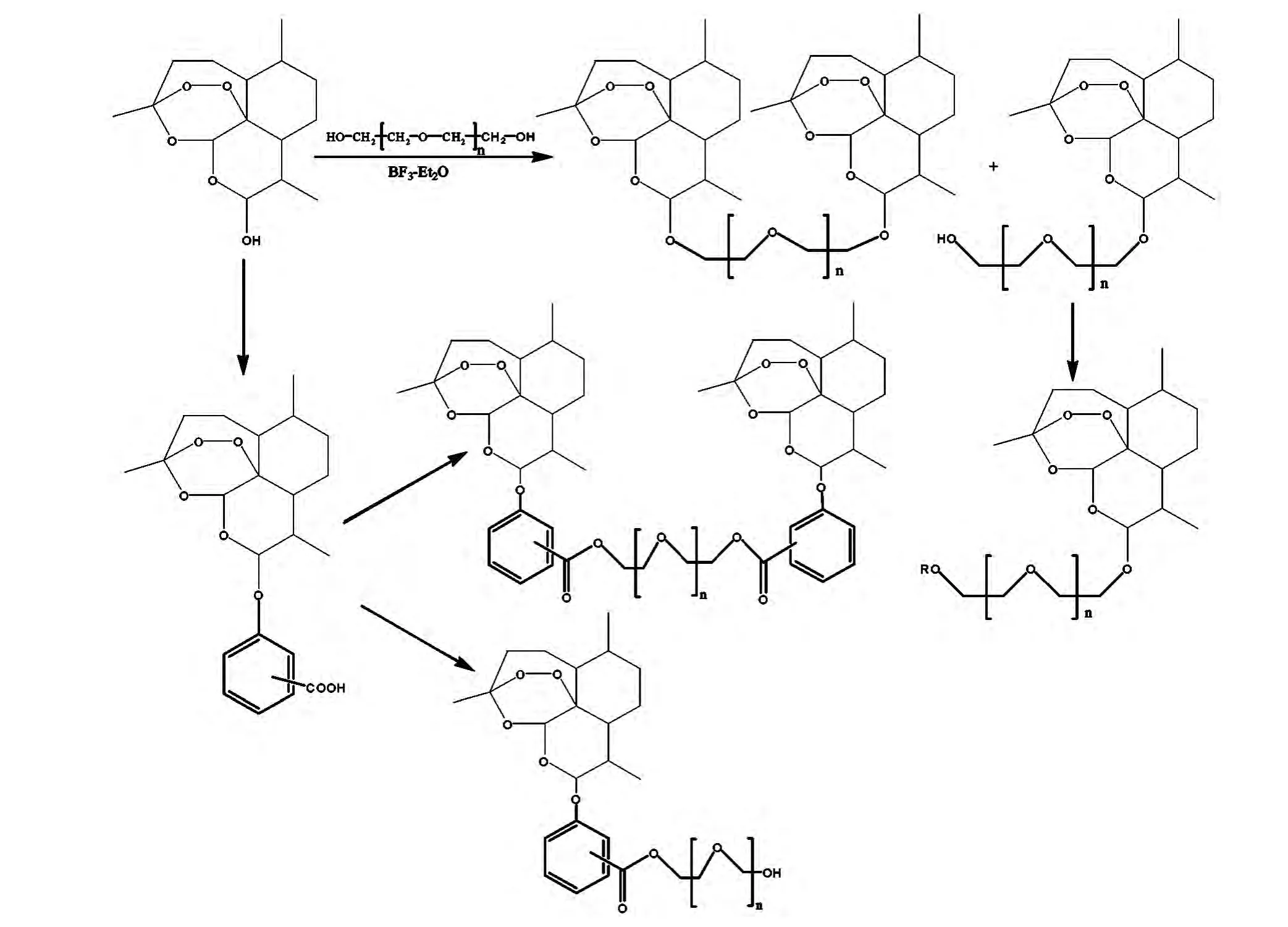
图9 低分子量聚乙二醇对二氢青蒿素结构修饰
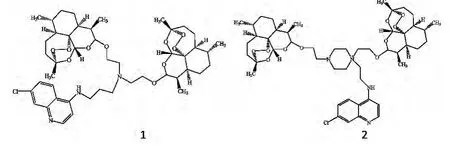
图10 青蒿素-4-氨基喹啉二聚体结构式
由于青蒿素在临床上产生的耐药性,Held J等[31-32]合成了一系列的青蒿素衍生物,如图11所示,并对以上化合物体外抗恶性疟原虫菌株的活性进行了考察,以上所有的化合物均具有较高的活性,IC50值小于13nM。该研究推动了青蒿素在抗疟活性方面的应用。
郭彬通过前药设计的原理[33],选择10-OH作为衍生位点,设计了以双氢青蒿素为母环,4-羟基苯甲醇衍生物为配体的新化合物(CQMU-DHA-10),如图12所示,结构中含有一个碳酸酯及一个醚键,在体内可能通过生物水解和化学水解两种途径释放出原药双氢青蒿素。经实验验证,得到的目标化合物具有良好的水溶性,且在兔体内代谢实验表明其在兔体内释放出原药双氢青蒿素而发挥抗疟作用,但是并未对该化合物进行体内半衰期及生物利用度的研究,也未对化合物活性进行报道[34]。
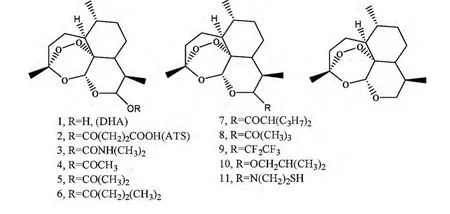
图11 青蒿素衍生物结构式
抗疟药青蒿素类衍生物的抗肿瘤和抗病毒活性已经有大量文献进行了报道,Alba G.Blazquez等[35]合成了一系列青蒿素类衍生物(AD1-AD8,如图13所示),并通过肝癌、结肠癌和病毒性肝炎B和C体外模型对该类化合物的体外活性进行了评价。通过对化合物AD1-AD8在人体肝癌细胞HepG2和SK-HEP-1、结肠腺癌细胞LS174T在6h和72h的细胞存活率的评价,可以得出AD5具有较低的急性毒性和较高的抗细胞繁殖的活性(IC50=1~5μM)。但是,化合物的抗癌和抗病毒的药理活性还需在动物体内进行进一步的评价。
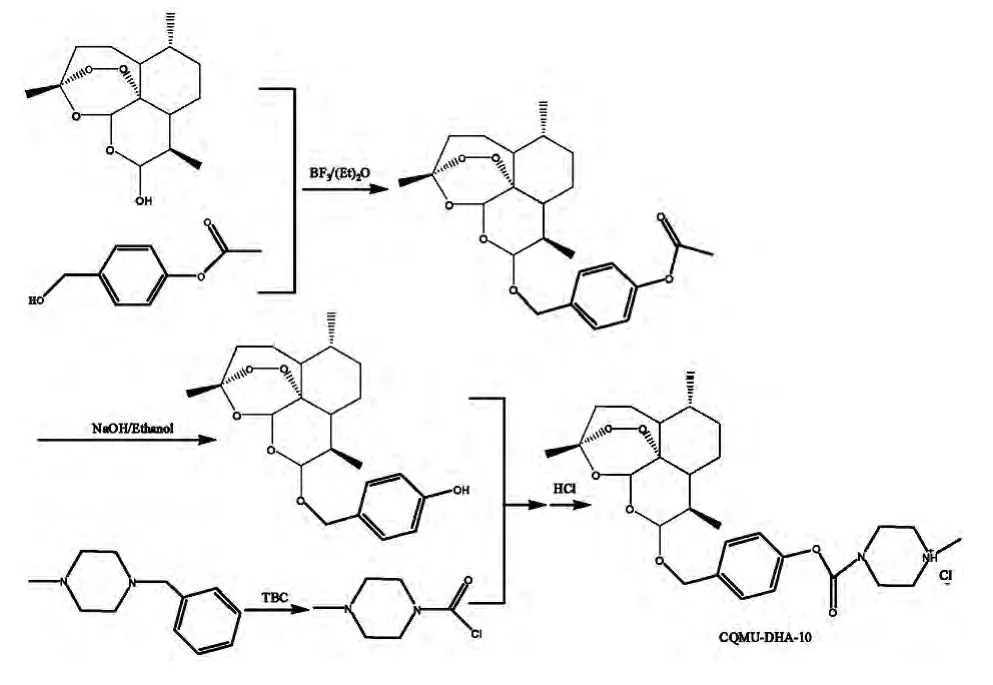
图12 4-羟基苯甲醇衍生物为配体的双氢青蒿素衍生物
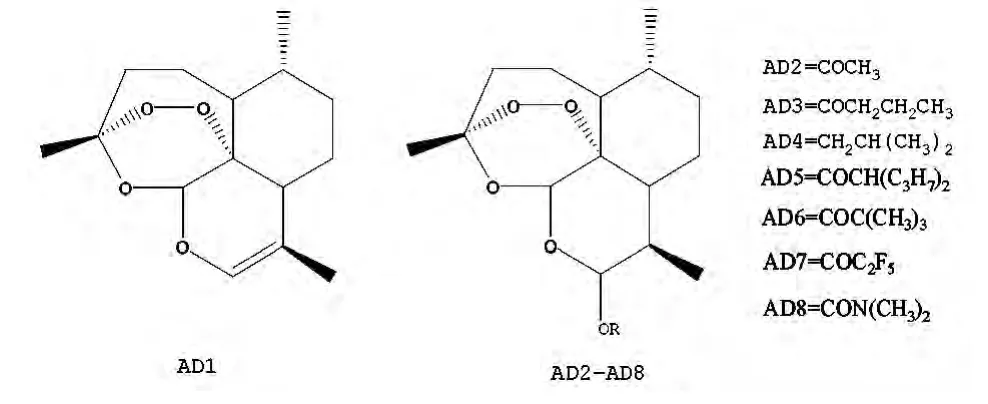
图13 青蒿素衍生物AD1-AD8的化学结构式
Cloete等[36]合成了11种青蒿素的氨基乙醚类衍生物,并对它们的的抗疟活性进行了考察,活性最高的化合物为向青蒿素分子中引入短链芳基衍生物,仅含有一个氮原子(如图14所示,IC50=1.44nM),而长链的多胺衍生物的活性较低。

图14 向青蒿素分子中引入短链芳基衍生物的化学反应式
Wang等[37]合成一种新的水溶性青蒿素衍生物SM905(结构式如图15所示),SM905在体内和体外均具有较好的免疫活性,并且可以抑制 T细胞的活性。

图15 青蒿素衍生物SM905的化学结构式
Yang等[38]以双氢青蒿素为母核,合成了一系列双氢青蒿素苄基醚类化合物(如图16所示),并以青蒿素、蒿甲醚和青蒿琥酯作为对照药,考察了这一系列化合物在鼠脾细胞上的细胞毒性、ConA引起的T细胞增殖或者LPS引起的B细胞增殖的抑制活性。在这些双氢青蒿素衍生物中,部分化合物对于ConA引起的T细胞增殖的抑制活性是青蒿素的5~9倍,抑制LPS引起的B细胞增殖活性是青蒿素的30~88倍。但是该类化合物的细胞毒性比青蒿素的要高。

图16 双氢青蒿素苄基醚类化合物结构式
4 前景及展望
目前,青蒿素结构修饰的目的之一是合成出一种能够解决青蒿素水溶性差、复燃率高等缺点并保留其抗疟活性的全新结构的修饰物,另一个目的是针对青蒿素其他药理活性进行修饰。在对青蒿素衍生物进行的生理活性的研究中发现,青蒿素衍生物除抗疟活性外,还具有抗肿瘤、抗吸血虫和提高免疫力等活性。近年来,青蒿素及其衍生物以其独特的抗肿瘤作用机制和高效、低毒的抗肿瘤活性引起了广泛的关注。高分子载体对抗肿瘤药物的修饰更是研究的热点。结合本实验室的研究工作,通过采用高分子量聚乙二醇(mPEG),以不同的氨基酸作为间隔臂,对双氢青蒿素进行结构修饰,与原药双氢青蒿素相比,得到的化合物在体外抗肿瘤活性方面具有不同程度的改善。以聚乙二醇作为载体的药物修饰技术,可以克服药物本身的一些缺点,达到靶向缓控释的效果,但是目前的研究只是浅尝辄止,对该方向的深入的研究对青蒿素的临床应用和综合利用有着重要的意义。
[1]Nakase I,Lai H,Singh NP,et al.Anticancer properties of artemisinin derivatives and their targeted delivery by transferrin conjugation[J].Int J Pharm,2008,354(1 -2):28 -33.
[2]Balint GA.Artemisinin and its derivatives:an important new class of antimalarial agents[J].Pharmacol Ther,2001,90(2 - 3):261 -265.
[3]Rita B,Benedetta I,Stefano P,et al.Distribution of artemisinin and bioactive flavonoids from Artemisia annua L.during plant growth[J].Biochem Syst Ecol,2008,36(5 -6):340 -348.
[4]任彦荣.糖基化青蒿素的制备及抗肿瘤活性研究[D].重庆:重庆大学,2008.
[5]Wu JM,Shan F,Wu GS,et al.Synthesis and cytotoxicity of artemisinin derivatives containing cyanoarylmethyl group[J].Eur J Med Chem,2001,36(5):469 -479.
[6]Oh S,Jeong IH,Ahn CM,et al.Synthesis and antiangiogenic activity of thioacetal artemisinin derivatives[J].Bioorg Med Chem,2004,12(14):3783-3790.
[7]Cloete TT,Krebs HJ,Clark JA,et al.Antimalarial activity of 10 -alkyl/aryl esters and - aminoethylethers of artemisinin[J].Bioorg Chem,2013,46:10 -16.
[8]沈丹丹,沈敏敏,臧运晓,等.双氢青蒿素衍生物的研究进展[J].化学通报,2008,71(9):659 -663.
[9]李雪芳,夏都灵,刘国柱,等.双氢青蒿素醚化法制备蒿甲醚的工艺优化[J].实验科学与技术,2008,6(2):36 -38.
[10]李英,虞佩琳,陈一心,等.青蒿素类似物的研究Ⅱ-应用高效酰化催化剂DMAP合成双氢青蒿素的羧酸酯和碳酸酯类衍生物[J].化学学报,1982,40(6):557 -560.
[11]Ploypradith P.Development of artemisinin and its structurally simplified trioxane derivatives as antimalarial drugs[J].Acta Tropica,2004,89(3):329 -342.
[12]Buijsman RC,Basten JEM,Dinther TG,et al.Design and synthesis of a novel synthetic NAPAP-pentasaccharide conjugate displaying a dual antithrombotic action[J].Bioorg Med Chem Lett,1999,9(14):2013-2018.
[13]Portoghese PS.From models to molecules:opioid receptor dimers,bivalent ligands,and selective opioid receptor probes[J].J Med Chem,2001,44(14):2259 -2269.
[14]Wermuth,CG.Selective Optimization of Side Activities:Another Way for Drug Discovery[J].J Med Chem,2004,47(6):1303 -1314.
[15]孙政进.抗病毒青蒿素核苷类轭合物的设计与合成研究[D].广州:广东药学院,2008.
[16]Jaracz S,Chen J,Kuznetsova LV,et al.Recent advances in tumortargeting anticancer drug conjugates[J].Bioorg Med Chem,2005,13(17):5043-5054.
[17]孟丽丽.新型青蒿素衍生物的合成及其抗肿瘤活性的初步研究[D].长沙:湖南大学,2009.
[18]顾正桂,王琼.茄尼醇的应用及衍生物的合成研究进展[J].化学世界,2006,47(11):692 -695.
[19]Bardou M,Barkun AN,Ghosn J,et al.Effect of chronic intake of NSAIDs and Cyclooxygenase 2-selective inhibitors on esophageal cancer incidence[J].Clin Gastroenterol Hepatol,2004,2(10):880-887.
[20]静永旺,袁胜涛,张陆勇,等.一氧化氮供体型非甾体抗炎药抗肿瘤作用机制研究现状[J].药学进展,2008,32(12):543 -547.
[21]Yeh RK,Chen J,Williams JL,et al.NO -donating nonsteroidal antiinflammatory drugs(NSAIDs)inhibit colon cancer cell growth more potently than traditional NSAIDs:a general pharmacological property[J].Biochem Pharmaeol,2004,67(12):2197 - 2205.
[22]Greenwald RB.PEG drugs:an overview[J].J Control Release,2001,74(1 -3):159 -171.
[23]Conover CD,Greenwald RB,Pendri A,et al.Camptothecin delivery systems:enhanced efficacy and tumor accumulation of camptothecin following its conjugation to polyethylene glycol via a glycine linker[J].Cancer Chemother Pharmacol,1998,42(5):407 - 414.
[24]Lu J,Cheng CM,Zhao XE,et al.PEG-scutellarin prodrugs:Synthesis,water solubility and protective effect on cerebral ischemia/reperfusion injury[J].Eur J Med Chem,2010,45(5):1731 -1738.
[25]Greenwald RB,Gilbert CW,Pendri A,et al.Drug delivery systems:water soluble taxol 2'- poly(ethylene glycol)ester prodrugs- design and in vivo effectiveness[J].J Med Chem,1996,39(2):424 -431.
[26]Greenwald RB,Choe YH,McGuire J,et al.Effective drug delivery by PEGylated drug conjugates[J].Adv Drug Deliver Rev,2003,55(2):217-250.
[27]郭维,吴勇权,郑绿茵,等.聚乙二醇基双氢青蒿素衍生物的合成[J].化学试剂,2008,30(1):55 -56.
[28]张建新,王峻霞,张瑜,等.具有免疫抑制作用的含有聚乙二醇基的青蒿素衍生物的合成[J].药学学报,2006,41(1):65 -70.
[29]Lombard MC,N’Da DD,Breytenbach JC,et al.Artemisininquinoline hybrid-dimers:synthesis and in vitro antiplasmodial activity[J].Bioorg Med Chem Lett,2010,20(23):6975 -6977.
[30]Lombard MC,N’Da DD,Breytenbach JC,et al.Antimalarial and anticancer activities of artemisinin-quinoline hybrid-dimers and pharmacokinetic properties in mice[J].Eur J Pharm Sci,2012,47(5):834-841.
[31]Soomro S,Konkimalla VB,Langenberg T,et al.Design of novel artemisinin-like derivatives with cytotoxic and anti-angiogenic properties[J].J Cell Mol Med 2011,15(5):1122 -1135.
[32]Held J,Soomro SA,Kremsner PG,et al.In vitro activity of new artemisinin derivatives against Plasmodium falciparum clinical isolates from Gabon[J].Int J Antimicrob Agents,2011,37:485 -488.
[33]Calderon M,Welker P,Licha K,et al.Development of efficient macromolecular prodrugs derived from dendritic polyglycerol[J].J Control Release,2010,148(1):24 -25.
[34]郭斌.双氢青蒿素水溶性衍生物的设计与合成[D].长沙:重庆医科大学,2010.
[35]Alba GB,Manuel FD,Laura SV,et al.Novel artemisinin derivatives with potential usefulness against liver/colon cancer and viral hepatitis[J].Bioorgan Med Chem,2013,21(14):4432 -4441.
[36]Cloete TT,Breytenbach JW,Kock C,et al.Synthesis,antimalarial activity and cytotoxicity of 10-aminoethylether derivatives of artemisinin[J].Bioorg Med Chem,2012,20(15):4701 -4709.
[37]Wang JX,Tang W,Yang ZS,et al.Suppressive effect of a novel water-soluble artemisinin derivative SM905 on T cell activation and proliferation in vitro and in vivo[J].Eur J Pharmacol,2007,564(1-3):211-218.
[38]Yang ZS,Wang JX,Zhong Y,et al.Synthesis and immunosuppressive activity of new artemisinin derivatives.Part 2:2 -[12(β or α)-Dihydroartemisinoxymethyl(or 1'- ethyl)]phenoxyl propionic acids and esters[J].Bioorg Med Chem,2006,14(23):8043 - 8049.
