人树突状细胞与肺癌细胞A-549融合疫苗生物学 特性研究
2014-08-10王佳烈马国强
王佳烈,马国强
论著·基础
人树突状细胞与肺癌细胞A-549融合疫苗生物学 特性研究
王佳烈,马国强
目的探讨人树突状细胞(DC)与人肺癌细胞A-549融合所得疫苗在制备过程中的生物学特性,总结高效制备融合疫苗的方法。方法应用GM-CSF和IL-4优化的方法制备肺癌患者人外周血单核细胞以获得DC,寻找DC制备率最高时间段;同时应用PKH672GL(绿色荧光)和PKH262GL(红荧光)分别标记DC和肺癌细胞A-549细胞,筛查最佳的融合比例。结果应用GM-CSF和IL-4优化法进行DC制备第7天所得百分率为(66.26±5.13)%,高于其他时间(P<0.05);通过对比不同融合比例DC与人肺癌细胞A-549,显示1∶1时所取得的融合百分率为(35.15±2.16)%,高于其他比例(P<0.05)。结论在DC制备过程中制备第7天所得DC百分率最高,应选取此时作为提取DC的最佳时间;同时DC与人肺癌细胞A-549以1∶1比例相融合所得疫苗百分率最高。
人树突状细胞;人肺癌细胞A-549;融合;疫苗
肺癌是十分常见的一种恶性肿瘤,目前的治疗方法主要有放疗、化疗及手术等多种方式,但治疗效果仍不十分理想。细胞免疫治疗是近年来新兴的一种肿瘤治疗方式。其主要原理为诱导树突状细胞(DC)和自体T细胞,使其成为细胞毒性T淋巴细胞。其中DC作为一种递呈细胞,不仅能够加工和递呈抗原,还能有效激活T淋巴细胞使其成为效应T细胞,因此DC在免疫治疗中有着十分重要的作用[1]。现制备人外周血单核细胞获得DC以找出其制备的最佳时段,并通过标记DC与人肺癌细胞A-549,找出二者的最佳融合比。
1 材料与方法
1.1 材料 应用15%胎牛血清(FCS)的RPMI1640培养50例人肺癌细胞A-549,纳入标准:经过临床诊断、影像学诊断和病理诊断均确诊为肺癌患者;尚未进行放疗、化疗或手术治疗;患者生存时间保守估计﹥6个月。排除标准:存在严重躯体性疾病;出现脑转移;自身或家族内存在精神病病史;存在严重智力或认知障碍。按随机数字表法随机分为5组,每组10例;同时应用GM-CSF和IL-4优化法培养250份DC,将250份DC同样按照随机数字表法随机分为5组,每组50份,培养时间分别为1d、3d、7 d、10d及14 d。
1.2 方法
1.2.1 培养方法:将含有15% FCS的RPMI1640培养人肺癌细胞株A-549细胞,用GM-CSF和IL-4优化的方法,培养成人外周血单核细胞,并用TNF-α和PGE2促成熟2d后获得成熟DC,倒置显微镜观察DC的形态[2]。
1.2.2 检测方法:分别选取A549细胞和细胞球置于盖玻片上进行培养,给予其37℃和5% CO2,完成爬片后取出玻片使用4%多聚甲醛进行固定,之后使用PBS进行润洗,接着用0.3%Triton X-100进行透化处理,封闭后以1∶400的比例加入一抗,并置于4℃的冰箱内过夜[3]。第2天,取出玻片,使用PBS洗涤后以1∶500的比例加入二抗,同时以37℃的温度在避光条件下孵育1h,再用PBS洗涤,应用PKH672GL(绿色荧光)和PKH262GL(红荧光)分别标记DC和肺癌细胞A-549细胞。以50%聚乙二醇和10%二甲基亚砜作为融合剂,构建融合细胞,用共聚焦显微镜对融合细胞照相,并使用流式细胞仪快速检测红绿双荧光细胞所占的百分率代表细胞融合率[4]。
1.3 观察项目
1.3.1 DC制备最佳时间:应用GM-CSF和IL-4优化的方法对人外周血单核细胞进行培养,分别于第1天、第3天、第7天、第10天及第14天各培养皿加入MCH-I类分子,在充分震荡后应用流式细胞仪对细胞进行检测,对比分析不同时间DC的制备率。
1.3.2 最佳融合比例:于DC制备最佳时间采集DC,应用PKH672GL染色标记,同时将染色标记好的DC与应用PKH262GL染色标记好的人肺癌细胞A-549进行融合,以二甲基亚砜作为融合剂,应用流式细胞仪对融合百分率进行分析,对比分析不同DC与人肺癌细胞A-549所融合的比例(包括3∶1、2∶1、1∶1、1∶2及1∶3)。
1.4 统计学方法 应用SPSS 19.0软件统计分析数据。计量资料以均数±标准差表示,应用F检验及独立样本t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 DC制备率最佳时间 应用GM-CSF和IL-4优化法进行DC制备第1天、第3天、第7天、第10天、第14天制备率分别为(35.51±3.11)%、(46.26±2.7)%、(66.26±5.13)%、(51.18±2.82)%、(41.51±1.38%)。第7天所得百分率高于其他时间(P<0.05)。
2.2 最佳融合比例 通过对比不同融合比例DC与人肺癌细胞A-549显示,3∶1、2∶1、1∶2、1∶3、时融合率分别为(13.62±1.71)%、(21.16±2.61)%、(35.15±2.16)%、(11.78±1.53)%、(30.13±1.93)%。1∶1时所取得的融合百分率高于其他比例(P<0.05)。
3 讨 论
DC是目前所发现的体内功能最强大的专职抗原递呈细胞之一,其在刺激机体的免疫反应中有着十分重要的作用。DC能表达高水平的MHC-I、MHC-II类分子及CD80和 CD40等分子,能有效地向T淋巴细胞递呈抗原刺激T细胞产生免疫应答。肿瘤患者体内由于缺少DC或存在功能障碍,导致无法有效递呈肿瘤抗原,T细胞免疫激活受阻,致使机体免疫功能下降甚至消失或是出现免疫耐受,使得肿瘤继续生长。人体内DC主要源于骨髓、外周血及脐血。而单核DC与具有抗原性的单核肿瘤细胞融合就可以产生特异性较强的免疫性抗原。因此寻找诱导癌细胞增值分化以及致使治疗失败的主要成分就成为了研究的关键。
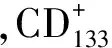
本研究中,为了防止没有经过融合的肿瘤细胞对患者产生污染,需要对细胞进行筛选,以便滤出未融合肿瘤细胞,提高融合DC疫苗的纯度。为达到这个目的,本次研究使用特异性标记体或是带有特异性标志的肿瘤细胞,通过在极低浓度条件下使用PKH67GL和PKH26GL标记人DC和肺细胞,这样就能保证在正常浓度范围内细胞不会存在明显毒性[6]。通过在共聚焦显微镜视野下观察呈现出红色和绿色2种荧光的细胞融合,能够利于细胞仪进行筛选。使用PKH67-GL和PKH-62GL荧光染料标记细胞,能够使人源DC与肺部细胞结合的DC疫苗更加易于区分,这种方式不仅简便,而且观察起来十分直观、快速,不需要考虑肿瘤细胞的抗原标志就可以方便快捷地筛选融合细胞。基于这些特性,其在融合DC疫苗治疗肺癌领域内得到普遍重视。此次研究使用了一种更加可靠、有效的分离方式来分离肺癌干细胞,即在无血清的条件下通过使用培养悬浮球的方式来分离肺癌干细胞。在这种方法中,向无血清条件培养基中加入生长因子,能够达到促进细胞繁殖的同时保持细胞未分化状态的目的。在这类培养基中,只有肿瘤干细胞能够不断生长,因此在这个分离过程中,能够大量富集肿瘤干细胞[7]。这说明悬浮球培养的方式能够有效分离和富集肺癌干细胞,使得肺癌干细胞能够具有更强的更新和繁殖能力,已达到标记肺癌干细胞的标准。单核肿瘤干细胞与DC经过诱导剂诱导融合就可以产生特异性抗原。
聚乙二醇是最常用的诱导融合剂,其诱导细胞融合机制是作用于细胞膜,相邻2个细胞的胞膜连接部穿通,胞膜融合形成异型核细胞进而通过有丝分裂将核合二为一,产生杂交子代细胞。聚乙二醇法融合人外周血DC和人肺癌细胞株A-549或H-446所获得的杂交瘤细胞,既可内源性表达肿瘤抗原,又具DC抗原递呈能力, 有效地改善肿瘤细胞上共刺激分子的表达,诱导特异抗肿瘤细胞毒性T淋巴细胞(CTL)反应[8]。本组通过运用PKH672GL(绿色荧光)和PKH262GL(红荧光)分别标记DC和肺癌细胞A-549细胞,并采用聚乙二醇作为诱导融合剂,结果显示:应用GM-CSF和IL-4优化法进行DC制备第7天所得百分率高于其他时间(P<0.05);通过对比不同融合比例DC与人肺癌细胞A-549显示,1∶1时所取得的融合百分率高于其他比例(P<0.05)。因此在制备DC与人肺癌细胞A-549联合疫苗时应选取DC制备的第7天且选取DC与人肺癌细胞A-549为1∶1。
1 Siegel R,Ward E,Brawley O,et al.Cancer statistics,2011: the impact of eliminating socioeconomic and racial disparities on premature cancer deaths[J].CA Cancer J Clin,2011,61(4):212-236.
2 Zhang Q,Shi S,Yen Y,et al.A subpopulation of CD133(+) cancer stem-like cells characterized in human oral squamous cell carcinoma confer resistance to chemotherapy[J].Cancer Lett,2010,289(2):151-160.
3 Teng Y,Wang X,Wang Y,et al.Wnt/beta-catenin signaling regulates cancer stem cells in lung cancer A549 cells[J].Biochem Biophys Res Commun,2010,392(3):373-379.
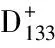
5 Yang L,Ping YF,Yu X,et al.Gastric cancer stem-like cells possess higher capability of invasion and metastasis in association with a mesenchymal transition phenotype[J].Cancer Lett,2011,310(1):46-52.
6 Xiang R,Liao D,Cheng T,et al.Downregulation of transcriiption factor SOX2in cancer stem cells suppresses growth and metastasis of lung cancer[J].Br J Cancer,2011,104(9):1410-1417.
7 Wang J,Shi G,Zhang S,et al.Clinical value of serum TPS,CEA,Pro-GRP and CYFRA21-1in patients with lung cancer[J].Chinese Journal of Lung Cancer,2010,13(5):500-505.
有效数字的确定
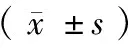
VaccineresearchonbiologicalcharacteristicsofhumandendriticcellsandA-549lungcancercellfusion
WANGJialie,MAGuoqiang.
DepartmentofRespiration,theInnerMongoliaAutonomousRegionPeople'sHospital,Hohhot010017,ChinaCorrespondingauthor:MAGuoqiang,E-mail:813812024@qq.com
ObjectiveTo explore the human dendritic cells (DC) and A-549 in human lung cancer cell fusion vaccine in the biological characteristics of the process of preparation, summarize the methods of efficient preparation of fusion vaccine.MethodsBy using of GM-CSF and IL-4 optimization method for preparing patients with lung cancer in human peripheral blood mononuclear cells for DC, DC looking for the highest rate of preparation time; while applying PKH672GL (green fluorescence) and PKH262GL (red fluorescence) and lung cancer cells were labeled DC and A-549 cells, screening the best blend ratio.ResultsApplication of GM-CSF and IL-4 optimization method for the first 7 days resulting percentage was (66.26±5.13)%, higher than at other times (P<0.05) DC preparation; By comparing different fusion the proportion of DC with human lung cancer cell A-549, showing the percentage of fusion was obtained (35.15±2.16)%, higher than the other ratios (P<0.05).ConclusionThe seventh days' percentage of DC is the best in the preparation process of DC, should be selected as optimum extraction time DC; while DC and human lung cancer cell line A-549 with a ratio of 1∶1shows the highest percentage combined vaccine.
Human dendritic cells; Human lung cancer cell A-549; Fusion; Vaccine
内蒙古自治区自然科学基金资助(No.2011MS1179)
010017 呼和浩特,内蒙古自治区人民医院呼吸科
马国强,E-mail:813812024@qq.com
10.3969 / j.issn.1671-6450.2014.03.027
2013-11-21)
