ApoA-1和α1-AT预测III期非小细胞肺癌同步 放化疗敏感性的价值
2014-08-10沈静侠王立东崔庆贵王淑颖
沈静侠,王立东,崔庆贵,王淑颖
论著·临床
ApoA-1和α1-AT预测III期非小细胞肺癌同步 放化疗敏感性的价值
沈静侠,王立东,崔庆贵,王淑颖
目的观测血清载脂蛋白A-1(ApoA-1)和α1-抗胰蛋白酶(α1-AT)水平在预测III期非小细胞肺癌(NSCLC)同步放化疗敏感性中的意义。方法2010年3月—2013年3月收治初次治疗的III期NSCLC患者60例,均行同步放化疗方案,分别于放疗前、放疗4周、放疗后检测ApoA-1和α1-AT的水平。结果NSCLC患者 ApoA-1和α1-AT 水平女性均明显高于男性(P<0.05);不同TNM分期和不同病理类型NSCLC 患者之间血清α1-AT 水平也有显著差异(P<0.05),IIIB 期较IIIA期α1-AT 水平有所降低(P<0.05),腺癌及非鳞腺癌患者的血清α1-AT 水平低于鳞癌患者(P﹤0.05)。敏感组和抵抗组的血清ApoA-1、α1-AT水平在放疗前比较差异均有统计学意义(P﹤0.05);抵抗组和敏感组放疗4周后ApoA-1水平明显降低(P<0.05),放疗结束后敏感组明显升高(P<0.05),而2组α1-AT水平放疗4周和放疗后均低于放疗前(P均<0.05)。ROC曲线提示α1-AT在325.2ng/ml时,对放化疗敏感性的预测敏感性为90.21%、特异性为89.02%,优于ApoA-1(分别为76.31%和87.25%)的预测意义。结论血清ApoA-1和α1-AT水平在预测III期非小细胞肺癌患者对于同步放化疗的敏感性方面有着重要的意义。
载脂蛋白A-1;α1-抗胰蛋白酶;同步放化疗;非小细胞肺癌
肺癌是发病率最高的恶性肿瘤之一,其病死率居于第1位。而非小细胞肺癌(non-small cell lung cancer, NSCLC)约占肺癌的80%~85%[1]。由于早期诊断率低,很多NSCLC患者发现时已经处于中晚期,错过了最佳手术时机。同步放化疗是治疗III期NSCLC患者标准方案,因个体差异,不同患者对放化疗的敏感性各不相同[2]。有研究证实载脂蛋白A-1(ApoA-1)、α1-抗胰蛋白酶(α1-AT)很可能与 NSCLC 分期、分化程度有着密切的关系[3],为此,观测ApoA-1和α1-AT与NSCLC 患者放化疗敏感性的关系,以期为NSCLC的放化疗治疗提供临床依据。
1 资料与方法
1.1 研究对象 2010年3月—2013年3月我院收治初次治疗的III期NSCLC患者(病程<1年)60例,均经纤维支气管镜或CT引导下穿刺活检确定病理类型,KPS评分70~100分。年龄31~70岁,中位数55岁。排除高血压、糖尿病等慢性基础疾病及有家族遗传病史者;无其他合并症;既往未曾接受肿瘤手术、放疗及化疗等相关治疗。所有入组患者均行同步放化疗方案,根据患者治疗的疗效标准分为敏感组和抵抗组2组。入组患者一般资料见表1。
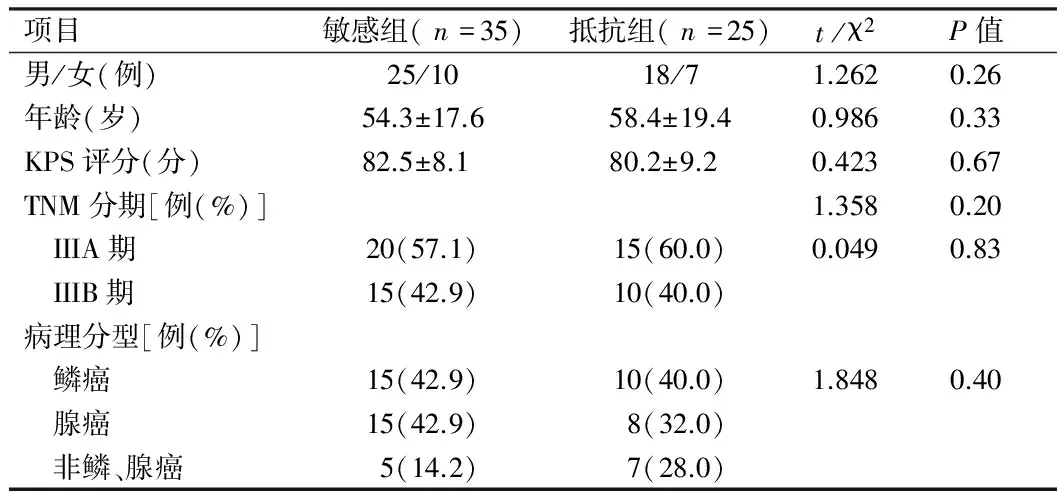
表1 患者一般临床资料比较
1.2 治疗方法 同步放化疗方案:入组患者行IMRT(调强放疗)或3D-CRT(三维适形放疗),放疗1.6~2.0Gy/次,每天1次,每周5次,总剂量60Gy。原发灶和已转移的淋巴结均予放射治疗,并予同时行化疗[化疗方案为顺铂+长春瑞滨(即NP方案)、顺铂+吉西他滨(即GP方案)或顺铂+多西他赛(即TP方案),3种方案中随机选择1种],化疗2周期,待放疗结束后再追加2个周期的化疗。总体治疗方案结束后通过CT及实体瘤RECIST标准综合判断、评估治疗效果。
1.3 观测指标 ApoA-1和α1-AT的测定通过双抗两步夹心酶联免疫吸附法测定。所有入组患者均在放疗前、放疗4周后及治疗结束时分别抽取空腹外周静脉全血 3ml检测ApoA-1和α1-AT。试验中所使用的Heraeu低温高速离心机(型号Biofugestratos)、Hevaeus恒温箱(型号 HERA cell240)、BIO-RAD 酶标仪(型号Bio-Rad 680)及EP管等试验器材均为R&D公司生产。
1.4 疗效标准 治疗结束后,根据治疗效果将患者分为:CR(完全缓解):所有病灶在治疗后均消失;PR(部分缓解):治疗后的病灶长径缩小≥30%;PD(疾病进展):治疗后病灶非但未减小,反而在原基础上出现新的病灶或原病灶长径增加≥20%;SD(稳定):病灶长径总和减小未达PR标准或增大但未达到PD标准。
肺癌KPS 评分是以百分制计算,患者根据自身临床症状、体征、生活自理能力等评分标准对自己的病情评分,可有助于临床医师治疗方案的制定。评分标准:0~100分,分值越高,表示健康状况越好。

2 结 果
2.1 基线资料ApoA-1和α1-AT水平比较 ApoA-1和α1-AT水平NSCLC患者中女性高于男性(P<0.05);IIIB期相比IIIA期α1-AT 水平有所降低(P<0.05),腺癌及非鳞、腺癌NSCLC 患者的血清α1-AT水平低于鳞癌患者(P<0.05)。见表2。
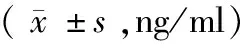
表2 基线资料中患者ApoA-1和α1-AT水平比较
2.2 组间和组内ApoA-1、α1-AT水平变化 根据患者治疗效果分为放化疗敏感组(CR组+PR组)和放化疗抵抗组(SD组+PD组),放疗前2组的血清ApoA-1、α1-AT水平比较差异均有统计学意义(P﹤0.05),敏感组放疗4周后患者的ApoA-1水平明显降低(P<0.05),放疗结束后明显升高,α1-AT水平放疗后显著高于放疗前和放疗4周后(P均<0.05);而抵抗组放疗4周后ApoA-1水平明显升高(P<0.05),放疗结束后ApoA-1与放疗前无显著差异(P>0.05),放疗4周和放疗结束后患者的α1-AT水平均低于放疗前(P均<0.05)。放疗后敏感组仅ApoA-1高于抵抗组(P<0.05)。见表3。
2.3 敏感性、特异性 放疗前ApoA-1和α1-AT水平对同步放化疗敏感性预测价值的ROC曲线显示,α1-AT在325.2ng/ml时,对放化疗敏感性的预测敏感性为90.21%、特异性为89.02%,优于ApoA-1的预测价值。见表4。
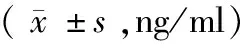
表3 2组放疗前、中、后的ApoA-1及α1-AT水平比较
注:与放疗前比较,*P﹤0.05;与放疗4周比较,#P﹤0.05;与抵抗组比较,△P﹤0.05
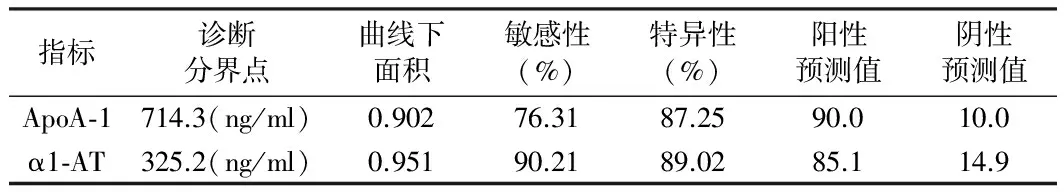
表4 ApoA-1和α1-AT水平对于同步放化疗敏感性的预测价值
3 讨 论
肿瘤组织在发生、发展、迅速生长时可特异性分泌某些蛋白释放到血液、组织液中,因此血清中某些蛋白含量可能会异常增多,这与肿瘤细胞的异常增殖程度[4]、速度或与蛋白在癌细胞中的异常表达量密切相关,比如说目前已经发现的卵巢癌的 CA125、前列腺癌的前列腺特异性抗原PSA 等。肺癌也同样如此[5],因而肺癌细胞分泌所致血清特异性蛋白含量异常对肺癌的早期筛选及治疗方案疗效的监测具有重大的意义[6]。而III期非小细胞肺癌对同步放化疗的敏感性存在着明显的个体差异,提示我们系统地研究肺癌中的特异性血清蛋白对临床治疗有着重大的意义。
已有研究证实血清 ApoA-1在恶性肿瘤患者和正常人群对照组中具有明显的表达差异[7,8]。而ApoA-1与肿瘤的关系研究也越来越多,且有较大进展[9],然而对于血清 ApoA-1水平是否受恶性肿瘤生长的影响以及其与肿瘤对放化疗敏感性的有关研究还相对较少[10]。研究证实ApoA-1能够抑制炎性因子的释放和一定程度上延缓动脉粥样硬化发展。纤维蛋白和血小板在肿瘤的生长、增殖和转移过程中均有着非常重要的影响。ApoA-1自身不能够被激活,也并不具有纤溶活性,但因为它与pLg(纤溶酶前体)有着相似的结构,所以能与pLg竞争结合位点,从而使纤维蛋白的降解受到抑制,并且可致血小板激活,进而对肿瘤细胞的生长、转移均产生一定的影响。本研究分析推测血清ApoA-1水平与肺癌存在着关联,但仍需大量研究来证实两者之间是否有明确的相关性,以及其与非小细胞肺癌临床分期、病理类型等的相关性。α1-AT主要来源在肝脏,而在肝外(如单核细胞和肺泡巨噬细胞等)合成的α1-AT有利于局部损伤组织的修复和调节。α1-AT是一种糖蛋白,还是一种血浆蛋白酶的抑制剂,其浓度与机体的感染、肿瘤、炎性反应及肝脏状态均有关系,且被证实具有抑制肿瘤细胞生长、增殖和转移的功能。因此,α1-AT很可能是肿瘤治疗中判断预后的血清学特异性标志物[11]。
本结果提示,对同步放化疗敏感组和抵抗组的血清ApoA-1、α1-AT水平在放疗前均有着显著差异。我们推测:血清蛋白ApoA-1和α1-AT水平预测III期非小细胞肺癌患者对同步放化疗的敏感性有重要意义,尤其是α1-AT,仍需更多的研究来证实。
1 Okuma Y, Yanagisawa N, Hosomi Y, et al.Concomitant chemoradiotherapy and antiretroviral therapy for HIV-infected patients with locoregionally advanced non-small cell lung cancer:benefit and tolerability of treatment in 2cases[J]. Onkologie, 2013,36(10):586-590.
2 Yan HA, Shen K, Huang XE. Clinical study on mannan peptide combined with TP regimen in treating patients with non-small cell lung cancer[J]. Asian Pac J Cancer Prev, 2013,14(8):4801-4804.
3 Karczmarski J, Rubel T, Mikula M, et al. Pre-analytical-related variability influencing serum peptide profiles demonstrated in a mass spectrometry-based search for colorectal and prostate cancer biomarkers[J]. Acta Biochimica Polonica, 2013,60(3):417-425.
4 Song XY, Zhou SJ, Xiao N, et al. Research on the relationship between serum levels of inflammatory cytokines and non-small cell lung cancer[J]. Asian Pac J Cancer Prev, 2013,14(8):4765-4768.
5 Ozdemir O, Ozdemir P, Veral A, et al. ERCC1expression does not predict survival and treatment response in advanced stage non-small cell lung cancer cases treated with platinum based chemotherapy[J]. Asian Pac J Cancer Prev, 2013,14(8):4679-4683.
6 Wang WJ, Tao Z,Gu W,et al.Variation of blood T lymphocyte subgroups in patients with non- small cell lung cancer[J]. Asian Pac J Cancer Prev, 2013,14(8):4671-4673.
7 Wu Q, Chen G, Wu WM, et al. Metabolic syndrome components and risk factors for pancreatic adenocarcinoma: a case-control study in China[J]. Digestion, 2012,86(4):294-301.
8 Tung CL, Lin ST, Chou HC, et al. Proteomics-based identification of plasma biomarkers in oral squamous cell carcinoma[J]. J Pharm Biomed Anal, 2013,75(1):7-17.
9 Ochoa MC, Fioravanti J, Rodriguez I, et al.Antitumor immunotherapeutic and toxic properties of an HDL-conjugated chimeric IL-15 fusion protein[J]. Cancer Res, 2013,73(1):139-149.
10 Qin X, Chen Q, Sun C, et al.High-throughput screening of tumor metastatic-related differential glycoprotein in hepatocellular carcinoma by iTRAQ combines lectin-related techniques[J]. Medical Oncology (Northwood, London, England), 2013,30(1):420.
11 Huang W, Ding X, Li B, et al. Serum biomarkers analyzed by LC-MS/MS as predictors for short outcome of non-small cell lung cancer patients treated with chemoradiotherapy[J]. Neoplasma, 2013,60(1):11-18.
ThevalueofexpressionofApoA-1andα1-ATinphaseIIInon-smallcelllungcancersynchronizationradiotherapysensitivity
SHENJingxia,WANGLidong,CUIQinggui,WANGShuying.
DepartmentofTumorChemotherapy,People'sHospitalofQian'ancity,Hebeiprovince,Qian'an064400,China
ObjectiveTo observe the expression of serum apolipoprotein A-1(ApoA-1) and α1antitrypsin (α1-AT) levels in predicting significance in the phase III non-small cell lung cancer (NSCLC) concurrent chemo- and radio-therapy sensitivity.MethodsFrom March 2010to March 2013, admitted to hospital and
the initial treatment of stage III NSCLC patients were 60cases, they underwent concurrent radiotherapy and chemotherapy. Before radiotherapy,after 4 weeks,after the radiation, detected the levels of ApoA-1and α1-AT.ResultsNSCLC patients' ApoA-1and α1-AT le-vels were significantly higher in women than men (P<0.05); different types of different pathological TNM stage and serum α1-AT levels between NSCLC patients also had significantly difference (P<0.05), IIIB period compared with stage IIIA α1-AT levels decreased (P<0.05), serum levels of α1-AT gland adenocarcinoma and non- squamous NSCLC patients with squamous cell carcinoma in patients below (P<0.05). Serum ApoA sensitive group and resistant group 1, α1-AT levels were statistically significant differences (P<0.05) before radiotherapy; resistance group and sensitive group after 4 weeks ApoA-1levels were significantly lower (P<0.05), after the end of radiotherapy sensitive group was significantly higher (P<0.05), while the two groups α1-AT levels after radiotherapy and after 4 weeks were lower (P<0.05) before radiotherapy. ROC curve when prompted α1-AT 325.2ng/ml, the sensitivity of chemotherapy sensitivity prediction 90.21% and specificity of 89.02%, better than the ApoA-1(76.31% and 87.25%) predicted significance.ConclusionSe-rum ApoA-1and α1-AT level in the forecast period Ⅲ NSCLC sensitive to concurrent chemoradiotherapy has an important significance.
Apolipoprotein A-1; α1-antitrypsin; Concurrent chemoradiotherapy; Non-small cell lung cancer
064400 河北省迁安市人民医院肿瘤放化疗科
10.3969 / j.issn.1671-6450.2014.03.019
2013-11-16)
