芒柄花黄素对人黑色素瘤细胞株A375凋亡的影响
2014-08-10符秀琼刘慰华张竞之刘少军刘世明
刘 彬,符秀琼,刘慰华,张竞之,刘少军,刘世明
芒柄花黄素对人黑色素瘤细胞株A375凋亡的影响
刘 彬1,符秀琼2,刘慰华1,张竞之1,刘少军1,刘世明1
(1. 广州医科大学附属第二医院心血管疾病研究所,广东 广州 510260;2. 南方医科大学中医药学院,广东 广州 510515)

目的 研究芒柄花黄素对人黑色素瘤细胞A375 凋亡的影响。方法 以人黑色素瘤细胞A375为研究对象,MTT法检测不同浓度的芒柄花黄素对A375细胞活性的影响,并用流式细胞术检测芒柄花黄素导致的细胞凋亡率;用Western blot方法检测cleaved Caspase-3、Bax、Bcl-XL的蛋白表达水平,从而初步探讨其凋亡的机制。结果 芒柄花黄素可降低A375细胞的活力并增加其凋亡率,Western blot 结果显示芒柄花素增加了A375中cleaved Caspase-3蛋白的表达,减少了抗凋亡蛋白Bcl-XL的表达,并增加促凋亡蛋白Bax表达。结论 芒柄花黄素可抑制A375细胞的活力并诱导细胞凋亡,其机制与减小Bcl-XL/ Bax 蛋白表达比例, 从而启动Caspase-3介导的凋亡途径有关。
芒柄花黄素;黑色素瘤;细胞凋亡
芒柄花黄素又名刺芒柄花素、芒柄花素,是异黄酮类化合物,存在于黄芪[1]、苦参[2]、鸡血藤[3]等多种中药中。研究表明,芒柄花黄素有一定的抗肿瘤作用,它可通过Caspase依赖的机制诱导人结肠癌细胞HCT-116凋亡[4],有抑制乳腺癌细胞增殖的作用[5],调控乳腺癌细胞周期相关因子的表达,引起细胞周期阻滞[6]。但其对黑色素瘤的作用国内外均未见报道。黑色素瘤是恶性程度极高的肿瘤之一,占皮肤肿瘤死亡病例的绝大部分。目前最有效的治疗方法是手术切除肿瘤,由于其恶性度高,对于黑色素瘤已转移或晚期不宜手术的患者,临床上仍缺乏有效化疗药物。本实验以人黑色素瘤细胞A375为模型,观察芒柄花黄素对A375细胞活性和凋亡的影响,并初步探讨其作用机制。
1 实验资料
1.1 细胞与培养 从液氮中取出人黑色素瘤细胞株A375并复苏,用含10%FBS(Gibico)的DMEM培养基(Gibico)在37 ℃ 含5% CO2的孵箱中培养,2 d传代1次,传代3次后用于实验。
1.2 主要药物及化学试剂 芒柄花黄素标准品购于成都曼思特公司,用二甲基亚砜(DMSO)溶解。3-4,5-二甲基噻唑-2-2,5-二苯基四氮唑溴盐(MTT)购自 Sigma公司,抗体均购于CST公司 ,Annexin V-FITC/PI双染细胞凋亡检测试剂盒购自凯基生物。
1.3 MTT法测定细胞活性 取对数生长期细胞,以每孔3 000个细胞的密度接种于96孔培养板,待细胞贴壁后更换不同浓度的含芒柄花黄素培养基,对照组加入含0.1% DMSO 的培养基。分别在作用24及48 h后加入MTT溶液,37 ℃ 放置4 h,移除孔内所有液体后加入DMSO将细胞中的结晶溶解,用酶标仪在570 nm 波长处检测吸光值,计算出存活细胞的比例。
1.4 流式细胞式检测细胞凋亡 加入芒柄花黄素刺激细胞48 h后,收集细胞上清,胰酶消化细胞后按凯基公司的Annexin V-FITC/PI双染细胞凋亡检测试剂盒说明书操作,用流式细胞仪检测,计算出细胞凋亡率。
1.5 Western blot 法检测凋亡相关蛋白表达 芒柄花黄素作用48 h后去培养基,预冷PBS洗细胞2次,加入200 μL RIPA裂解液,冰上裂解5 min,细胞刮刮下细胞,12 000 r/min低温离心10 min,弃沉淀。BCA法检测蛋白浓度,加入5×Lodding Buffer 95 ℃ 5 min蛋白变性,-80 ℃冻存。取15 μg蛋白样品上样,用1×Lodding Buffer补至等体积,然后进行电泳。电泳结束后,转移至PVDF膜上,5%脱脂奶粉封闭1 h,分别加入Bcl-XL(1∶1 000)、Bax (1∶1 000)、cleaved-Caspase-3(1∶11 000)、β-actin(1∶1 000)4 ℃缓慢摇动过夜,0.1%TBST洗3次,加入HRP标记的山羊抗兔IgG(1∶5 000)室温缓慢摇动1 h,0.1%TBST洗3次,ECL显影,胶片曝光。

2 结 果
2.1 芒柄花黄素对人黑色素瘤细胞A375活性的影响 经MTT法检测,芒柄花黄素在大于25 μmol/L时A375细胞的活性较对照组明显降低,并呈时间依赖性(图1)。虽然25 μmol/L、50 μmol/L、100 μmol/L药物浓度均可显著降低A375细胞活性(P均<0.05),但在25 μmol/L时药物对细胞活性的抑制效果与50 μmol/L、100 μmol/L比较没有显著性差异,因此后续实验选用药物的最高浓度为25 μmol/L。

图1 芒柄花黄素对A375细胞活力的影响
2.2 芒柄花黄素对人黑色素瘤细胞A375凋亡的影响 用流式细胞学方法对Annexin V / PI 双染的细胞进行检测。结果提示,芒柄花黄素可增加A375细胞的凋亡,25 μmol/L浓度时最明显(P<0.05)。见图2。

图2 芒柄花黄素对A375细胞凋亡的影响
2.3 芒柄花黄素对A375细胞中Caspase-3、Bcl-XL及Bax表达影响 不同浓度的芒柄花黄素刺激A375细胞48 h后,Western blot法检测发现,随着药物浓度的增加,cleaved Caspase-3表达增加,且芒柄花黄素增加A375细胞的Bax蛋白表达,并下调Bcl-XL蛋白,从而明显降低Bcl-XL/Bax的比例。见图3~5。

图3 芒柄花黄素对A375细胞中cleaved Caspase-3蛋白表达水平的影响
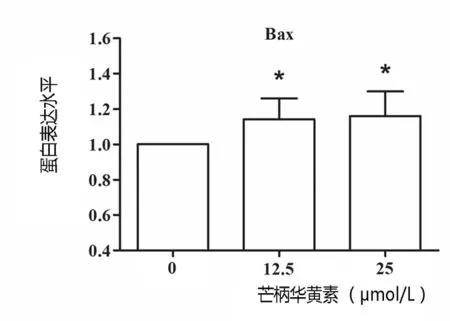
图4 芒柄花黄素对A375细胞中Bax蛋白表达水平的影响
3 讨 论
芒柄花黄素又名刺芒柄花素、芒柄花素,是一种异黄酮类化合物,具有抗肿瘤作用。既往研究表明,芒柄花黄素可诱导人结肠癌细胞、前列腺癌细胞凋亡[4,6],抑制乳腺癌细胞增殖并引起细胞周期阻滞[5,7],增加对表阿霉素耐药的子宫癌细胞凋亡[8]。然而不同肿瘤的病理机制不尽相同,芒柄花黄素的抗肿瘤效果及作用机制有待进一步探索。本研究发现芒柄花黄素对恶性度较高的人黑色素瘤细胞A375的细胞活性有抑制作用,并显著增加细胞凋亡率,因而笔者从细胞凋亡相关蛋白方面着手,并初步探讨其抗人黑色素瘤细胞的作用机制。

图5 芒柄花黄素对A375细胞中Bcl-XL蛋白表达水平的影响
Bcl-2 蛋白家族由抗凋亡蛋白 Bcl-2 和Bcl-XL, 以及促凋亡蛋白Bax, Bid, Bak等组成,通过调节线粒体外膜通透性来调节细胞凋亡通路[9]。Bcl-2 蛋白家族所介导的细胞活力或凋亡的调控,是通过改变促凋亡和抗凋亡蛋白的比例来实现,而不是取决于单个蛋白的表达水平[10]。研究表明芒柄花黄素可增加表阿霉素对子宫癌(Hela)细胞的毒性,其机制为增加ROS调节的抗多重耐药及提高Bax/ Bcl-2比例,激活Caspase-9和Caspase-3介导的细胞凋亡[8]。细胞凋亡中存在着不同的信号转导途径,Caspase-3是细胞凋亡下游的关键执行者,同时也参与了细胞凋亡的调控[11]。本研究结果显示,芒柄花黄素可明显增加Caspase-3的剪切体(cleaved Caspase-3, 17 kD)的表达,激活了Caspase-3,并增加Bax蛋白水平的表达和抑制Bcl-XL蛋白的表达,从而降低了Bcl-XL/Bax蛋白表达水平的比例。促凋亡因子Bax和抗凋亡因子Bcl-XL都属于Bcl-2的家族成员,都参与了引起细胞凋亡的线粒体通路调节,Bc-l XL/Bax蛋白水平的比例降低会促使细胞往凋亡方向发展[12]。因此,笔者认为芒柄花黄素可通过减小Bcl-XL/Bax 蛋白表达的比例, 从而启动Caspase-3途径诱导A375细胞凋亡。下一步笔者将对芒柄花黄素所引起的这些蛋白表达改变的分子机制进行深入研究。
[1] 宋肖炜,李清,叶静,等. 黄芪不同炮制品中黄酮类成分的含量比较[J]. 中国实验方剂学杂志,2013,19(9):85-88
[2] 李丹,左海军,高慧媛,等. 苦参的化学成分[J]. 沈阳药科大学学报,2004,21(5):346-348
[3] 梁永枢,安冉,刘军民,等. 不同产地鸡血藤药材中染料木素及芒柄花素的含量测定[J]. 时珍国医国药,2013,24(7):1655-1657
[4] Auyeung KK,Ko JK. Novel herbal flavonoids promote apoptosis but differentially induce cell cycle arrest in human colon cancer cell[J]. Invest New Drugs,2010,28(1):1-13
[5] 周瑞娟,陈红风,叶媚娜,等. 芒柄花素对不同亚型乳腺癌细胞增殖及细胞周期的影响[J]. 肿瘤防治研究,2012,39(9):1051-1055
[6] Ye Y,Hou R,Chen J,et al. Formononetin-induced apoptosis of human prostate cancer cells through ERK1/2 mitogen-activated protein kinase inactivation[J]. Horm Metab Res,2012,44(4):263-267
[7] Chen J,Zeng J,Xin M,et al. Formononetin induces cell cycle arrest of human breast cancer cells via IGF1/PI3K/Akt pathways in vitro and in vivo[J]. Horm Metab Res.2011,43(10):681-686
[8] Lo Y L, Wang W. Formononetin potentiates epirubicin-induced apoptosis via ROS production in HeLa cells in vitro[J]. Chem Biol Interact,2013,205(3):188-197
[9] Autret A,Martin SJ. Bcl-2 family proteins and mitochondrial fission/fusion dynamics[J]. Cell Mol Life Sci,2010,67(10):1599-1606
[10] Lindsay J,Esposti MD,Gilmore AP. Bcl-2 proteins and mitochondria-specificity in membrane targeting for death[J]. Biochim Biophys Acta,2011,1813(4):532-539
[11] Mazumder S,Plesca D,Almasan A. Caspase-3 activation is a critical determinant of genotoxic stress-induced apoptosis[J]. Methods Mol Biol,2008,414:13-21
[12] Ren X,Zhang Y,Li C,et al. Enhancement of baicalin by hexamethylene bisacetamide on the induction of apoptosis contributes to simultaneous activation of the intrinsic and extrinsic apoptotic pathways in human leukemia cells[J]. Oncol Rep,2013,30(5):2071-2080
Influence of formononetin on apoptosis in A375 Human melanoma cells
Liu Bin1, Fu Xiuqiong2, Liu Weihua1, Zhang Jingzhi1, Liu Shaojun1, Liu Shiming1
(1. Cardiovascular Disease Institute of The Second Affiliated Hospital of Guangzhou Medical University, Guangzhou 510260, Guangdong, China; 2.TCM College of Southern Medical University, Guangzhou 510515, Guangdong China)
Objective It is to observe the influence of formononetin on apoptosis in A375 human melanoma cells.Methods A375 human melanoma cells were used to be the cell model. The influence of formononetin on activity of A375 cells was measured by MTT assay, and the rate of cells viability and apoptosis in A375 cells was, detected by flow cytometry. the protein expression levels of cleaved Caspase-3, Bax and Bcl-XL were detected by Western blot assay in A375 cells with formononetin treatment. Then the mechanism of apoptosis was investigated.Results Cells viability was decreased and apoptosis rate was increased in A375 cells after treatment with formononetin. The Western blot results showed that, formononetin had enhanced the protein expression levels of cleaved Caspase-3 and pro-apoptotic protein Bax, and suppressed the expression of anti-apoptotic protein Bcl-XL. Conclusion Formononetin can reduce cells viability and induce apoptosis in A375 cells. The mechanism is related to reduce the expression of Bcl-XL/Bax protein ratio, thereby start the apoptosis pathway mediated by Caspase-3.
formononetin; melanoma;apoptosis
刘彬,男,博士后,研究方向为中西医结合基础研究。
刘世明,主任医师,E-mail:gzliushiming@126.com
国家自然科学基金资助项目(81302892);广东省自然科学基金资助项目(S2013040016226);中国博士后基金资助项目(2013M530363);广州医科大学博士启动项目(2012C50)
10.3969/j.issn.1008-8849.2014.15.003
R285.5
A
1008-8849(2014)15-1603-03
2013-11-28
