芒柄花素抑制乳腺癌细胞HIF-1α/CXCR4信号以及细胞增殖和迁移
2016-11-02葛新李林王芳郭广成李靖若谷元廷
葛新 李林 王芳 郭广成 李靖若 谷元廷
(郑州大学第一附属医院 乳腺外科 河南 郑州 450052)
芒柄花素抑制乳腺癌细胞HIF-1α/CXCR4信号以及细胞增殖和迁移
葛新李林王芳郭广成李靖若谷元廷
(郑州大学第一附属医院 乳腺外科河南 郑州450052)
目的研究芒柄花素对乳腺癌细胞行为的影响及其作用机制。方法利用不同浓度(5、10、15、20 μM)的芒柄花素处理MDA-MB-231细胞,分别处理48 h。应用qRT-PCR法检测细胞中低氧诱导因子-1α(HIF-1α)和CXC趋化因子受体4(CXCR4)mRNA的表达,利用Western blot方法检测细胞中HIF-1α和CXCR4蛋白的表达。构建pShuttle-HIF-1α过表达载体并转染MDA-MB-231细胞。利用噻唑蓝(MTT)法检测细胞增殖,利用Transwell法检测细胞体外迁移。结果相比于对照组,芒柄花素显著降低MDA-MB-231细胞中HIF-1α和CXCR4 mRNA和蛋白的表达水平(P<0.05),并且具有剂量依赖性。过表达HIF-1α提高芒柄花素处理后细胞中HIF-1α和CXCR4的表达水平(P<0.05),促进癌细胞增殖(P<0.05),并促进癌细胞体外迁移(P<0.05)。结论芒柄花素可能通过调控乳腺癌细胞中HIF-1α/CXCR4信号转导影响癌细胞增殖和迁移。
芒柄花素;乳腺癌;低氧诱导因子-1α;CXC趋化因子受体4;增殖;迁移
芒柄花素是黄芪的有效成分之一,具有抑制肿瘤细胞生长和增殖的作用[1]。研究发现,芒柄花素能够通过下调乳腺癌细胞中Akt磷酸化抑制细胞增殖[2]。低氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)和CXC趋化因子受体4(CXC chemokine receptor 4,CXCR4)在乳腺癌细胞生长、增殖、迁移、上皮间充质化中具有重要作用[3-4]。目前,芒柄花素是否能够通过调控HIF-1α和CXCR4影响乳腺癌细胞行为还不清楚。本研究通过探索芒柄花素在乳腺癌中的作用机制,从而为其在临床治疗中的应用提供理论基础。
1 材料与方法
1.1实验材料MDA-MB-231细胞购自于美国模式培养物保藏所;芒柄花素(C16H12O4,分子量268.264 08,纯度≥98%)购自上海纯优生物;胎牛血清、DMEM培养基、Trizol试剂盒、噻唑蓝(MTT)、二甲基亚砜、硝酸纤维素膜购自大连宝生物公司;DNA Engine OpticonTM2荧光检测系统和DyNAmo SYBR Green qPCR试剂盒购自美国Invitrogen公司;抗HIF-1α单抗、抗CXCR4单抗和酶标羊抗鼠二抗购自美国Sigma公司。
1.2实验方法
1.2.1细胞培养与分组处理将MDA-MB-231细胞孵育于含10%胎牛血清的DMEM培养基中,置于37 ℃恒温、5%CO2的饱和湿度培养箱中培养。将细胞随机分为对照组、芒柄花素组、空载体组、HIF-1α过表达组。芒柄花素组分别用5、10、15、20 μM芒柄花素处理48 h。空载体组和HIF-1α过表达组细胞转染pShuttle空载质粒和pShuttle-HIF-1α质粒24 h后,利用20 μM芒柄花素处理48 h。
1.2.2构建pShuttle-HIF-1α表达载体将人HIF-1α cDNA克隆至pGEMTEasy载体,测序鉴定质粒。重组质粒pGEM-HIF-1α及表达空载体pShuttle用限制性内切酶NotⅠ和ApaⅠ双酶切,将HIF-1α片段与表达载体pShuttle连接,然后将重组表达载体pShuttle-HIF-1α转染MDA-MB-231细胞,应用Western分析方法检测HIF-1α的表达。
1.2.3噻唑蓝(MTT)法检测细胞增殖收集对数生长期细胞,按每孔3×104个接种于96孔培养板。细胞达到80%融合时用于MTT实验。MTT实验检测分别在细胞培养24、48、72、96 h后进行。按实验分组情况,每孔加入20 μl MTT(5 mg/ml)后培养4 h。去掉上清,按照每孔150 μl加入二甲基亚砜(dimethyl sulfoxide,DMSO)。混匀后用酶标仪(Bio-tek Instruments/USA)测定(测量波长为570 nm)。实验重复3次,取平均数作为实验结果。
1.2.4Transwell法检测细胞迁移用胰蛋白酶消化细胞,细胞计数3×105,转移至Transwell 上层小室中,每孔铺200 μl细胞,加入200 μl无血清培养基。下层板孔中加入600 μl完全培养基,37 ℃、5%CO2培养箱中培养24 h,随后取出小室用90%乙醇固定,0.1%结晶紫溶液染色,置于显微镜下观察并拍照,随机选取4个低倍视野(100×)进行细胞计数,并计算平均值。
1.2.5qRT-PCR检测利用Trizol试剂盒提取培养细胞系总RNA,按照步骤反转录合成cDNA。查找Genbank序列设计并合成HIF-1α和CXCR4基因引物序列。HIF-1α上游引物:5’-CCT GAG CCT AAT AGT CCC-3’;下游引物:5’-GGT GGC ATT AGC AGT AGG-3’。CXCR4上游引物:5’-GGT GGT CTA TGT TGG CGT CT;下游引物: 5’-TGG AGT GTG ACA GCT TGG AG-3’。采用DNA Engine OpticonTM 2荧光检测系统和DyNAmo SYBR Green qPCR 试剂盒进行基因表达的测定。取3次重复的平均值,靶基因的相对表达量的计算由目的基因的拷贝数除以β-actin的拷贝数。
1.2.6Western blot检测提取MDA-MB-231细胞中总蛋白,取30 μg蛋白样品进行SDS-PAGE电泳。电泳结束后,将凝胶上的蛋白转移到硝酸纤维素膜上,并用1%丽春红染色检测转移效果。将膜放在10 ml封闭液中(2%脱脂奶粉)1 h;加入抗HIF-1α单抗(1∶800)和抗CXCR4单抗(1∶1 000),4 ℃过夜孵育;加入酶标羊抗鼠二抗抗体(1∶10 000),室温孵育2 h,利用化学发光法(ECL),并在暗盒曝光。用凝胶图像分析系统拍照并分析,比较蛋白条带的相对积分吸光度(OD)值。

2 结果
2.1芒柄花素抑制HIF-1α mRNA和CXCR4 mRNA表达水平相比于对照组细胞,芒柄花素组MDA-MB-231细胞中HIF-1α mRNA和CXCR4 mRNA的表达水平下调。 当芒柄花素剂量≥10 μM时,差异具有统计学意义(P<0.05),且剂量为20 μM时效果最为明显。见图1。

图1 芒柄花素处理后MDA-MB-231细胞HIF-1α和CXCR4 mRNA的表达
2.2芒柄花素抑制HIF-1α蛋白和CXCR4蛋白表达水平芒柄花素剂量≥10 μM时,MDA-MB-231细胞中HIF-1α蛋白和CXCR4蛋白的表达显著下调(P<0.05);当药物剂量为20 μM时,效果最明显。见图2和图3。
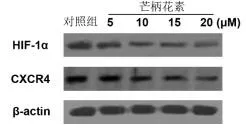
图2 芒柄花素处理后MDA-MB-231细胞HIF-1α和CXCR4蛋白的表达

图3 HIF-1α和CXCR4蛋白条带定量分析
2.3过表达HIF-1α拮抗芒柄花素对CXCR4蛋白的影响与对照组比较,20 μM芒柄花素显著抑制细胞中HIF-1α蛋白和CXCR4蛋白的表达(P<0.05)。与空载体+芒柄花素组比较,HIF-1α过表达+芒柄花素组中HIF-1α蛋白和CXCR4蛋白明显升高,差异有统计学意义(P<0.05)。见图4和图5。
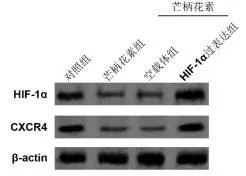
图4 过表达HIF-1α后MDA-MB-231细胞HIF-1α和CXCR4蛋白的表达

图5 HIF-1α和CXCR4蛋白条带定量分析
2.4过表达HIF-1α拮抗芒柄花素对细胞增殖的影响相比于对照组细胞,芒柄花素处理后的细胞增殖速率显著降低(P<0.05)。转染pShuttle-HIF-1α后,MDA-MB-231细胞增殖速率明显上升(P<0.05)。见图6。

图6 MTT法检测MDA-MB-231细胞增殖
2.5过表达HIF-1α拮抗芒柄花素对细胞迁移的影响芒柄花素处理后的细胞迁移数目相比于对照组显著降低(P<0.05)。转染pShuttle-HIF-1α后,细胞迁移数目显著增加(P<0.05)。见图7和图8。
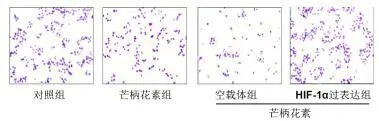
图7 Transwell法检测MDA-MB-231细胞迁移

图8 MDA-MB-231细胞迁移数目分析
3 讨论
HIF-1α/CXCR4信号异常活化被证明与多种恶性肿瘤的发生有关,其中包括乳腺癌[5-6]。芒柄花素的抑癌作用也在多个研究中得到报道[7]。Wu等[8]发现芒柄花素可抑制内皮细胞增殖、迁移、微血管形成,并在体内抑制乳腺癌进展相关的新血管形成。本研究利用不同剂量(5、10、15、20 μM)的芒柄花素体外处理乳腺癌细胞系MDA-MB-231,随后检测细胞中HIF-1α和CXCR4的mRNA和蛋白水平的变化。结果发现芒柄花素能够显著抑制HIF-1α和CXCR4的表达,并且具有剂量依赖性,说明芒柄花素可能通过调控HIF-1α和CXCR4的表达影响乳腺癌疾病进展。
本研究构建了pShuttle-HIF-1α过表达载体,并在体外转染pShuttle-HIF-1α及其空载体对照。结果发现,过表达HIF-1α可以显著上调乳腺癌细胞中HIF-1α蛋白和CXCR4蛋白的表达水平。随后,本研究发现芒柄花素可抑制细胞增殖,而过表达HIF-1α则可以拮抗芒柄花素的作用,促进细胞增殖。同时,本研究也检测了芒柄花素对癌细胞迁移的影响,结果显示芒柄花素可抑制癌细胞的体外迁移,而过表达HIF-1α则可以促进细胞迁移,拮抗芒柄花素的作用。
综上所述,芒柄花素能够抑制人乳腺癌细胞中HIF-1α和CXCR4的表达,过表达HIF-1α可抵消芒柄花素对CXCR4的表达调控以及对癌细胞增殖和迁移的抑制作用。因此,HIF-1α可能是芒柄花素的重要调控靶基因,进而影响癌细胞的增殖和迁移能力。
[1]Zhou R, Xu L, Ye M, et al. Formononetin inhibits migration and invasion of MDA-MB-231 and 4T1 breast cancer cells by suppressing MMP-2 and MMP-9 through PI3K/AKT signaling pathways[J]. Horm Metab Res, 2014, 46(11): 753-760.
[2]邓樱, 陈红风. 黄芪注射液及其有效成分对乳腺癌细胞增殖和Akt磷酸化的影响[J]. 中西医结合学报, 2009, 7(12): 1174-1180.
[3]Wang W, He Y F, Sun Q K, et al. Hypoxia-inducible factor 1α in breast cancer prognosis[J]. Clin Chim Acta, 2014, 428: 32-37.
[4]Xu T P, Shen H, Liu L X, et al. The impact of chemokine receptor CXCR4 on breast cancer prognosis: a meta-analysis[J]. Cancer Epidemiol, 2013, 37(5): 725-731.
[5]Andreou K, Rajendran R, Krstic-Demonacos M, et al. Regulation of CXCR4 gene expression in breast cancer cells under diverse stress conditions[J]. Int J Oncol, 2012, 41(6): 2253-2259.
[6]Guan G, Zhang Y, Lu Y, et al. The HIF-1alpha/CXCR4 pathway supports hypoxia-induced metastasis of human osteosarcoma cells[J]. Cancer Lett, 2015, 357(1): 254-264.
[7]周瑞娟, 陈红风, 叶媚娜, 等. 芒柄花素对不同亚型乳腺癌细胞增殖及细胞周期的影响[J]. 肿瘤防治研究, 2012, 39(9): 1051-1055.
[8]Wu X Y, Xu H, Wu Z F, et al. Formononetin, a novel FGFR2 inhibitor, potently inhibits angiogenesis and tumor growth in preclinical models[J]. Oncotarget, 2015, 6(42): 44563-44578.
Formononetin regresses HIF-1α/CXCR4 signaling and cell proliferation and migration in breast cancer cells
Ge Xin, Li Lin, Wang Fang, Guo Guangcheng, Li Jingruo, Gu Yuanting
(DepartmentofBreastSurgery,theFirstAffiliatedHospitalofZhengzhouUniversity,Zhengzhou450052,China)
ObjectiveTo investigate the effect of formononetin on breast cancer cell behavior as well as its mechanism. MethodsMDA-MB-231 cells were exposed to different doses (5, 10, 15, 20 μM) of formononetin for 48 h respectively. The expression of hypoxia-inducible factor-1α (HIF-1α) mRNA and CXC chemokine receptor 4 (CXCR4) mRNA were analyzed by qRT-PCR. The expression of HIF-1α and CXCR4 protein were analyzed by Western blot method. Furthermore, pShuttle-HIF-1α overexpression vector was constructed and transfected into MDA-MB-231 cells. Cell proliferation was determined by MTT assay. Cell migration was evaluated by Transwell assay. ResultsCompared with the control, exposure of formononetin significantly decreased both mRNA and protein expression of HIF-1α and CXCR4 (P<0.05) in a dose dependent way. Overexpression of HIF-1α raised HIF-1α and CXCR4 expression in cancer cells after formononetin treatment (P<0.05), promoting cell proliferation (P<0.05) and enhancing cell migration (P<0.05). ConclusionFormononetin might affect breast cancer cell proliferation and migration through modulation of HIF-1α/CXCR4 signaling transduction.
formononetin; breast cancer; hypoxia-inducible factor-1α; CXC chemokine receptor 4; proliferation; migration
谷元廷,E-mail:zzyuantinggu@126.com。
R 737.9doi: 10.3969/j.issn.1004-437X.2016.09.003
2016-03-04)
