程序化镇静用于神经外科手术患者的临床效果
2014-08-10吴灵潝夏文芳邹捍东
吴灵潝,冯 敏,夏文芳,邹捍东
(1. 武汉大学人民医院,湖北 武汉 430060;2. 湖北省利川市中医院,湖北 利川 445400)
麻 醉
程序化镇静用于神经外科手术患者的临床效果
吴灵潝1,冯 敏2,夏文芳1,邹捍东1
(1. 武汉大学人民医院,湖北 武汉 430060;2. 湖北省利川市中医院,湖北 利川 445400)
目的 比较观察右美托咪定和舒芬太尼程序化镇静应用于神经外科手术患者术后镇痛的效果及不良反应。方法 选择择期开颅手术患者40例,随机分为右美托咪定组(D组)和舒芬太尼组(S组),每组20例,D组患者手术后接静脉输注泵(右美托咪定200 μg用生理盐水稀释至50 mL),S组患者术后接静脉输注泵(舒芬太尼100 μg用生理盐水稀释至50 mL),根据Ramsay镇静评分调整泵速,使患者Ramsay评分在2~3分。观察患者术后苏醒情况,并记录术前(t0)、拔管后3 h(t1)、6 h(t2)、12 h(t3)及24 h(t4)的Ramsay镇静评分、SAS镇静及躁动评分、VAS疼痛评分,并观察记录以上时点的HR、MAP和不良反应。结果 2组患者术后苏醒时间、拔管时间、拔管后话语时间均无显著性差异(P均>0.05);2组患者t0—t4的Ramsay镇静评分、SAS镇静及躁动评分、VAS疼痛评分均无显著性差异(P均>0.05);2组患者t0—t4的HR、MAP无显著性差异(P均>0.05);D组和S组各有3例(15%)患者出现呕心/呕吐。结论 择期神经外科手术患者术后使用右美托咪定和舒芬太尼程序化镇静效果确切,不良反应少。
神经外科手术;术后镇痛;右美托咪定;舒芬太尼
疼痛对神经外科术后患者可造成不利影响,中重度的疼痛可使患者应激反应增强、血压升高,甚至颅内压升高导致严重后果。程序化镇静就是有计划有目标地镇静,根据镇静评分实时调整镇静药物剂量,程序化镇静可实现用最小剂量的药达到理想的镇静目标,最大限度地降低不良反应发生率。本研究观察比较了右美托咪定和舒芬太尼程序化镇静对神经外科手术患者术后镇静镇痛评分的影响,旨在评价这2种程序化镇静方法在神经外科手术患者中应用的价值,现将结果报道如下。
1 临床资料
1.1 一般资料 选择2012年8—12月我院择期开颅手术患者40例,术前格拉斯高评分>12分,年龄36~60岁,其中脑膜瘤17例,前交通动脉瘤8例,后交通动脉瘤7例,三叉神经减压3例,垂体瘤5例。随机分为右美托咪定组(D组)和舒芬太尼组(S组),每组20例。有意识障碍病史或连续服用镇静镇痛药3周以上者除外,术中低血压(降低40%)时间超过15 min者除外,再次手术者除外。2组患者年龄、性别、体质、手术时间、芬太尼用量比较均无显著性差异(P均>0.05 )。见表1。

表1 2组患者一般资料比较±s)
1.2 麻醉及镇痛方法 患者术前按神经外科常规禁饮食,入手术室前30 min肌注苯巴比妥钠注射液100 mg,阿托品注射液0.5 mg。2组患者顺序静脉注射咪达唑仑0.05 mg/kg,靶控输注丙泊酚,血浆靶浓度设为3~3.5 mg/L,维库溴铵0.15 mg/kg,芬太尼5~8 μg/kg。待药效充分发挥作用后插入合适大小的气管导管,插管后接麻醉机控制呼吸,潮气量为8~10 mL/kg,呼吸频率12~14次/min,维持呼吸末二氧化碳分压(PETCO2)于35~45 mmHg(1 mmHg=0.133 kPa)。持续静脉泵注丙泊酚、芬太尼和维库溴铵,术中麻醉深度维持脑电双频指数(BIS)在40~55之间。麻醉手术期间持续监测心电图、有创动脉压、中心静脉压、脉搏氧饱和度。术毕送麻醉恢复室,自主呼吸开始恢复时,以0.04 mg/kg新斯的明、0.02 mg/kg阿托品拮抗残余肌松作用。当患者的潮气量>8 mL/kg并出现咳嗽反射或苏醒时,拔除气管插管。
1.3 程序化镇静 本组患者的镇静目标为浅镇静水平,即Ramsay评分2~3分,D组患者手术后接静脉输注泵(右美托咪定200 μg用生理盐水稀释至50 mL),S组患者术后接静脉输注泵(舒芬太尼100 μg用生理盐水稀释至50 mL),根据Ramsay镇静评分调整泵速,使患者Ramsay评分2~3分。镇静初期评分的间隔时间为5 min,10 min,30 min,然后每隔60 min评分1次。日间唤醒时间定为8:00,停止输注镇静泵,待患者清醒并正确回答3~4个简单问题,然后以0.5倍的剂量开始直到Ramsay评分在2~3分。镇静期间严密监护患者呼吸循环的变化,并观察不良反应。
1.4 观察指标 观察患者术后苏醒情况,并记录术前(t0)、拔管后3 h(t1)、6 h(t2)、12 h(t3)及24 h(t4)的镇静评分RSS、镇静及躁动评分SAS、疼痛评分VAS,并观察记录以上时点的HR、MAP和不良反应。苏醒时间:停麻醉药至患者能唤醒睁眼的时间。拔管时间:停用麻醉药至拔除气管导管的时间。话语时间:停用麻醉药至患者能准确回答简单问题(自己姓名、年龄等)的时间。RSS镇静评分标准:1分为焦虑和/或激动不安;2分为平静合作,具有定向力;3分为仅对指令有反应;4分为开始入睡,对呼唤反应敏捷;5分为对呼唤反应迟钝;6分为对刺激无反应。SAS评分标准:1分为无反应;2分为仅对恶性刺激有反应;3分为对触摸、叫姓名有反应;4分为安静、配合;5分为烦躁但能配合;6分为躁动;7分为危险躁动。VAS评分标准:0为无痛;10为剧痛;患者根据疼痛的程度指定一个0~10之间的数值。

2 结 果
2.1 2组患者术后苏醒时间、拔管时间、拔管后话语时间比较 2组苏醒时间话语时间比较均无显著性差异(P均>0.05),见表2。
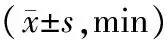
表2 2组患者苏醒情况
2.2 2组患者镇静及疼痛情况比较 2组患者t0—t4的RSS、SAS、VAS均无显著性差异(P均>0.05),见表3。2组患者t0—t4的HR、MAP无显著性差异(P均>0.05),见表4。D组和S组各有3例(15%)患者出现呕心/呕吐。

表3 2组患者镇静评分和疼痛评分比较±s,分)
3 讨 论
文献报道,超过半数的神经外科术后患者主诉有不同程度的疼痛,开颅术后,部分患者因为手术创伤应激和疼痛,可导致脑血流量增多,脑氧耗量增加,甚至颅内压升高,增加颅内出血和脑水肿的几率[1-2]。尤其是对血压控制要求比较高的血管瘤患者,术后疼痛可触发机体交感神经系统、肾上腺皮质-垂体-丘脑反射,引起神经内分泌功能紊乱,机体呈现高代谢状态和自主神经功能亢进使心率增快,心脏做功增加;还可使凝血和纤溶系统功能紊乱,出现高凝状态,血栓形成[3]。因此,对神经外科术后的患者,有必要进行有效的镇静治疗,以抑制应激反应、降低氧耗、防止颅内压升高, 减少并发症的发生[4]。
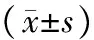
表4 2组患者t0—t4的HR、MAP比较
开颅术后患者需要常规监护神志的变化,因此镇静的“度”尤为重要。患者若镇静过深,则可影响对神志的观察。程序化镇静的实施需要医生和护士的紧密合作,首先根据患者制定适宜的镇静目标,选用合适的药物、给药途径和方法,然后在规定时间点根据镇静评分来调整方案,随后还要不断观察、评分、再调节,直到达到满意的镇静目标。程序化镇静是最安全的镇静方法。舒芬太尼是μ阿片受体高选择性激动剂,与μ1受体结合后较芬太尼具有更高的选择性,因此舒芬太尼的镇痛效应较芬太尼强而呼吸抑制效应则较芬太尼弱。与芬太尼、吗啡相比,舒芬太尼的血流动力学更稳定,安全范围更大。舒芬太尼的上述药理学特性使其成为用于神经外科患者术后镇痛的理想药物之一。右美托咪定是一种新型高选择性α2肾上腺素能受体激动剂,右美托咪定的镇静效应由激动蓝斑核内的α2肾上腺能受体亚型而产生,抑制去甲肾上腺素的释放,降低交感神经活性,产生剂量依赖性的镇静、催眠和抗焦虑作用,右美托咪定镇静近似自然睡眠,适合应用于“清醒镇静镇痛”[5-7]。快速静注右美托咪定可能造成低血压和心动过缓,有研究证实:在规定剂量范围内,右美托咪定所引起的血压降低和心率减慢多在可接受范围,不会影响安全,无需干预[8-9]。本研究中使用静脉持续输注舒芬太尼和实现程序化镇静,考虑到全身麻醉剂的部分残余作用,初始镇静从小剂量开始,舒芬太尼的初始输注速度为2 mL/h(4 μg/h),右美托咪定的初始速度为5 mL/h(20 μg/h),所以本研究中患者均未出现明显的低血压和心动过缓,但其安全性仍需更大样本和更宽剂量范围的研究来证实。
Ramsay评分可操作性强,与其他评分系统的一致性好。本组患者程序化镇静目标设定为Ramsay评分2~3分,处于此水平的术后患者感觉舒适,平静合作,对指令有反应,治疗依从性好。因为Ramsay评分无躁动状态的评价,所以笔者用Riker SAS评分来评估镇静的效果,同时进行VAS疼痛评分。2组患者术后24 h内的SAS镇静评分在3~4分之间,VAS疼痛评分在2~3分之间,心率和血压无明显变化。表明右美托咪定和舒芬太尼程序化镇静用于神经外科手术患者, 其镇静、镇痛效果相当,安全性可靠, 不良反应很少。
[1] Bruder N,Ravussin P. Cerebral and systemic changes during neumsurgieal recovery[J]. Ann Fr Anesth Reanim,2004,23(4):410-416
[2] Basali A,Mascha EJ,Kalfas I,et al. Relation between perioperative hypertension and intracranial hemorrhage after craniotomy[J]. Anestheiology,2000,93(1):48-54
[3] Ellamushi HE,Grieve JP,Jager HR,et al. Risk factors for the formation of multiple intracranial aneurysms[J]. J Neurosurg,2001,94(5):728-732
[4] 安友仲,邱海波,黄青青,等. 中国重症加强治疗病房患者镇静和镇痛治疗指导意见[J]. 中华外科杂志,2006,44(17):1158-1166
[5] Venn RM,Grounds RM. Comparison between dexmedetomidine and propofol sedation in the intensive care unit: patient and clinician perceptions[J]. Br J Anaesth,2001,87(5):684-690
[6] Yildiz M,Tavlan A,Tuncer S,et al. Effect of dexme-detomidine on haemodynamics responses to laryngoscopy and intubation: perioperative haemodynamics and nesthetic requirements[J]. Drugs RD,2006,7(1):43-52
[7] 栾翰林,何洹,施冲,等. 右美托咪啶对幕上病灶切除术后患者镇静作用的临床效果观察[J/CD]. 中华临床医师杂志:电子版,2012,6(13):3573-3575
[8] Hoy SM,Keating GM. Dexmedetomidine: a review of its use for sedation in mechanically ventilated patients in an intensive care setting and for procedural sedation[J]. Drugs,2011,71(11):1481-1501
[9] Cooper L,Candiotti K,Gallagher C,et al. A randomized,controlled trial on dexmedetomidine for providing adequate sedation and hemodynamic control for awake, diagnostic transesophageal echocardiography[J]. J Cardiothorac Vasc Anesth,2011,25(2):233-237
10.3969/j.issn.1008-8849.2014.02.035
R614.2
B
1008-8849(2014)02-0191-03
2013-04-05
