尿微量蛋白检测在窒息新生儿急性肾脏损伤中的临床意义
2014-08-10窦振云韩良荣丁素芳潘兆军
窦振云,韩良荣,丁素芳,潘兆军
(江苏省淮安市妇幼保健院,江苏 淮安 223002)
尿微量蛋白检测在窒息新生儿急性肾脏损伤中的临床意义
窦振云,韩良荣,丁素芳,潘兆军
(江苏省淮安市妇幼保健院,江苏 淮安 223002)

目的 探讨尿微量蛋白检测在窒息新生儿肾脏损害早期诊断中的意义。方法选取窒息组新生儿65例,其中轻度窒息组31例,重度窒息组34例,选择同期33例健康新生儿为对照组,均于生后24 h内留取新鲜尿液检测尿α1-微球蛋白(A1M)、白蛋白(MA)、免疫球蛋白G(IgG)及转铁蛋白(TRF)水平;同期采静脉血检测血BUN、Cr。结果 与对照组相比,轻度窒息组Cr升高、A1M阳性率增高(P均<0.05);与对照组相比,重度窒息组BUN、Cr、A1M、MA、IgG、TRF水平均明显升高(P均<0.05),Cr、A1M、MA、IgG、TRF阳性率亦明显升高(P均<0.05);与轻度窒息组相比,重度窒息组Cr、A1M、MA、IgG、TRF阳性率均明显升高(P均<0.05)。单项指标阳性率除尿MA(7.14%)外,A1M(50.00%)、IgG(26.53%)、TRF(21.43%)均明显高于血BUN(7.14%)及Cr(6.12%)(P均<0.01)。结论 窒息新生儿尿微量蛋白水平明显升高,该指标阳性率明显高于BUN及Cr,可以作为新生儿窒息肾脏损害早期的判断指标。
新生儿;窒息;肾脏损害;尿微量蛋白
新生儿窒息是新生儿时期常见病,在我国的发生率为3.78%~9.85%,占新生儿科住院患者的17.1%,是新生儿期死亡和儿童期致残的的主要原因之一[1-4]。新生儿窒息对机体的损伤主要是缺氧缺血引起肾脏、中枢神经、心血管、胃肠道等多脏器形态和功能的改变,以肾脏受损率最高,为22%~57%[5-8]。临床常以血清 BUN、Cr作为肾功能检查来判断肾功能有无障碍, 但是BUN、Cr仅反映肾小球功能, 且不能反映早期肾功能轻微损伤[9]。近年来研究显示,尿微量蛋白的测定可帮助评估肾脏的损害程度,能早期发现亚临床肾脏疾病[10-13]。本研究通过检测新生儿尿微量蛋白α1-微球蛋白(A1M)、白蛋白(MA)、免疫球蛋白G(IgG)、转铁蛋白(TRF)的变化,探讨尿微量蛋白在窒息新生儿急性肾脏损害(AKI)中的临床意义。
1 临床资料
1.1 一般资料 选择我院新生儿科病房2009年10月—2010年12月入住的新生儿窒息者共65例,男35例,女30例。根据儿科学窒息的诊断标准[14],将窒息组分为轻度窒息组31例,重度窒息组34例。选择我院同期出生的正常足月新生儿33例为对照组,男15例,女18例,均无宫内窘迫、 产时窒息史及其他异常体征。2组新生儿的胎龄、年龄、性别、体质量比较均无显著性差异。
1.2 方法
1.2.1 尿微量蛋白的检测 全部病例用集尿袋收集生后24 h内尿液2 mL,送检。采用散射比浊法,试剂盒由西门子医学诊断产品(上海)有限公司提供。尿TRF>2.0 mg/L;A1M>12.5 mg/L;IgG>8.0 mg/L;MA>25 mg/L为阳性。
1.2.2 血BUN、Cr检测 生后24 h留取静脉血液送检BUN、Cr。血BUN>7.14 mmol/L或血Cr>132.6 μmol/L为阳性[15-16]。
2 结 果
与对照组相比,轻度窒息组血Cr、A1M均显著升高(P<0.05);与对照组相比,重度窒息组BUN、Cr、A1M、MA、IgG、TRF均升高(P均<0.05);与轻度窒息组相比,重度窒息组Cr、A1M、MA、IgG、TRF水平均明显升高(P<0.05)。见表1。综合单项指标阳性率:除尿MA(7.14%)外,A1M(50.00%)、IgG(26.53%)、TRF(21.43%)均明显高于血BUN(7.14%)、Cr(6.12%),差异有统计学意义(P<0.01),综合单项指标阳性率=单项所有阳性数/(轻度窒息组数+重度窒息组数+对照组数)。见表2。
3 讨 论
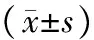
表1 2组各项指标比较
注:①与对照组比较,P<0.05;②与重度窒息组比较,P<0.05。
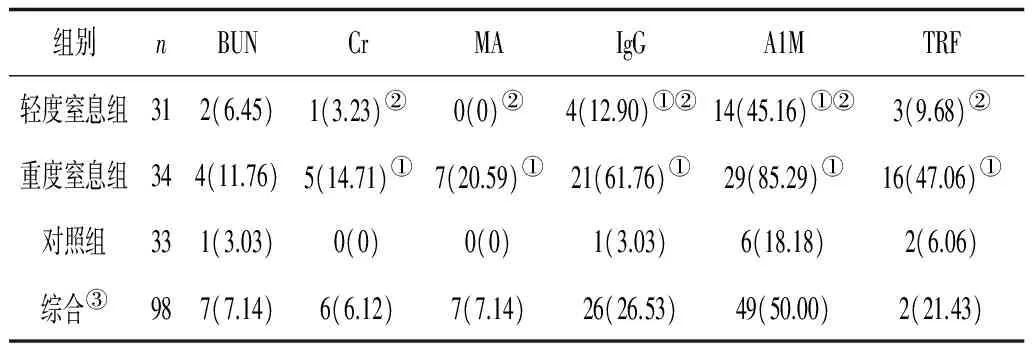
表2 2组血BUN、Cr及尿MA、IgG、A1M、TRF阳性率比较 例(%)
注:①与对照组比较,P<0.05;②与重度窒息组比较,P<0.05;③综合血BUN、Cr、IgG、A1M、TRF异常率比较,2=90.81,P<0.01。
窒息新生儿由于机体缺氧导致重要脏器供血不足,从而引起组织缺血。窒息时肾血管收缩,肾血流急剧减少,引起肾组织缺氧缺血,使肾小管上皮细胞肿胀、变性,甚至坏死、脱落,肾髓质出血和肾小球滤过率(GFR)下降, 而近曲肾小管细胞对缺氧特别敏感,肾小管重吸收功能减弱及间质性改变,从而产生AKI甚至急性肾功能衰竭[17]。新生儿窒息后AKI的本质是肾脏缺氧缺血性损伤,程度与窒息严重程度相关。目前AKI的实验室诊断多以BUN、Cr作为主要指标,但GFR降至正常50%以下时BUN才开始升高,GFR降至正常1/3时Cr才会迅速增高,不能早期反映AKI。另外出生几天内更多的是对母亲肾功能的反应[18],因此这些项目难以发现早期AKI[9,19]。
尿微量蛋白是指尿中某些蛋白的排泄呈亚临床升高,用常规定性或定量方法难以测出的一组蛋白[20]。尿微量蛋白的检测作为判断肾小球、肾小管功能损害的一种主要手段,主要包括检测MA、IgG、A1M、TRF等。MA相对分子质量69×103,是一种带有负电荷的大分子蛋白,正常状态下MA很难通过肾小球基底膜,只有极少量的白蛋白可以通过尿液排除到体外。任何能够引起肾小球基底膜通透性增高的病变,均可导致MA的排出,使得MA在尿中的排泄增加。尿MA可作为早期肾小球受损的标志蛋白[21]。TRF为单链糖蛋白,相对分子质量为76.5×103,主要由肝细胞合成,易通过带阴电荷的肾小球滤过膜,尿转铁蛋白反映的是肾小球损伤[22],特别是在肾脏早期损伤时,尿中转铁蛋白的排出即会增加。IgG属高分子蛋白,相对分子量为160×103,趋向电中性,肾小球滤过膜孔径的筛网选择性屏障对IgG起阻留作用,在正常情况下,不被肾小球滤膜透过,滤过膜受损和孔径变大时,IgG滤出增多,尿中IgG含量升高。IgG是肾小球滤过膜筛网选择性屏障损伤的标志。A1M相对分子质量(26~33)×103,游离A1M占30%~60%,能自由通过肾小球,被肾小管吸收和代谢,在肾小管损害早期,肾小管对A1M的重吸收减少,导致尿中浓度升高。尿A1M升高可作为肾小管重吸收功能受损的标志[21,23]。
本组资料显示,窒息组新生儿尿A1M比对照组明显升高,重度窒息组比轻度窒息组明显升高。窒息组尿A1M较MA、IgG、TRF升高明显,说明窒息后导致肾损伤的部位首先是肾小管,尿A1M可作为肾损害(主要是近曲肾小管功能损害)时的敏感指标。轻度窒息组新生儿MA、TRF、IgG值与对照组比较均无显著性差异(P>0.05),而重度窒息组新生儿尿MA、TRF、IgG值与对照组及轻度窒息组比较有显著升高(P<0.01),说明轻度窒息后肾小球滤过膜功能受损不明显,随着缺氧缺血的加重,肾小球滤过膜功能受损。随着窒息程度的加重。血BUN、Cr逐渐升高,但BUN的异常率比较没有差异,而Cr异常率也只是在重度窒息组升高。因此,BUN、Cr作为新生儿AKI的诊断指标有一定的局限性,容易造成漏诊[18]。本研究认为尿微量蛋白系列的检测是反映窒息新生儿AKI的指标,可以早期反映新生儿窒息后肾功能损害。
本组资料中,对照组尿A1M、IgG、TRF也有一定的阳性率,可能与本研究参考成人诊断标准有关,目前尚无有关儿童特别是新生儿的确实、完整报道。在以后的研究中有必要多中心、大样本确定儿童和新生儿的尿微量蛋白正常值。
反映新生儿窒息后肾功能损害的指标较多,临床上以血BUN、Cr来判定新生儿缺氧性AKI存在一定的缺陷和滞后性,而尿微量蛋白的检测标本采集容易,能做动态跟踪检测,可及早发现肾脏受损,结合临床综合分析,提高肾损伤的早期诊断敏感性,及时了解窒息新生儿肾功能变化,指导临床治疗。
[1] 中华医学会儿科学分会新生儿学组. 中国住院新生儿流行病学调查[J]. 中国当代儿科杂志,2009,11(1):15-20
[2] 石晓东,杨军,李秋平,等. 广东省新生儿窒息发病率调查及危险因素分析[J]. 南方医科大学学报,2007,27(11):1688-1691
[3] 王庆红,杨于嘉,魏克伦,等. 2005年中南地区产科新生儿流行病学调查[J]. 中国当代儿科杂志,2011,13(6):458-461
[4] Ma L,Liu CQ,Zheng XL,et al. A 12-month prospective survey of perinatal outcome of liveborn neonates in Julu County[J]. China Chin Med J,2010,123(20):2781-2785
[5] Kaur S,Jain S,Saha A,et al. Evaluation of glomerular and tubular renal function in neonates with birth asphyxia[J]. Ann Trop Paediatr, 2011,31(2):129-134
[6] 庞学问,廖锋,张运江. 新生儿窒息致多脏器损伤临床分析[J]. 中国新生儿科杂志,2008,23(3):177-178
[7] 常树宝,孙秀丽,马晓花,等. 新生儿窒息并发多器官损伤202例临床分析[J]. 山东医药,2010,50(13):69-70
[8] Mohd Ashraf,Ahmed N,Chowdhary J,et al. Acute renal failure: Nephrosonographic findings in asphyxiated neonates[J]. Saudi J Kidney Dis Transpl,2011,22(6):1187-1192
[9] Drukker A,Guignard JP. Renal aspects of the term and preterm infant:a selective update[J]. Curr Opin Pediatr,2002,14:175-182
[10] Lisowska-Myjak B. Serum and urinary biomarkers of acute kidney injury[J]. Blood Purif,2010,29(4):357-365
[11] Khosla N,Sarafidis PA,Bakris GL. Microalbuminuria[J]. Clin Lab Med,2006,26(3):635-653
[12] Ware LB,Johnson AC,Zager RA.Renal cortical albumin gene induction and urinary albumin excretion in response to acute kidney injury[J]. Am J Physiol Renal Physiol,2011,300(3):628-638
[13] Soler-García AA,Johnson D,Hathout Y,et al. Iron-related proteins: candidate urine biomarkers in childhood HIV-associated renal diseases[J]. Clin J Am Soc Nephrol,2009,4(4):763-771
[14] 沈晓明,王卫平. 儿科学[M]. 7版. 北京:人民卫生出版社,2008:97-102
[15] Aggarwal A,Kumar P,Chowdhary G,et al. Evaluation of renal functions in asphyxiated newborns[J]. J Trop Pediatr,2005,51(5):295-299
[16] Mathur NB,Agarwal HS,Maria A. Acute renal failure in neonatal sepsis[J]. Indian J Pediatr,2006,73(6):499-502
[17] Karlowicz MG,Adelman RD. Nonoliguric and oliguric acute renal failure in as phyxiated term neonates[J]. Pediatr Nephrol,1995,9(6):718-722
[18] 刘晓宇,张欣,王颖,等. 重度窒息新生儿发生急性肾损伤回顾性分析[J]. 中国循证儿科杂志,2011,6(4):275-279
[19] Askenazi DJ,Ambalavanan N,Goldstein SL. Acute kidney injury in critically ill newborns:what do we know? What do we need to learn?[J]. Pediatr Nephrol,2009,24(2):265-274
[20] 陈庆海. 尿微量蛋白检测及临床应用的研究进展[J]. 国外医学临床生物化学与检验学分册,2002,23(3):178-180
[21] Devarajan P,Krawczeski CD,Nguyen MT,et al. Proteomic identification of early biomarkers of acute kidney injury after cardiac surgery in children[J]. Am J Kidney Dis,2010,56(4):632-642
[22] 方晓燕,徐虹,冯志明,等. 新生儿肾功能损害早期指标分析[J]. 临床儿科杂志,2008,26(2):132-136
[23] Penders J,Delanghe JR. Alpha 1-microglobulin:clinical laboratory aspects and applications[J]. Clin Chim Acta,2004,346(2):107-118
Clinical significance of urinary microprotein in acute kidney injury of neonates with asphyxia
Dou Zhenyun, Han Liangrong, Ding Sufang, Pan Zhaojun
(Maternal and Child Health Hospital of Huai’an, Huai’an 223002, Jiangsu, China)
Objective It is to explore the significance of urinary microprotein in the early diagnosis of kidney injury in asphyxial neonates. Methods 65 neonates with asphyxia(31 mild cases and 34 severe cases) and 33 healthy newborns were chosen as asphyxia group and control group respectively.The fresh urine specimens were collected within 24 hours after birth and used to test the urinary microprotein:urine α1-microglobulin(A1M), microalbuminuria(MA), immunoglobulin G(IgG),transferrin(TRF);and the venous blood was sampled to test serum BUN and Cr at the same time. Results As compared with control group, in mild asphyxia group the positive rates of serum Cr level and urinary A1M positive rate increased, the differences were statistical significant(P<0.05); As compared with control group, in severe asphyxia group the positive rates of serum BUN, Cr, urinary A1M, MA, IgG, TRF level and serum Cr, urinary A1M, MA, IgG, TRF increased, the differences were statistical significant(P<0.05); As compared with mild asphyxia group, in severe asphyxia group the positive rates of serum Cr, urinary A1M, MA, IgG, TRF positive rate increased, the differences were statistical significant(P<0.05). Except positive rate of MA was 7.14%, the positive rates of other individual indicators were 50.00% for A1M, 26.53% for IgG, 21.43% for TRF, and significantly higher than that (7.14%) of BUN and (6.12%) of Cr(P<0. 01). Conclusion The level of urinary microprotein significantly increased in asphyxial neonates, whose positive rate was higher than serum BUN and Cr, and it can be used as early diagnostic indicators of kidney injury in neonates with asphyxia.
neonate; asphyxia; kidney injury; urinary microprotein
窦振云(1968—),男,副主任医师,研究方向为新生儿和儿童重症医学。
潘兆军,E-mail:panzhaojun1@sina.com
10.3969/j.issn.1008-8849.2014.02.009
R692
A
1008-8849(2014)02-0137-03
2013-06-15
