10株绿僵菌菌株分类地位的多基因系统进化分析
2014-08-10殷幼平王中康刘娟娟廖玉凤
王 萌, 殷幼平, 王中康, 刘娟娟, 廖玉凤
(重庆大学生命科学学院基因工程研究中心,重庆 400030)
研究报告
10株绿僵菌菌株分类地位的多基因系统进化分析
王 萌, 殷幼平, 王中康*, 刘娟娟, 廖玉凤
(重庆大学生命科学学院基因工程研究中心,重庆 400030)
为确定10株高效杀虫绿僵菌菌株的分类地位,通过克隆、测序10株绿僵菌菌株的ef1-α、rpb1、rpb2、β-tubulin部分序列进行多基因系统进化分析,并结合形态特征确定10株绿僵菌菌株的分类地位。结果表明多基因分子鉴定在绿僵菌菌种的划分上较单基因更为准确,结合多基因系统进化分析结果和形态学特征,将CQMa114、CQMa117、CQMa125、CQMa126、CQMa128归为大孢绿僵菌,CQMa102归为蝗绿僵菌,CQMa132、CQMa135归为贵州绿僵菌,菌株CQMa138、CQMa140与其他绿僵菌亲缘关系较远,有可能为绿僵菌属的新种或新的分类单位。
绿僵菌; 分类鉴定; 多基因系统进化分析; 形态学
绿僵菌属(MetarhiziumSorokin)的系统分类地位为菌物界(Fungi),子囊菌门(Ascomycota),粪菌纲(Sordariomycetes),肉座菌目(Hypocreales),麦角菌科(Clavicipitaceae),是一个包括多种重要虫生真菌的真菌类群[1]。据不完全统计,近年来世界各地有近百余种农作物、林木及卫生害虫采用绿僵菌进行室内防效测试与评价[2-3]。从应用范围看,绿僵菌已发展为仅次于白僵菌的杀虫真菌属种。杀蝗绿僵菌制剂已用于我国农牧区飞蝗和土蝗的大面积生物防治[4]。绿僵菌属是麦角菌科的重要昆虫病原真菌属,由于具有较强的寄主专化性的大多数绿僵菌种类仅产生形态简单的无性型,绿僵菌菌种的正确鉴别,对绿僵菌杀虫制剂的研制和开发有着重要的指导意义。传统的绿僵菌分类主要根据菌丝体、产孢结构和分生孢子进行分类鉴定。
进入20世纪60年代后,分子生物学方法进入真菌分类鉴定,其中应用最为广泛的是利用保守的ITS rDNA 序列对真菌进行分类。但由于ITS序列提供的遗传信息有限,Driver等根据ITS序列将绿僵菌属划分为多个变种,其中黄绿绿僵菌、金龟子绿僵菌分别定义为包含种下变种的复合种[5]。Bischoff等通过结合功能基因转录延长因子(ef1-α),RNA聚合酶Ⅰ(rpb1),RNA 聚合酶Ⅱ(rpb2)进行多基因系统进化分析,并结合形态学特征证明易碎绿僵菌不属于黄绿绿僵菌类群[6]。这种多基因系统进化分析的有效性,为绿僵菌属的分类鉴定提供了一个更加细化和可靠的方法[7]。Bischoff等结合功能基因ef1-α,rpb1,rpb2以及β-tubulin(微管蛋白基因)对绿僵菌属进行系统进化分析的研究[7]。将Driver 命名的两个变种上升到种的水平,分别为M.acridum和M.lepidiotae,同时还将前人鉴定的2个变种升到种的地位,重新命名为M.anisopliae,M.majus, 并且发现了2个新种:M.giohosurn和M.robertsii。相对于ITS单一靶标基因对绿僵菌属的分类鉴别方法,多基因序列分析能够更明确地确定绿僵菌属种的分类地位,对其种下变种的细化分类具有明显的优势。
近年来本研究室经过广泛的采集收集,从国内外采集了大量的杀虫真菌菌株,其中一些种类在形态上差异很小,分类地位难以确定。本研究根据菌株的ef1-α、rpb1、rpb2、β-tubulin部分序列对10株经形态初步鉴定为绿僵菌的高效杀虫菌株进行多基因系统进化分析,结合形态学特征以确定菌株的科学分类地位。
1 材料与方法
1.1 供试材料
供试菌株:实验室保存经形态初步鉴定为绿僵菌的菌株10株,菌株信息见表1,菌株培养基:1/4 SDA培养基(蛋白栋2.5 g,葡萄糖10 g,酵母膏0.5 g,琼脂15~20 g,蒸馏水1 000 mL)为菌株培养基。
1.2 试验方法
1.2.1 形态学观察
将各菌株分别接种于1/4 SDA培养基上,28 ℃培养6~8 d,观察菌落形态、孢子形态、产孢结构等形态特性。
1.2.2 基因组DNA提取
将菌种接种于1/4 SDA液体培养基中,28 ℃振荡培养5~7 d,收集菌丝。分别以Fermentas 真菌基因组DNA提取试剂盒提取各菌株的基因组DNA。
1.2.3 目的基因的扩增及测序
用于多基因系统进化分析的目的基因包括ef1-α、rpb1、rpb2、β-tubulin,引物序列参见文献[7]。
PCR反应体系(50 μL)包括5 μL 10×PCR buffer,1 μL dNTP,1.5 μL MgCl2,正反向引物各1 μL,模板2 μL,0.2 μL PlatinumTaq酶(Invitrogen公司)。PCR反应程序为预变性95 ℃5 min,1个循环;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 90 s,35个循环;72 ℃延伸10 min。扩增产物在1.5%琼脂糖凝胶(含EB)中电泳30 min 后在紫外灯下切下凝胶,以Fermentas凝胶回收试剂盒回收扩增产物,回收产物经T4连接酶连接过夜,转化trans5α感受态细胞,连接体系为5 μL solutionⅠ,4 μL DNA,1 μL pmd-19 载体。连接过夜后向装有25 μL感受态细胞的1.5 mL 离心管中加入10 μL 连接产物,冰浴30 min,转入42 ℃水浴 50 s ,再次冰浴2 min,后向转化产物中加入800 μL 液体LB培养基,37 ℃培养1 h,将培养物3 500 r/min 离心3 min,弃上清液,留取下部约30 μL菌液用移液枪吹打混匀,将菌液涂平板,38 ℃培养12 h,挑取阳性克隆经PCR验证后,送北京六合华大基因科技股份有限公司测序。
1.2.4 序列比对及系统进化分析
从GenBank中下载已登录的绿僵菌ef1-α、rpb1、rpb2、β-tubulin序列信息,与本研究所测的菌株序列一起,用Clustal X 1.83软件分别对基因序列进行比对分析,以球孢白僵菌为外群,用MEGA4.1 软件构建菌株单基因和多基因系统进化树,根据形态和系统进化分析结果确定各菌株的科学分类地位。
2 结果和分析
2.1 形态学特征
2.1.1 菌落形态
将菌株接种在1/4 SDA培养基上,28 ℃培养14 d后记录菌落形态、产孢情况。观察分生孢子和产孢细胞即分生孢子梗的特征。菌落形态特征见表1。
表1绿僵菌不同菌株菌落及孢子形态特征
Table1CharacteristicsofcoloniesandconidiaofcollectedMetarhiziumstrains

绿僵菌菌株StrainofMetarhizium菌落形态特征Charactersofmorphology菌落色泽Colorofcolony菌落形态Shapeofcolony基质色泽Colorofbasifixedcolony采集地Collectlocation年份YearCAMa102黄色Yellow茸状Chopped黄色Yellow重庆Chongqing1990CQMa114橄榄绿Olivegreen绒毛状Villiform淡黄Lightyellow河南Henan2005CQMa117橄榄绿Olivegreen绒毛状Villiform淡黄Lightyellow广西Guangxi2007CQMa125橄榄绿Olivegreen绒毛状Villiform淡黄Lightyellow河南Henan2007CQMa126橄榄绿Olivegreen绒毛状Villiform淡黄Lightyellow河南Henan2007CQMa128橄榄绿Olivegreen绒毛状Villiform淡黄Lightyellow河南Henan2007CQMa132绿色Green茸状Chopped黄褐色Tawny山东Shandong2009CQMa135墨绿色Blackandgreen茸状Chopped黄褐色Tawny山东Shandong2009CQMa138绿色Green茸状Chopped红褐色Mahogany湖南Hunan2010CQMa140灰绿Greygreen绒毛状Villiform黑色Black广西Guangxi2011
2.1.2 显微形态
将各菌株通过插片培养的方法接种于1/4 SDA培养基,6 d后取下玻片,在显微镜下观察分生孢子和产孢结构(图1、图2),分生孢子大小及形状见表2。其中菌株CQMa102的分生孢子呈卵形,大小与其他绿僵菌差异较大,分生孢子梗聚集为轮生体,CQMa114、CQMa117、CQMa125、CQMa126、CQMa128的分生孢子皆为长椭圆形,分生孢子大小无明显差异,分生孢子梗紧密排列,呈帚状分枝。CQMa132、CQMa135的分生孢子呈柱状,大小7.5~11.8 μm,分生孢子梗聚集,每个分生孢子梗上有多个瓶梗。CQMa138、CQMa140分生孢子呈杆状,分生孢子梗只有1~2个瓶梗。
表2绿僵菌菌株的分生孢子形态
Table2ConidialfeaturesofMetarhiziumspecies

绿僵菌菌株StrainofMetarhizium孢子形态特征Charactersofspores孢子形态Shapeofspores孢子长度/μmLengthofspore孢子宽度/μmWidthofsporeCQMa102卵形Oval3.3~4.62.1~3.3CQMa114长椭圆形Oblong6.6~8.22.3~3.1CQMa117长椭圆形Oblong6.2~8.52.3~3.5CQMa125长椭圆形Oblong6.4~8.31.8~2.5CQMa126长椭圆形Oblong5.5~8.62.2~2.9CQMa128长椭圆形Oblong6.7~8.42.2~3.1CQMa132柱状Columnar7.5~10.22.2~2.6CQMa135柱状Columnar9.1~11.82.1~3.2CQMa138杆状Rod8.8~10.22.2~2.9CQMa140杆状Rod9.3~11.21.8~2.8

图1 10株绿僵菌菌株的孢子形态
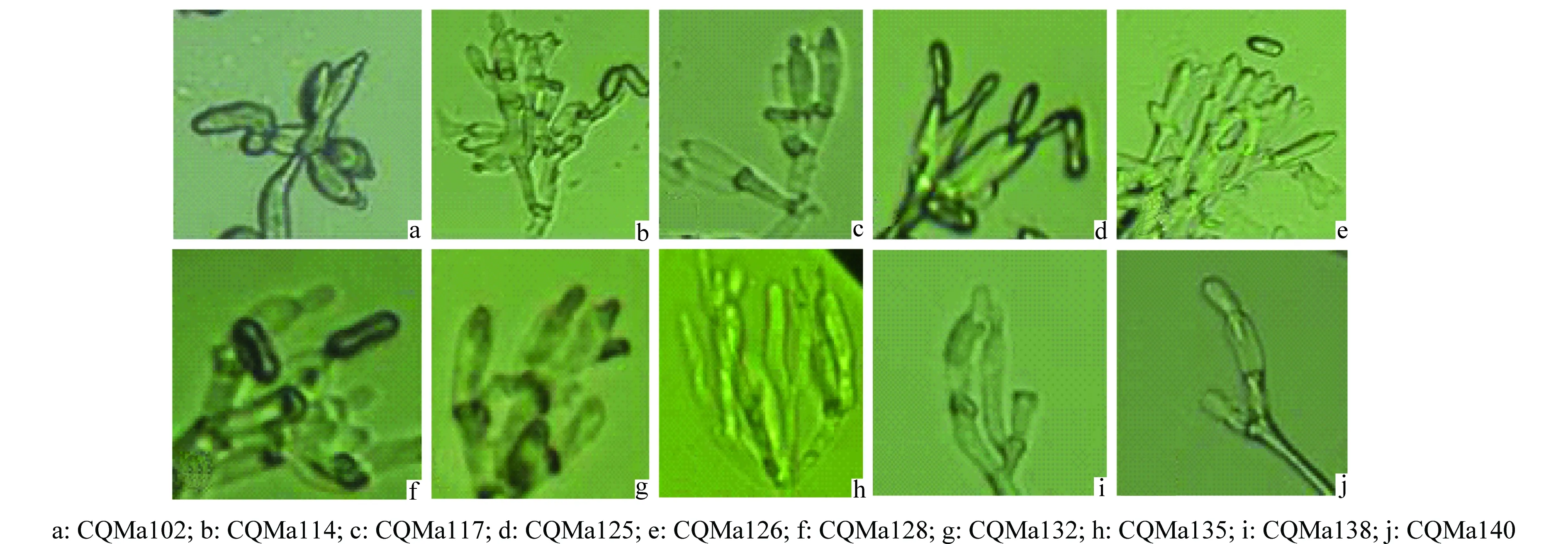
图2 10株绿僵菌菌株的产孢结构形态
2.2 系统进化分析
2.2.1 单基因系统进化树及系统进化分析
分别基于ef1-α、rpb1、rpb2、β-tubulin序列构建了单基因MP(maximum parsimony)系统进化树,单基因系统进化树结果较为一致的是绿僵菌属分为4个类群,黄绿绿僵菌单独为一个类群,独立于金龟子绿僵菌类群之外。柱状绿僵菌的分类也较为稳定,在4个单基因系统进化树中都独立为一个类群。球形绿僵菌和蝗绿僵菌及目的菌株CQMa102为一个类群,与其他金龟子绿僵菌亲缘关系较远。出现争议的对其他形态上相近的绿僵菌菌株的亲缘关系的划分,对目的菌株的划分结果也不一致。值得注意的是菌株CQMa138、CQMa140在4个单基因系统进化树中都独立于现有绿僵菌种的类群之外,与现有绿僵菌种的亲缘关系较远。
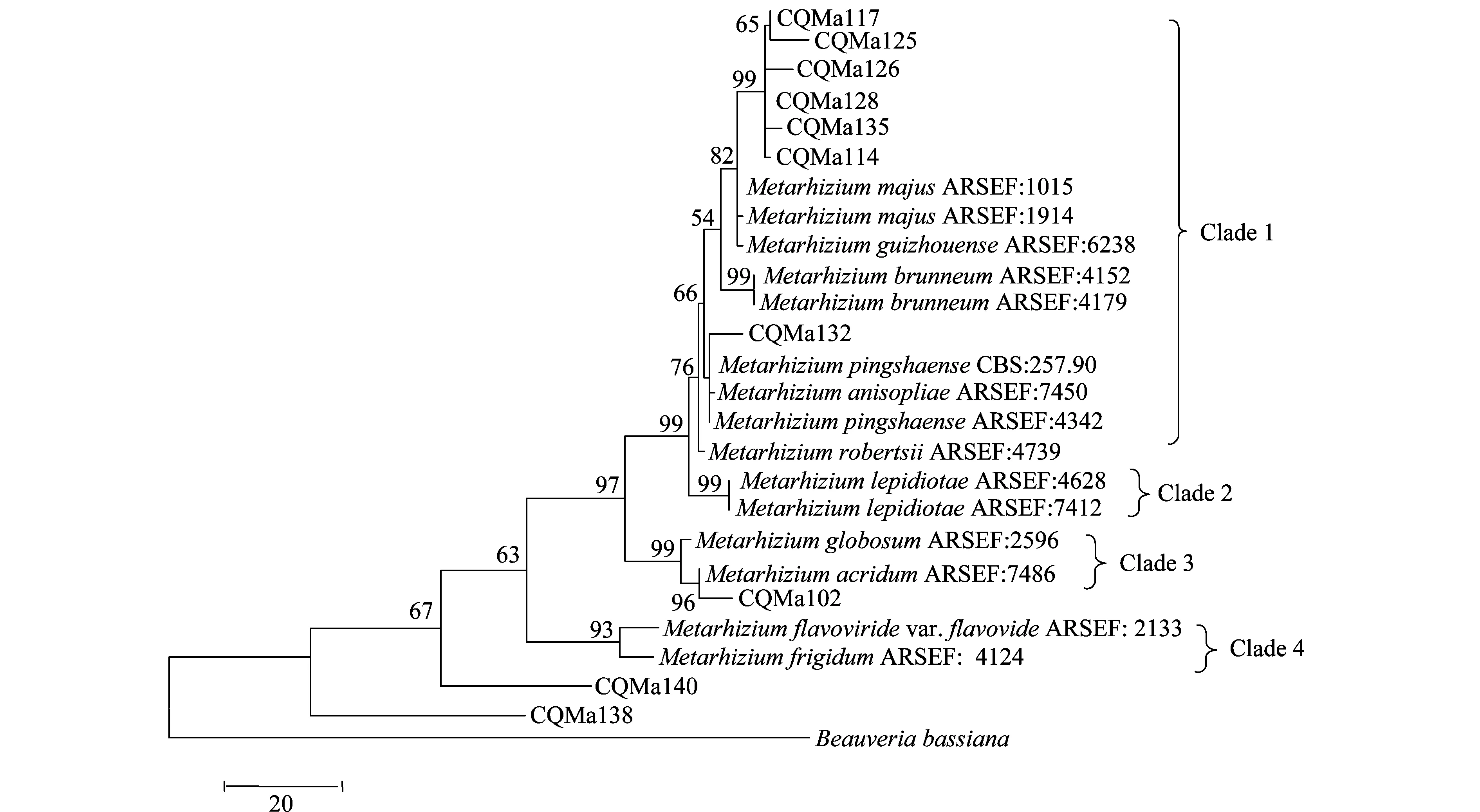
图3 基于rpb1 序列的单基因MP系统进化树

图4 基于rpb2序列的单基因MP系统进化树

图5 基于β-tubulin序列的单基因MP系统进化树
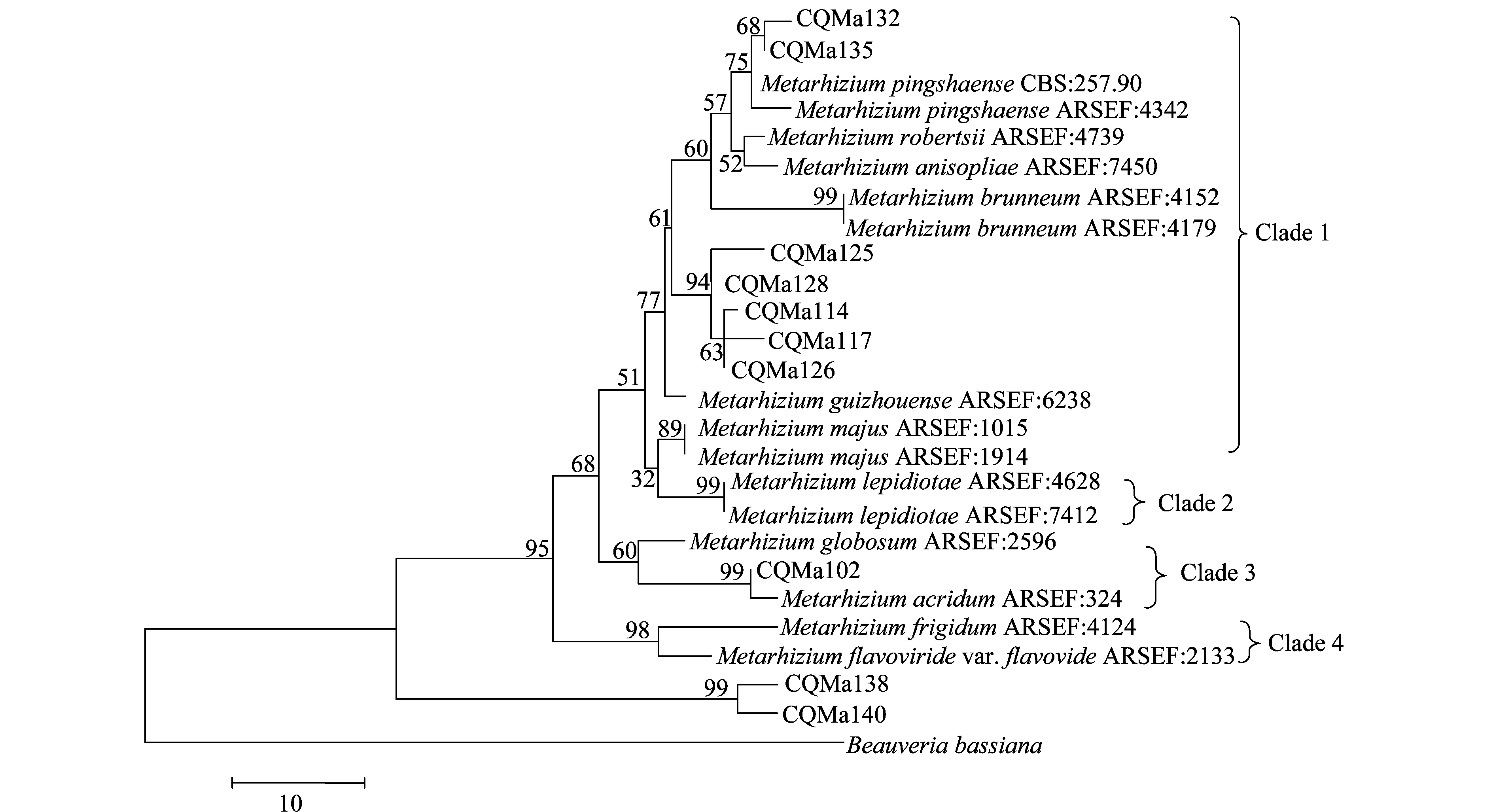
图6 基于ef1-α 序列的单基因MP系统进化树
2.2.2 多基因系统进化树及系统进化分析
以MP(maximum parismony)及N-J(neighbor-joining)两种方法构建了基于ef-α、rpb、rpb、β-tubulin序列的多基因系统进化树(图7、8),相比于单基因系统进化树,其能正确反映各菌株的亲缘关系,不存在同一个种的绿僵菌处在不同分支中的情况。两种算法构建的多基因系统进化树中各目的菌株的分类地位一致,各绿僵菌种之间的亲缘关系也一致。菌株CQMa102与蝗绿僵菌处在一个分支,支持率分别为96和89,在单基因系统进化树中与多基因系统进化树中菌株CQMa102的分类地位一致。 CQMa114、CQMa117、CQMa125、CQMa126、CQMa128聚集在一起,处在大孢绿僵菌这一分支当中,支持率分别为97和92,在单基因系统进化树中它们的分类地位则不一致,而两种算法构建的多基因进化树中他们的分类地位一致。CQMa135、CQMa132的分类地位单基因系统进化树中不一致,两种算法的多基因系统进化树中菌株CQMa132、CQMa135的分类地位一致,与贵州绿僵菌处于一个分支中。从多基因系统进化树中我们可以看到菌株CQMa138、CQMa140独立于现有的绿僵菌种的类群之外,与它们的亲缘关系较远,在单基因系统进化树中两株绿僵菌也独立于现有绿僵菌种的类群之外。有可能属于新的分类单元,还需要深入对菌株的生物学形态、杀虫谱以及多基因分子鉴定等方面开展研究,方能作出结论。
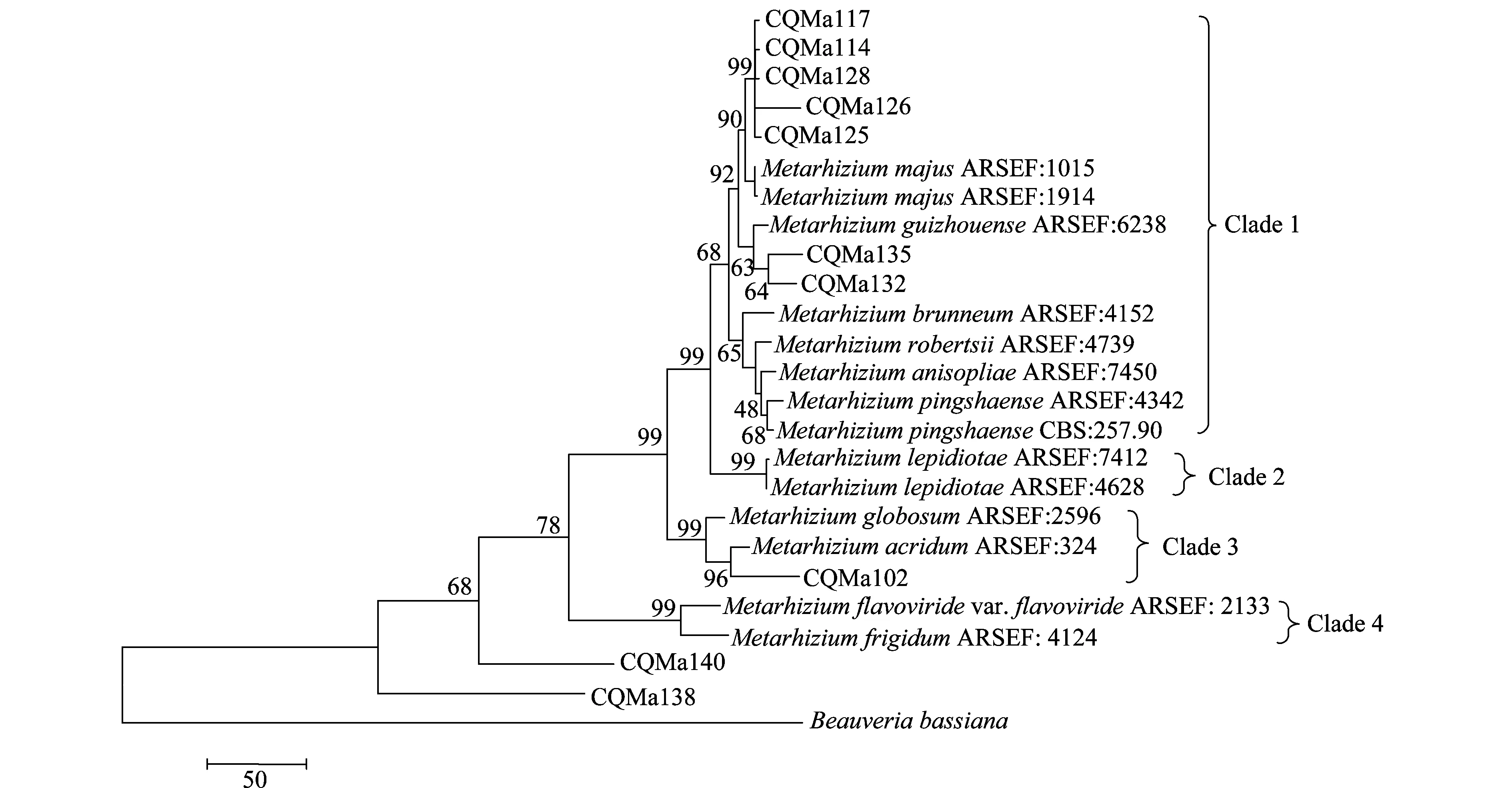
图7 基于ef1-α、rpb1、rpb2、β-tubulin序列的MP多基因系统进化树

图8 基于ef1-α、rpb1、rpb2、β-tubulin序列的N-J多基因系统进化树
3 结论与讨论
绿僵菌属是一个包括多种重要虫生真菌的真菌类群,具有很高的经济和社会价值。绿僵菌具有较强的宿主专化性,因此对绿僵菌进行准确的分类鉴定为基于绿僵菌菌种的杀虫剂研制和环境、生态的保护有着重要意义。绿僵菌属的分类鉴定方法经历了从传统生物形态学的单一性状到现代分子生物学的基因再到多基因位点分类的演变。由于菌落、瓶梗在不同培养条件下及在同一培养条件下都可能发生变化,且分生孢子大小存在重叠,因此不能完全依靠形态学特征作为分类的标准。随着分子生物学的发展,含有遗传信息的功能基因序列用于种类鉴定当中, ITS序列由于所含遗传信息的局限性,不能区别复合种下形态学相近的物种。在Driver[5]的研究中,形态学明显差异很大的大孢绿僵菌和金龟子绿僵菌在基于ITS序列的分析中处在一个分支当中,由于不能确定各个绿僵菌种的分类地位从而多赋予变种的分类地位。
在本研究中,基于4个不同基因序列的单基因系统进化树中可以将分析的菌株分为4个大的类群,4个类群所包含的绿僵菌种基本稳定,但在不同的单基因系统进化树中类群1中各菌株的亲缘关系差异较大,这可能是单个基因所包含的遗传信息有限,不能清晰地区分亲缘关系较近的种,而结合几个基因则能提供较充分的遗传信息。其中菌株CQMa114、CQMa117、CQM125、CQMa126、CQMa128在单基因系统进化树和多基因系统进化树中都聚集在一起,与大孢绿僵菌亲缘关系较近,形态学上分生孢子均为橄榄绿色,长椭圆形,因此鉴定为大孢绿僵菌。来源为河南的菌株CQMa114、CQM125、CQMa126、CQMa128虽寄主不同,但仍然具有很高的遗传相似性。在Fegan[8]的研究中发现同一地域来源的菌株在RAPD图谱上具有较大的相似率,说明同一地域来源菌株的遗传差异较小。在基于rpb1、rpb2、β-tubulin序列的单基因系统进化树中,贵州绿僵菌(M.guizhouense)均与大孢绿僵菌(M.majus)有很近的亲缘关系,但在基于ef1-α的系统进化树中,贵州绿僵菌却单独为一个分支。菌株CQMa132、CQMa135的来源和寄主相同,形态学上菌落均为茸状,基质均为黄褐色,孢子形态为柱状,在MP和N-J多基因系统进化树中以及基于rpb2序列的单基因系统进化树中均与贵州绿僵菌处在一个分支中,形态特征与贵州绿僵菌相符,因此鉴定为贵州绿僵菌,但在基于rpb1、β-tubulin序列的单基因系统进化树中两株绿僵菌却处在不同的分支中,这说明不同基因的变异频率有差异,因此单基因的系统进化分析和分类鉴定并不可靠。在Driver的研究中并没有包括我国的贵州绿僵菌和平沙绿僵菌两个种。
类群2为两株柱状绿僵菌(M.lepidiotae),类群3为蝗绿僵菌(M.acridum)、球孢绿僵菌(M.globosum)和菌株CQMa102,在单基因和多基因系统进化树中2个类群的分类稳定。菌株CQMa102分离于自然感病的黄脊竹蝗僵虫,分生孢子为卵形至梨形、黄色,分生孢子梗聚集呈轮生体,形态特征与蝗绿僵菌相似,加上可以侵染多种飞蝗和土蝗,因此鉴定为蝗绿僵菌。类群3在单基因系统进化树中分类地位稳定且和多基因系统进化树一致,从形态上看球孢绿僵菌和蝗绿僵菌与金龟子绿僵菌有较大的差异,这说明单基因在区分形态差异大的种时具有一定优势,而类群1中各绿僵菌菌种的亲缘关系在单基因中差异较大,这可能是单基因所包含的遗传信息有限而不能清晰区分形态相近的绿僵菌种的亲缘关系。
类群4为黄绿绿僵菌类群(M.flavoviride),在单基因和多基因系统进化树中其分类地位稳定,与其他绿僵菌的亲缘关系较远,说明黄绿绿僵菌与金龟子绿僵菌在遗传上有较大的差异,支持分为独立的2个种的现状;这一结果与Bridge[9]的研究一致。值得注意的是,菌株CQMa138、CQMa140在单基因和多基因系统进化树中都独立于现有绿僵菌种的类群之外,与其他绿僵菌种的亲缘关系较远,从形态上看CQMa138、CQMa140孢子均为杆状,颜色分别为绿色和灰绿色,瓶梗数量较少,与其他绿僵菌种的形态有比较明显的差异,结合系统进化分析结果和形态特征,初步推测CQMa138、CQMa140可能为绿僵菌属的新种或新的分类单元,但在MP和N-J多基因系统进化中,两个菌株的亲缘关系又有比较明显的差异,两者的亲缘关系还不明确,因此新种地位的确定还需更多的证据支撑。
[1]全宇, 刘永翔, 刘作易. 绿僵菌属分类的研究进展[J]. 贵州农业科学, 2011, 39(10): 113-117.
[2]de Faria M R, Wraight S P. Mycoinsecticides and mycoacaricides: A comprehensive list with worldwide coverage and international classification of formulation types[J]. Biological Control, 2007, 43:237-256.
[3]黄勃, 樊美珍, 李增智. 绿僵菌属系统分类的研究进展(综述)[J]. 安徽农业大学学报, 2002, 29(2): 169-172.
[4]Peng G X, Wang Z K, Yin Y P, et al. Field trials ofMetarhiziumanisopliaevar.acridum(Ascomycota: Hypocreales) against oriental migratory locusts,Locustamigratoriamanilensis(Meyen) in Northern China[J].Crop Protection,2008,27(9):1244-1250.
[5]Driver F, Milner R J, Trueman J W H. A taxonomic revision ofMetarhiziumbased on a phylogenetic analysis of rDNA sequence data[J]. Mycological Research, 2000, 104(2): 134-150.
[6]Bischoff J F, Rehner S A, Humber R A.Metarhiziumfrigidumsp. nov.: a cryptic species ofM.anisopliaeand a member of theM.flavoviridecomplex[J]. Mycologia, 2006, 98: 737-745.
[7]Bischoff J F, Rehner S A, Humber R A.A multilocus phylogeny of theMetarhiziumanisopliaelineage[J]. Mycologia, 2009, 101(4): 512-530.
[8]Fegan M, Manners J M, Maclean D J. Random amplified polymorphic DNA markers reveal a high degree of genetic diversity in the entomopathogenic fungusMetarhiziumanisopliaevar.anisopliae[J]. Journal of General Microbiology, 1993, 139: 2075-2081.
[9]Bridge P D, Williams M A J, Prior C. Morphological, biochemical and molecular characteristics ofMetarhiziumanisopliaeandM.flavoviride[J]. Journal of General Microbiology, 1993, 139: 1163-1165.
Multilocusphylogeneticanalysisofthetaxonomicstatusof10strainsofMetarhizium
Wang Meng, Yin Youping, Wang Zhongkang, Liu Juanjuan, Liao Yufeng
(SchoolofLifeSciences,ChongqingUniversity,ResearchCenterforGeneticEngineering,Chongqing400030,China)
In order to confirm the taxonomic status of 10 high-efficiency pesticide isolates ofMetarhizium, we employed a multilocus phylogenetic analysis approach by usingef1-α,rpb1,rpb2 andβ-tubulingene sequences and morphological characteristics to identify the taxonomic status of isolatedMetarhizium, the results proved that the multilocus phylogenetic analysis method was more accurate compared to single gene phylogenetic analysis. We identified CQMa114, CQM117, CQMa125, CQMa126 and CQMa128 asM.majus, CQMa102 asM.acridum, and CQMa132 and CQMa135 asM.guizhouense. The strains CQMa138 and CQMa140 might be new species ofMetarhizium.
Metarhizium; classification and determination; multilocus phylogenetic analysis; morphology
2013-09-16
:2014-05-24
公益性行业(农业)科研专项(201103002)
S 476.12
:ADOI:10.3969/j.issn.0529-1542.2014.05.003
* 通信作者 E-mail: w-zk@163.com
