大鼠离体心脏局部缺血再灌注损伤模型制备方法
2014-08-09日玄陈婵娟鲁卫星赵明镜
潘 日玄,陈婵娟,鲁卫星*,赵明镜
(1.北京中医药大学第一临床医学院,北京100007;2.北京中医药大学第三附属医院,北京100029;3.北京中医药大学东直门医院,北京 100007)
心肌组织是高度依赖于有氧氧化供应能量的组织。当供给心肌的血流量减少或心肌对氧的需求量超过其动脉最大供血量时即造成心肌缺血。缺血性损伤是指因心肌缺血引起心肌代谢、功能和结构的改变。尽早恢复组织的血液灌流是减轻心肌缺血性损伤的根本措施。近年来,随着溶栓、经皮冠状动脉介入术、动脉搭桥、心脏外科体外循环等方法的建立和推广,使缺血心肌更快地重新获得血液供应,明显减少了由于缺血导致的细胞坏死,提高了临床疗效,减少了病死率。但是,在临床观察和动物实验中发现,缺血组织细胞恢复灌流后,部分患者或动物的心肌损伤反而加重,因而将这种血液再灌注使缺血性损伤进一步加重的现象称之为缺血-再灌注损伤(Ischemia-Reperfusion Injury),简称再灌注损伤(Reperfusion Injury)[1]。除心肌组织外,再灌注损伤也同样危害着脑及其他器官组织[2]。对于急性心肌梗死或心脏外科手术的患者来说,其心肌的损伤包括2个阶段:1)缺血引起的损伤;2)含氧血流恢复后的再灌注损伤,这2个阶段既相互联系,又各有特点。在缺血性损伤的基础上发展而来的再灌注损伤,涉及多种发病机制并影响缺血性疾病的预后。再灌注可以使可逆性缺血损伤加重,亦可能促进可逆性缺血损伤转化为不可逆性损伤。在缺血性疾病防治中做到既保证尽早恢复缺血组织的血流,又减轻或防止再灌注损伤的发生,成为亟待解决的重要课题[1]。故正确而有效的实验模型制备对探索缺血-再灌注损伤的机制尤为重要。离体心脏模型是指将动物心脏取出胸腔,连接于特定的灌流装置,灌注液灌注其冠脉系统,使离体心脏在人工控制的条件下自主搏动。离体心脏模型是心肌缺血-再灌注损伤机制研究和心血管药物筛选的常用工具[3]。自从Langendorff[4]首次报道使用哺乳动物离体心脏进行心脏机械功能研究以来,使研究者们可以在不受神经体液干扰的情况下进行心肌组织研究,在此模型基础上的各种改良的Langendorff模型相继出现在各种动物实验中。大鼠以其冠状动脉侧支循环少,心肌坏死出现早,心律失常发生率高,重复性与稳定性好,费用低廉而成为制作心肌缺血再灌注损伤的首选模型[5]。由于大鼠离体心脏冠脉在心肌内走行不易辨认,冠脉结扎手术操作难度大,心肌组织易损伤等特点,以往的离体心脏缺血再灌注模型制备多采用全心停灌后再灌的方法,但此方法与临床中人体心脏局部缺血的实际情况有所差别,本实验使用12只Wistar大鼠建立Langendorff离体心脏局部缺血再灌注模型,通过结扎离体心脏前降支而造成心肌局部缺血30 min后复灌的方法,以更好的模拟实际临床中患者心肌缺血的情况,在实验过程中探索并总结了成功制备模型的要点和经验。
1 实验材料
1.1 实验动物 健康Wisrar雄性大鼠12只(由北京华阜康生物科技股份有限公司提供),体质量300~350 g[许可证号:SCXK(京)2009-0007]。动物饲养环境为清洁级。本研究遵循国家实验动物管理条例及国家实验动物管理实施细则。
1.2 实验设备 Langendorff(澳大利亚ADInstruments Pty Ltd实验室,ML870 B2 Langendorff System),恒温水浴(LETIC公司,LE13206),电子天平(上海精科天平厂,JA1003),pH仪(上海精密科学仪器有限公司,PHS-3B),蠕动泵(GILSON公司,minipuls3),多导生理仪(美国Biopac MP150),医用二元气(95%O2+5%CO2),带线缝合针(上海医用缝合针厂有限公司,规格圆3/8 2.5×8 5/0),自制心室内压球囊及导管。
1.2.1 心室内压球囊测压管制备方法 持直径约2 mm的塑料导管一端轻轻抵住球囊底部,通过导管向球囊注入少量水的同时将导管缓慢拔出,仅留少许在球囊内,0号或1号丝线扎紧,检查球囊与导管结扎已紧且球囊无破口漏气。球囊直径约2~3 mm,直径过小易使球囊张力增大,测量数据不够敏感,过大则不易使球囊插入左心室。
1.2.2 主要溶液及试剂配制 K-H缓冲液的配制:储备液的配置,在2 L烧杯中,加入双重蒸馏水(总体积80%左右),再依次加入氯化钠69 g,氯化钾3.5 g,碳酸氢钠21 g,磷酸二氢钾1.63 g,硫酸镁1.44 g,充分搅拌后,加入双重蒸馏水定容至2 L,常温保存。工作液的配置:取储备液400 mL,加入葡萄糖3.996 g,氯化钙0.277 5 g,充分搅拌均匀,加双重蒸馏水稀释至2 L,再将溶液pH值调试至7.2~7.3。将过滤好的工作液分装入Langendorff灌流容器内。注意:凡溶液中有碳酸氢钠或氯化钙,则均应分别溶解,否则易产生沉淀;葡萄糖、氯化钙应在临用前加入以防变质;K-H液应当天使用当天配制,放置时间过久可致pH值变化[6]。
2 实验方法
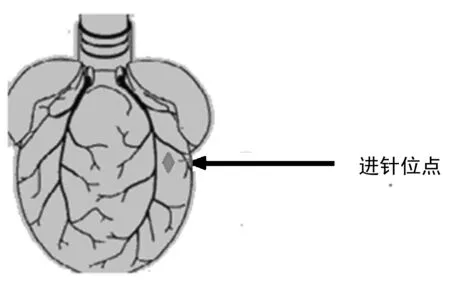
图1 进针位点
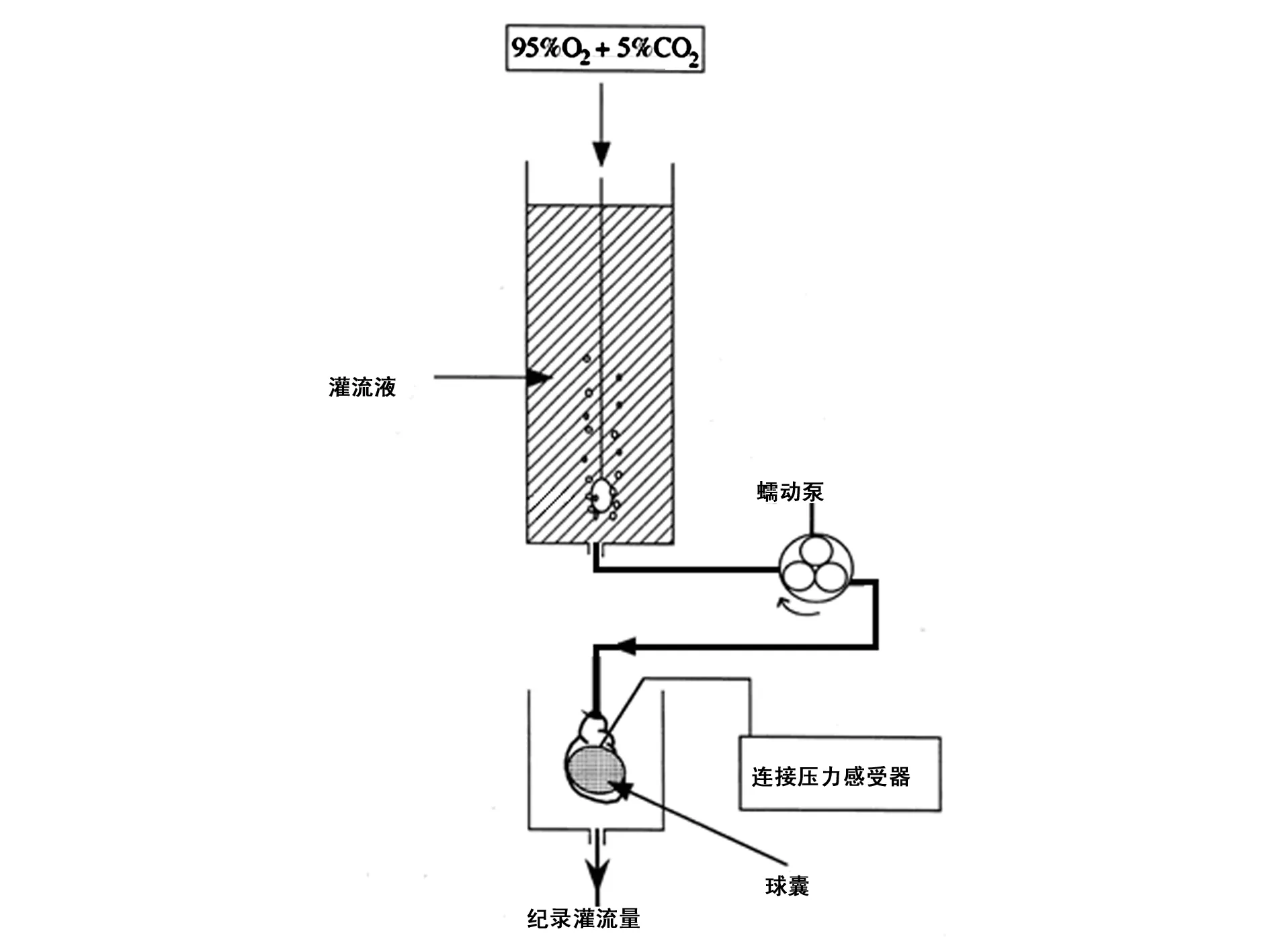
图2 Langendorff灌流系统示意图
2.1 造模方法 大鼠称重后,提前30 min腹腔注射肝素抗凝(1 mL/300 g),使其充分肝素化,之后用2%戊巴比妥钠(0.2 mL/100 g)腹腔注射,待大鼠充分麻醉后将大鼠仰卧固定在鼠板上。首先从剑突下约1 cm处起至颈部纵向剪开胸腹部皮肤,继而将剑突下方的肌层纵向剪至横膈处,沿横膈横向剪开,同时用眼科镊提起剑突以观察心脏位置,防止伤及心脏;剪开横膈后,沿两侧肋骨向上剪至颈部,将胸壁向头部掀起,暴露出心脏。眼科镊轻轻分离开胸腺,以镊子夹住主动脉的根部(即主动脉与头臂干交接处),迅速切断主动脉处的血管连接,以眼科镊夹闭主动脉切断处将心脏提出胸腔,同时使用眼科剪分离与心脏连着的肺及周围的脂肪及结缔组织,迅速将分离出的心脏放入0 ℃K-H液使之停跳,并迅速移至Langendorff仪器前,用2眼科镊轻提起主动脉血管壁,经仪器灌注口插入,动脉夹固定,后用棉线打结固定灌注口与主动脉相连处,灌注口应置于主动脉瓣及冠状动脉开口上方,K-H液经主动脉恒流灌注(灌注压维持在75~80 mmHg之间)。整个灌注期间温度保持在37 ℃,为了保证离体心脏的表面有一定的温度和湿度,将心脏置于由玻璃或有机玻璃制成的双层保温灌流槽内。双层保温灌流槽的底部有漏斗形的开口,上方盖子盖住可以保持槽内温度恒定,灌注液经95%O2+5%CO2鼓泡式氧合。剪开右心耳,使冠状动脉回流液得以充分引流。待心脏经灌流可正常搏动5 min后,使用带线缝合针穿线,穿刺点位于左心耳下方约2 mm(见图1),隐约能看到走行于心脏表面静脉,进针角度应垂直于心脏,由于前降支在心肌内走形并非垂直,而是略向上弯曲,故尽量斜向上方出针。穿针后暂不结扎,将连有压力传感器的抽瘪的球囊从左心耳上方与主动脉之间,经左房与二尖瓣送入左心室,压力传感器与多导生理仪系统连接(见图2),向心室球囊内缓慢注入适量水,使心室舒张末压维持在10 mmHg,待离体大鼠心脏收缩舒张功能逐渐稳定后,开始记录血流动力学,调节固定保温灌流槽,使保温灌流槽罩住心脏。灌流液进入冠脉后到右心房经腔静脉及肺动脉滴入双层灌流槽中,经槽底部的漏斗形开口流出,用量筒收集一定时间内的流出液即为冠脉流量。
平衡灌注15~20 min后观察心脏搏动情况,以稳定后缺血前心率在220~290次/min,左心室内压力约45~65 mmHg之间,心室发展压在10.64~15.96 kPa为入选标准,超出此范围应弃之[7]。继而进行前降支结扎,有文献记述采用推管法[8],但经本课题组成员反复探索,采用橡皮筋垫放结扎更为简便易行。将一段长约0.7 cm的橡皮筋垫放于结扎处,用之前已穿好的带线缝合针系紧橡皮筋后打结。此方法可有效阻断前降支血流,且不会出现结扎线将心肌拉断的现象,有利于复灌时操作。待前降支血流被阻断时计时30 min,缺血30 min后将橡皮筋抽出,同时可剪断结扎线,进行复灌75 min。
2.2 注意要点 1)在胸腔内分离出心脏时,应尽量减少器械及手与心脏触碰,否则会影响心脏搏动。2)从体内取出心脏后放入0 ℃K-H液中以减少心脏在离体后与再灌前的心肌耗氧量,0 ℃K-H液中需加入少量肝素,防止离体心脏冠脉凝血,且心脏应全部浸入K-H液中,以防引起冠脉空气栓塞。3)心脏与Langendorff连接前应事先打开灌流仪,使灌流液从灌注口流出,以排尽管道中的空气与杂质防止血管栓塞。4)主动脉根部需保留0.5~1 cm长度以备插管用,灌注口应置于主动脉瓣及冠状动脉开口上方,若过深会损伤主动脉瓣,使灌流液流入心室腔,造成冠状动脉灌流不充分。5)从开胸至心脏迅速转移并固定于Langendorff离体心脏灌流装置上,其用时一般在70 s左右[6]。6)由于心脏对温度极其敏感,要注意K-H液从37 ℃恒温水浴流出后在通道里所丢失的温度,室温不能过低。如果在灌注口处无保温层,则可以将水浴温度适当调高。7)注意灌注液鼓泡式氧合时起泡不能过大,否则会损伤钙离子[8]。8)由于本实验所造模型为前壁局部缺血再灌注,故结扎时需避开第一对角支,注意结扎位点与左主干距离,若靠近冠脉左主干过近,易出现室颤[9]。9)插入心室内压球囊测压管后,需进行压力感受器调零。10)由于本实验采用恒流灌注,灌流量控制在10 mL/min[10]。11)按照穿线后放入球囊,再行结扎前降支的顺序是防止进针过深扎破球囊。
3 实验结果
观察缺血后再灌注心肌模型的梗死面积:实验结束,取下心脏,将心脏横向切成1~2 mm厚的薄片,浸于1%TTC溶液中,37 ℃横温水浴约15 min,梗死区为灰白色,非梗死区为砖红色,后放入4%多聚甲醛固定。数码相机拍照,应用Image-Pro Plus 6.0软件计算 IS(%),计算方法为IS%=(梗死面积/截面总面积)×100%。本实验造模成功率为83%(10/12),其中麻醉致死1只,因分离心脏时间过长致灌流后不能复跳1只。IS%为(40±6)%。图3中所示梗死区主要位于室间隔、左室前壁及侧壁大部分(见图3)。
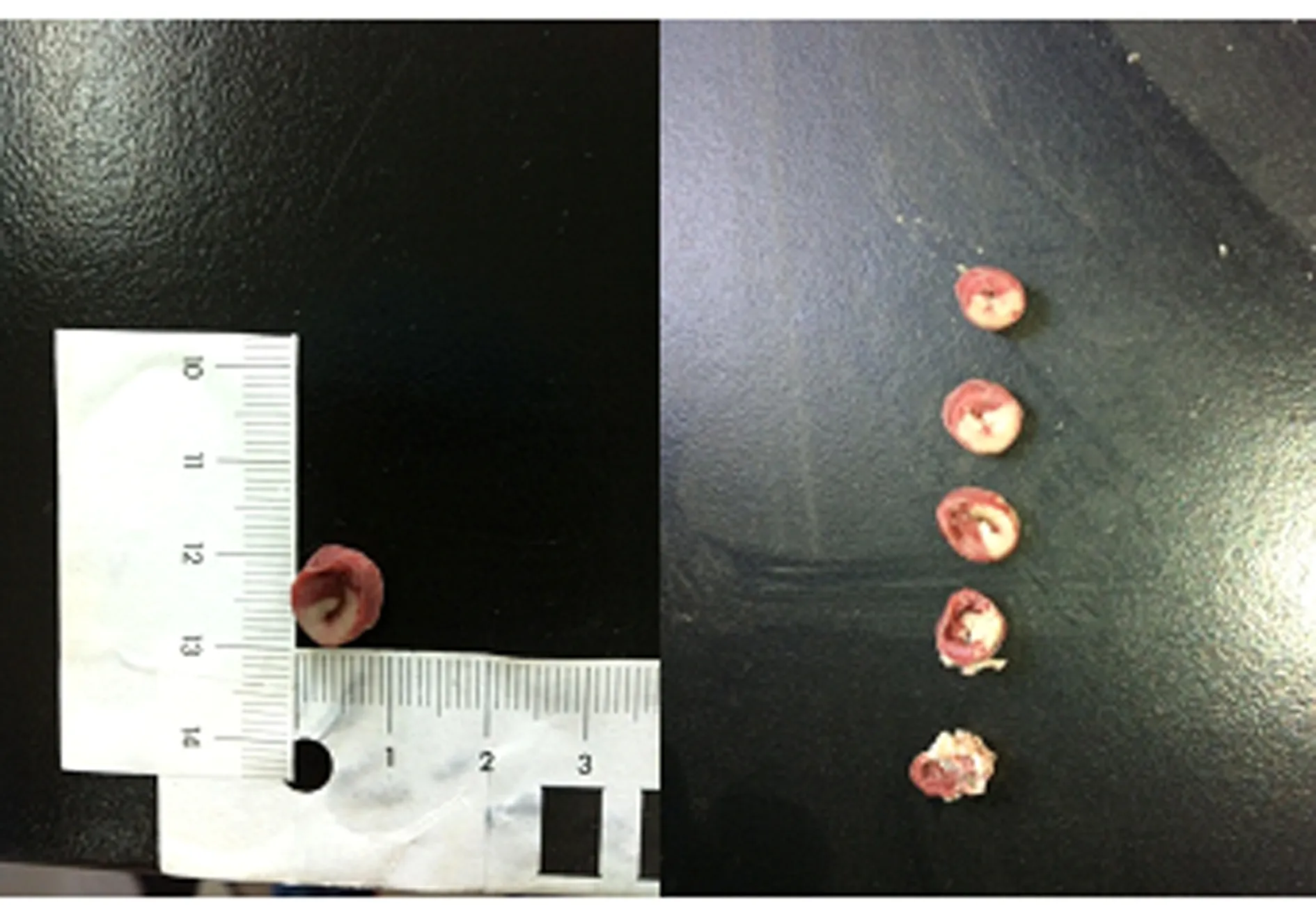
图3 缺血后心肌梗死照片
4 讨论
4.1 关于恒流灌注与恒压灌注 文献中所述Langendorff离体灌流多是恒压灌流系统[11],然而应用Langendorff恒流灌注系统也不失为另一种仪器设备的选择。二者各有其特点:恒压法便宜又方便,保持恒定液体静力压力即可,具体说就是保持恒定高度的液体,比如放一个储液器并保持其灌注液与目标主动脉灌注套管之间的距离,一般灌注压在75 mmHg左右[12]。恒压灌注适用于依赖心脏冠脉张力的自调节机制,尤其在灌注床各部分有连接的时候,这种情况在区域心肌缺血中出现,此时恒流灌注系统控制的单位体积心肌的冠脉灌注液远多于冠脉所需,但风险在于可能由于剪切压而造成冠状动脉损害;恒流灌注多见于研究血管功能、平滑肌和内皮功能时应用蠕动泵控制冠脉流量。恒流灌注时如需测量灌注压,只需在液体通路中灌注套管之前安装一个压力传感器即可。已知流速,便可计算冠状动脉阻力,如此一来便可在整个心脏的处理过程中研究血管活性物质[8]。
4.2 缺血时间与灌注总时间的把握 根据郭丽丽等[7]的文献报道,离体心脏正常灌流20~30 min各项指标趋于稳定,正常灌流70 min,各项指标保持稳定。因Langendorff离体模型中一些重要营养成分的不足及神经体液环境的缺乏,离体心脏长时间灌流可能出现缺氧、水肿、僵硬等现象,因此将再灌注时间继续延长>180 min研究意义可能不大。相反,在心肌梗死面积充分形成的前提下,尽量缩短再灌注时间则能使离体心脏心功能维持在较好状态[13]。根据文献报道,冠脉阻断20 min以内,缺血的心脏功能尚可恢复正常,超过20 min则导致心肌不可逆性坏死,因此适宜的缺血时间是导致心肌损伤的基础[14-15]。本实验组成员经反复摸索将缺血时间定为30 min,再灌注75 min,既能保证再灌注损伤又能保证心肌缺血模型的造模成功率。
4.3 Langendorff离体心脏灌流原理 离体心脏灌注模型是通过主动脉逆行插管灌注灌流液。与在体心脏工作原理不同的是,随着灌流液顺着主动脉流向心肌时,主动脉瓣在压力下呈关闭状态,灌流液通过左右冠状动脉开口进入冠状动脉系统营养心肌后,少量进入心室内,大多数汇集到冠状窦,最后经右心室和肺动脉排出,故要确保灌流液充分循环,则要确保循环后的灌流液充分排出,在结扎时切忌结扎肺动脉;也可以将右心耳剪开以更方便灌流液排出[16-17]。
[1]吴立玲,张幼怡.心血管病理生理学[M].2版.北京:北京大学医学出版社,2009:8.
[2]白黎明,张晓双,白璐,等.薯蓣皂苷与冰片配伍对大鼠脑缺血再灌注损伤的保护作用及其机制[J].吉林中医药,2012,32(4):75-76,79.
[3]Selye H.Simple techniques for surgical occlusion of coronary vessels in the rat [J].Angiology,1960(11):398.
[4]Porter W T.A new method for the study of the isolated mammalian heart [J].Physiol,1898(1):511-517.
[5]崔新明,曹霞,谷欣权,等.在体大鼠心肌缺血时间对再灌注损伤形成的影响[J].中国实验诊断学,2010,14(3):28-30.
[6]黄健,周云,杨绍军,等.成功制作离体心脏灌注模型要点和经验[J].实验动物学,2011,28(4):64-66,69.
[7]郭丽丽,王阶,陈雯.离体心脏缺血再灌时间与损伤模型的合理评价[C]//2011年中华中医药学会心病分会学术年会暨北京中医药学会心血管病专业委员会年会论文集.北京:中华中医药学会心病分会、北京中医药学会心血管病专业委员会,2011:5.
[8]Bell R M,Mocanu M M,Yellon D M,et al.Retrograde heartperfu-sion:The Langendorff technique of isolated heart perfusion[J].JMol Cell Cardiol,2011,50(6):940-950.
[9]李明,鲁卫星,崔现军,等.提高大鼠心肌缺血/再灌注损伤模型成功率的方法探讨[J].辽宁中医杂志,2010,37(9):71-72.
[10]郑君.瑞芬太尼后处理对兔离体缺血再灌注心肌保护作用及其机制[D].云南:昆明医学院,2010.
[11]戴小燕,方秋娟.Langendorff离体心脏灌注模型的制备及应用[J].医学综述,2012,18(13):82-85.
[12]王国印,刘宇,顾仁樾.三七有效组分对离体大鼠心肌缺血再灌注的影响[J].现代中西医结合杂志,2007,16(13):21-22.
[13]黎庆捷,文伟明,钟国强,等.离体大鼠心脏再灌注损伤模型中最佳再灌注时间的探讨[J].实用医学杂志,2013,29(8):44-46.
[14]殷仁富,陈金明.心脏能量学一代谢与治疗[M].上海:第二军医大学出版社,2002:74-76.
[15]邓汉武.大鼠心肌缺血再灌注损伤实验法[J].中国药理学通报,1989(5):63-66.
[16]Sutherland F J,Hearse D J.The isolated blood and perfusion fluid perfused heart[J].Pharmacol Res,2000,41(6): 613-627.
[17]Süzer O,Süzer A,Ayka Z,et al.Direct Cardiac Effects in Isolated Perfused Rat Hearts Measured at Increasing Concentrations of Morphine,Alfentanil,Fentanyl,Ketamine,Etomidate,Thiopentone,Midazolam and Propofol[J].European Journal of Anaesthesiology,1998,15(4):480-485.
