游离脂肪酸混合物对肝细胞脂毒性及脂代谢相关基因表达的影响*
2014-08-08项夏霖王苑芳刘填桂黄树林邵红伟
王 辉, 陈 骁, 项夏霖, 彭 鑫, 王苑芳, 刘填桂, 黄树林, 邵红伟
(广东省生物技术候选药物研究重点实验室, 广东药学院生命科学与生物制药学院,生物制药研究所, 广东 广州 510006)
非酒精性脂肪肝病(non-alcoholic fatty liver di-sease, NAFLD)是一种排除过量饮酒和其它明确的肝损伤因素之外所致的类似酒精性脂肪性肝病理改变的综合征,包括单纯脂肪肝(steatosis)、非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)、肝纤维化及肝硬化[1]。随着生活水平的提高,与膳食结构、肥胖、代谢性疾病密切相关的NAFLD发病率逐渐增高并呈现全球化、低龄化趋势。据报道,西方国家的成人NAFLD的发病率达20%~30%,其中NASH为2%~3%,约1/3 NASH病人并发进展性肝纤维化和肝硬化[2]。我国脂肪肝的发病率已占平均人口的10%,在肥胖、糖尿病高危人群中可高达50%~60%。国外大量临床调查发现NAFLD已成为西方国家继HBV和HCV后引起肝癌的第3个重要原因[3]。
游离脂肪酸(free fatty acid,FFA)与脂肪肝发病密切相关。脂肪肝病人常表现为肝脏摄取和合成FFA增加,FFA在肝线粒体内氧化和利用减少。FFA增加超过肝组织的氧化能力使FFA过度沉积造成脂毒性,表现为肝细胞脂肪变性和脂性凋亡[4]。本研究利用FFA混合物作用于人肝细胞L-02,观察其对L-02细胞脂肪变性、细胞损伤及脂代谢相关基因表达的影响,从而为研究NAFLD的发病机理和发现有效的治疗靶点奠定实验基础。
材 料 和 方 法
1 材料
油酸(oleic acid)、软脂酸(palmitic acid)、牛血清白蛋白、尼罗红(Nile red)、MTT和DMSO购自Sigma;人L-02细胞株购自中国科学院细胞库;BCA法蛋白质定量检测试剂盒购自碧云天生物技术研究所;甘油三酯(triglyceride,TG)酶法测定试剂盒购自北京普利莱基因技术有限公司;丙氨酸氨基转移酶(alanine aminotransferase,ALT)和天冬氨酸氨基转移酶(aspartate aminotransferase,AST)测定试剂盒购自中生北控生物科技股份有限公司;DMEM培养基和Trizol试剂购自Invitrogen;胎牛血清购自浙江天杭生物科技有限公司;Annexin V-PI凋亡检测试剂盒购自BD;GoScript逆转录试剂盒购自Promega;SYBR Fast MasterMix(2×)购自Roche。
2 方法
2.1细胞培养及给药 人肝细胞系L-02用含10%胎牛血清的DMEM培养液在37 ℃、5% CO2培养箱进行培养。每2~3 d传代1次,所有实验均采用处于2~5代对数生长期的细胞。 L-02细胞培养至生长密度达到80%以上,分别用正常培养基和0.5、1、2 mmol/L FFA混合物(油酸∶软脂酸=2∶1)培养24 h后测定指标。
2.2激光共聚焦显微镜观察细胞脂肪堆积 尼罗红可对脂肪特异性染色。L-02细胞接种于放有盖玻片的35 mm平板中爬片生长至密度80%以上,用不同浓度FFA混合物培养24 h后,细胞用1 μmol/L 尼罗红染液1 mL室温避光染色15 min,奥林巴斯激光共聚焦显微镜(488 nm excitation/543 nm emission)观察细胞内脂肪堆积情况。
2.3流式细胞术测定细胞脂肪堆积 不同浓度FFA混合物培养24 h的细胞经胰酶消化后,1 000 r/min离心5 min,收集细胞后用冰PBS洗涤细胞2次。细胞重悬于1 μmol/L 尼罗红染液1 mL,小心吹打混匀。室温避光放置30 min染色,1 000 r/min离心5 min,冰PBS洗涤细胞2次,重悬于1 mL PBS,流式细胞仪(490 nm excitation/570 nm emission;Beckman Coulter)随机计数10 000个细胞检测其荧光强度。
2.4TG测定 收集FFA混合物处理后的细胞,TG含量用组织细胞酶法测定试剂盒进行测定,细胞蛋白浓度用BCA法蛋白质定量检测试剂盒测定,实验重复3次。
2.5细胞存活率检测 采用MTT法检测细胞存活率。不同浓度FFA混合物处理接种于96孔板的L-02细胞(细胞密度50%)24 h后,每孔加入10 μL MTT储存液(5 g/L)。培养4 h后弃去培养基每孔加入DMSO 100 μL,室温振荡5 min后多功能酶标仪570 nm波长处测定各孔的吸光度(A)。每组设4个复孔,实验重复3次,细胞存活率计算:

2.6流式细胞术测定细胞凋亡 Annexin V-PI凋亡检测试剂盒分析细胞的凋亡情况。用不同浓度FFA混合物培养24 h的细胞经胰酶消化后,1 000 r/min离心5 min,收集细胞用冰PBS洗涤细胞2次,1 000 r/min离心5 min。细胞重悬于500 μL binding缓冲液 ,分别加入5 μL Annexin V和5 μL PI,小心吹打混匀。室温避光放置15 min,流式细胞仪随机计数10 000个细胞并计算凋亡细胞百分率,实验重复3次。
2.7ALT和AST测定 FFA混合物处理L-02细胞24 h后,吸取培养上清用ALT和AST测定试剂盒340 nm波长处测定1 min和2 minA值,根据试剂盒说明书利用吸光度差值ΔA计算ALT和AST活性,实验重复3次。
2.8实时荧光定量PCR检测脂代谢相关基因表达 Trizol试剂提取各组细胞总RNA并取5 μg RNA用GoScriptTM逆转录试剂盒分别逆转录为cDNA。脂肪分化相关蛋白(adipose differentiation-related protein,ADR)上游引物5′-gggatccctgtctaccaagc-3′,下游引物5′-agatgtcgcctgccatcacc-3′。固醇调节元件结合蛋白1(sterol regulatory element-binding protein 1,SREBP-1)上游引物5′-acggcagcccctgtaacgaccactgtga-3′,下游引物5′-tgccaagatggttccgccactcaccagg-3′。β-actin上游引物5′-gactacctcatgaagatc-3′,下游引物 5′-gatccacatctgctggaa-3′。用Roche Light Cycler 480II实时定量PCR仪进行PCR扩增。反应体系为:2× SYBR Fast Master Mix 10 μL,10 μmol/L上、下游引物各1 μL,cDNA模板2 μL,无菌水补足体积至20 μL。反应条件为:95 ℃ 5 min, 1个循环;95 ℃ 10 s,62 ℃ 30 s,45个循环。检测荧光信号并分析循环阈值(Ct),ΔCt为目的基因与内参照β-actin循环阈值的差值,ΔΔCt为对照组和实验组ΔCt的差值,采用公式2-ΔΔCt计算目的基因的相对表达量。每组设3个复孔,实验重复3次。
3 统计学处理
数据用均数±标准误(mean±SEM)表示,均数比较采用方差分析,以P<0.05为差异有统计学意义。
结 果
1 FFA混合物诱导肝细胞L-02脂肪变性
如图1所示,FFA混合物处理后,细胞内脂滴成环状位于细胞膜内侧,随脂肪酸浓度增加L-02细胞内红色脂滴增大及数量增多。图2显示,各浓度FFA混合物可剂量依赖性增加肝细胞脂肪堆积。如图3所示,各浓度FFA混合物可剂量依赖性增加肝细胞甘油三酯含量。与对照组相比,1 mmol/L FFA混合物处理的肝细胞甘油三酯含量增高2.6倍,与文献报道[5]的NAFLD病人的情况(2.7倍)基本相同。

Figure 1. FFA mixture induced lipid accumulation in L-02 cells after Nile red staining by confocal laser scanning microscopy (×400).
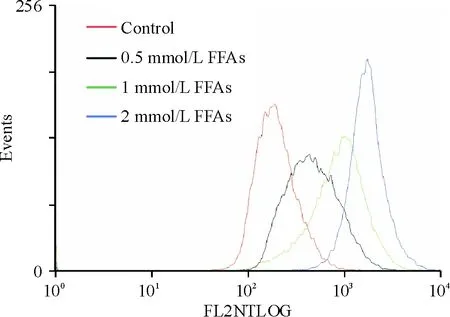
Figure 2. Flow cytometric analysis of L-02 cell lipid content after FFA mixture treatment and Nile red staining. The flow cytometry diagram is a representative of three independent experiments.
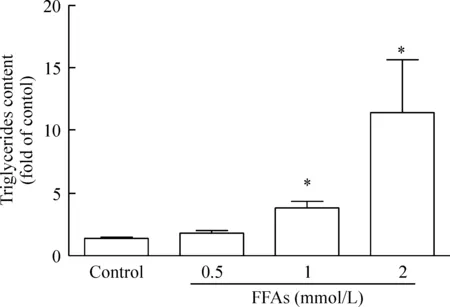
Figure 3. Triglyceride(TG)content in L-02 cells treated with FFA mixture. Mean±SEM.n=3.*P<0.05 vs control group.
2 FFA混合物对肝细胞L-02损伤的影响
如图4所示,0.5 mmol/L和1 mmol/L脂肪酸混合物对细胞生长无明显抑制作用,而2 mmol/L脂肪酸混合物可降低L-02细胞存活率(P<0.05)。如图5所示,与对照组早期凋亡率(3.400±0.414)%和晚期凋亡率(2.600±0.402)%相比,2 mmol/L FFA混合物处理的L-02细胞早期凋亡率(6.275±1.368)%和晚期凋亡率(7.625±1.810)%增加(P<0.05),而0.5 mmol/L和1 mmol/L FFA混合物对细胞凋亡无明显影响。与对照组相比,各浓度FFA混合物培养上清中ALT和AST水平无显著上升,见表1,说明FFA混合物处理未造成L-02细胞转氨酶泄漏。1 mmol/L FFA混合物可诱导肝细胞脂肪变性但又不造成肝细胞损伤。

Figure 4. Effects of FFA mixture on L-02 cell viability.Mean±SEM.n=3.*P<0.05 vs control group.

Figure 5. Apoptosis-inducing effects of FFA mixture treatment on L-02 detected by flow cytometry.Mean±SEM.n=3.*P<0.05 vs control group.
3 FFA混合物上调L-02细胞ADRP和SREBP-1 mRNA的表达
与对照组相比,1 mmol/L FFA混合物作用后,L-02细胞的ADRP和SREBP-1 mRNA的表达分别上调2.660和2.758倍,见图6。

表1 不同浓度FFA混合物对L-02细胞培养上清中ALT和AST活性的影响
讨 论
油酸和软脂酸是正常人和NAFLD病人肝脏中含量最丰富的脂肪酸[5],添加油酸和软脂酸也是脂肪肝细胞模型研究中最常见的方法。研究发现过多脂肪酸沉积在肝脏可引起一系列代谢改变并最终导致对肝细胞的脂毒性[4]。不同脂肪酸的作用差异较大,饱和脂肪酸软脂酸可诱导肝细胞内质网应激并导致肝细胞凋亡,而不饱和脂肪酸油酸可减少和抑制软脂酸对肝细胞的毒性[6]。Gómez-Lechón等[5]用不同比例的饱和脂肪酸和不饱和脂肪酸来培养HepG2细胞和人原代肝细胞,发现软脂酸的比例越高,对肝细胞的脂毒性越大。脂肪酸血清浓度为0.2~2 mmol/L,因此我们选用0.5、1和2 mmol/L这3个浓度的FFA混合物,参照人体油酸和软脂酸的比例,以2∶1 比例联合作用于肝细胞,观察肝细胞的脂毒性。

Figure 6. The mRNA expression levels of two lipid metabolism-related molecules in FFA mixture-treated L-02 cells.ADRP: adipose differentiation-related protein; SREBP-1: sterol regulatory element-binding protein 1. Mean±SEM.n=3.*P<0.05 vs control group.
在用于脂肪肝研究的细胞中,人原代肝细胞特性最接近人肝脏,但细胞来源缺乏。另一常用于脂肪肝研究的细胞是人肝细胞癌细胞系HepG2,但肿瘤细胞内通常存在能量代谢过程的改变,如脂肪酸合成增加[7-8]和涉及脂质代谢过程的甲胎蛋白高表达[9]。L-02细胞是永生化正常人肝细胞系,已被研究者广泛应用于脂肪肝的机理和药物筛选研究[10-11],因此我们在本研究中采用了L-02细胞作为受试对象。细胞形态学观察、酶法检测细胞内甘油三酯含量和流式细胞术检测细胞内脂质堆积均证实1和2 mmol/L FFA混合物可明显诱导肝细胞L-02脂肪变性。对细胞存活率、凋亡和培养上清中转氨酶的检测进一步确定了1 mmol/L FFA混合物未造成L-02细胞明显损伤,而2 mmol/L FFA混合物对L-02具有毒性,这也与文献报道一致[12-13]。
脂代谢相关基因与肝脏脂肪酸合成和积聚密切相关。ADRP是形成细胞内脂滴的主要成分,在激活和贮存脂滴过程中发挥重要作用,可作为鉴定脂肪肝疾病的标志蛋白[14]。通过基因敲除和反义核苷酸可使ADRP含量降低,从而逆转脂肪肝,改变脂类代谢[15]。SREBP-1是甘油三酯代谢中的重要转录因子, 可在转录水平上调控多个脂质代谢中的关键酶[16-17],其在肝脏过表达导致肝细胞脂变[18]。为进一步明确1 mmol/L FFA混合物诱导肝脂肪变性的机制,我们通过实时定量PCR技术证实1 mmol/L FFA混合物可上调肝细胞脂代谢相关基因ADRP和SREBP-1的表达。
[参 考 文 献]
[1] 周 鑫, 韩德五, 李素红,等.非酒精性脂肪性肝病在代谢综合征相关的2型糖尿病发病中的作用[J].中国病理生理杂志, 2011, 27(7): 1352-1359.
[2] Gentile CL, Pagliassotti MJ. The role of fatty acids in the development and progression of nonalcoholic fatty liver disease [J]. J Nutr Biochem, 2008, 19(9): 567-576.
[3] 郑 刚.非酒精性脂肪性肝病与肝癌关系研究进展[J]. 胃肠病学和肝病学杂志, 2012, 21(3): 216-220.
[4] 程 媛,尚 靖,张陆勇.脂毒性与非酒精性脂肪肝的研究进展[J].华西医学, 2008,23(6):1482-1484.
[5] Gómez-Lechón MJ, Donato MT, Martínez-Romero A, et al. A human hepatocellularinvitromodel to investigate steatosis [J]. Chem Biol Interact, 2007, 165(2):106-116.
[6] Malhi H, Gores GJ. Molecular mechanisms of lipotoxicity in nonalcoholic fatty liver disease [J]. Semin Liver Dis, 2008, 28(4):360-369.
[7] 郑 杰. 肿瘤生物合成的异常及其临床应用[J]. 肿瘤, 2012, 32(1):74-78.
[8] Menendez JA, Lupu R. Fatty acid synthase and the lipogenic phenotype in cancer pathogenesis [J]. Nat Rev Cancer, 2007, 7(10):763-777.
[9] 李朝英, 李 刚. 甲胎蛋白的生物学功能 [J]. 世界华人消化杂志, 2011, 19(14):1436-1440.
[10] 王 川,亢渝俊,姜 政,等.水甘油通道蛋白9短发夹RNA的构建与筛选及其对非酒精性脂肪性肝病细胞模型的作用[J].中华肝脏病杂志, 2013, 21(3):222-227.
[11] Cao J, Feng XX, Yao L ,et al. Saturated free fatty acid sodium palmitate-induced lipoapoptosis by targeting glycogen synthase kinase-3β activation in human liver cells[J]. Dig Dis Sci, 2014, 59(2):346-357.
[12] Feldstein AE, Werneburg NW, Canbay A, et al. Free fatty acids promote hepatic lipotoxicity by stimulating TNF-alpha expression via a lysosomal pathway [J]. Hepatology, 2004,40(1):185-194.
[13] Wu X, Zhang L, Gurley E, et al. Prevention of free fatty acid-induced hepatic lipotoxicity by 18beta-glycyrrhetinic acid through lysosomal and mitochondrial pathways [J]. Hepatology, 2008, 47(6):1905-1915.
[14] 刘 阳, 高士争, 赵素梅. ADRP在脂滴形成中的作用 [J]. 中国医药科学, 2013, 3(8):44-46.
[15] 胡成穆,曹 琦, 李 俊. 酒精性脂肪肝脂质代谢研究进展 [J]. 安徽医药, 2012, 16 (8):1045-1047.
[16] 蒋 越, 高运臻,潘玉春,等.固醇调节元件结合蛋白及其靶基因在脂肪代谢中的研究进展 [J]. 猪业科学,2009,(11):94-98.
[17] 汤晓丽, 邓立彬,林加日,等. 固醇调节元件结合蛋白1及其靶基因网络 [J]. 遗传, 2013, 35(5):607-615.
[18] Higuchi N, Kato M, Shundo Y, et al. Liver X receptor in cooperation with SREBP-1c is a major lipid synthesis regulator in nonalcoholic fatty liver disease [J]. Hepatol Res, 2008, 38(11): 1122-1129.
