基于普鲁士蓝/碳纳米管纳米棒修饰电极用于有机磷农药检测的研究
2014-08-07黄小梅
邓 祥, 黄小梅, 吴 狄
(四川文理学院化学与化学工程系,四川达州635000)
近年来,随着国内农林业病虫害的不断发生,造成农林业大量使用农药.因有机磷农药(OPs)具有较高的药效,对植物的药害小,在人、畜体内一般不积累等特点[l],是目前国内用途最为广泛的一类农药,主要用于防治果蔬病、虫、害.但是,随着有机磷农药的大量使用,部分农药残留在环境中来不及分解,从而造成对土壤、水体的严重污染.对人类健康产生潜在的威胁.残留在环境中的农药随着食物链进入人体体内,其磷酰基与体内胆碱脂酶的活性部分进行结合,形成磷酰化胆碱酶从而使其分解乙酰胆碱的能力丧失,导致人体内乙酰胆碱大量积累,并抑制体内乙酰胆碱酯酶(AChE)的活性,致使神经传导介质:乙酞胆碱的新陈代谢紊乱,引起中枢神经调节功能异常,导致运动失调、昏迷、瘫痪甚至导致死亡等症状.所以,及时、准确地对OPs残留进行监控与检测是十分必要的.
有机磷农药残留的常用检测方法主要有:高效液相色谱(HPLC)法[2]、高效液相色谱(HPLC)-质谱(MS)法[3]和气相色谱(GC)法[4]等.上述方法虽然能对有机磷农药的残留情况进行比较准确地检测,但也存在样品处理过程复杂,检测周期长和仪器设备价格昂贵等缺陷,不能满足现场快速检测的要求.随着生物传感技术的迅猛发展,越来越多的科研技术工作者着力研发灵敏度高、方便、快捷、主要用于现场监控和检测的有机磷农药生物传感器[5-6].为了排除某些电活性物质的干扰,降低工作电位.各种各样的电子媒介体被用于生物传感器中,以期达到提高电极和生物酶之间的电子传导性能,促进电子的传递速率.但是,由于大多数电子媒介体的相对分子质量较小,实验过程中,分子量较小的电子媒介体极其容易渗漏而进入测试底液中对电极造成污染,从而对电极的响应性能产生影响.为了消除这一影响,部分研究表明将电子媒介体与其他载体相连接以增大分子量降低其渗漏现象[7].碳纳米管(MWCNTs)作为一种新型的纳米材料,由于其独特的管状结构和较强的导电性能,广泛应用于生物电分析和生物传感器的研究[8-10].碳纳米管能够缩短其与氧化还原蛋白质中氧化还原中心的距离[11-12],使电子转移更容易进行.本文选用MWCNTs为模板合成PB包埋MWCNTs的纳米棒(PB@MWCNTs).然后将PB@MWCNTs用CS分散,固定到玻碳电极上,然后通过静电吸附将乙酰胆碱酯酶(AChE)修饰于电极表面,制得的乙酰胆碱酯酶的酶抑制电流型传感器应用于本实验有机磷农药的检测研究,效果较好.该酶抑制电流型传感器主要利用PB@MWCNTs良好的导电性、吸附性和生物相容性,实现了对有机磷农药的检测.由于纳米材料间的协同作用,充分发挥了各种材料功效,使该传感器具有检测线性范围宽、灵敏度高、检测限低等优点.
1 实验部分
1.1 试剂与仪器碳纳米管(MWCNTs,中科院成都有机化学有限公司);壳聚糖(CS)、乙酰胆碱(ATCh)、乙酰胆碱酯酶(AChE)、呋喃丹均购自Sigma公司;氯化钾(KCl)、氯化铁(FeCl3)、铁氰化钾(K3Fe(CN)6)等试剂均购于成都科龙试剂有限公司.磷酸盐缓冲溶液(PBS)通过 KH2PO4-K2HPO4溶液配制而成.实验用水均为二次蒸馏水,其他试剂均为分析纯试剂.TECNAI10型透射电镜(TEM,荷兰PHILIPSFEI公司);CHI660D电化学工作站(上海辰华仪器公司);FA1004N电子天平(上海菁海仪器公司);,KQ-300VDB型超声波清洗器超声清洗机(上海谱振生物科技有限公司);pHS-4C型酸度计(成都方舟科技开发公司).
1.2 PB@MWCNTs纳米棒的制备[13]将5 mg经酸处理过的MWCNTs均匀地分散于1 mL二次蒸馏水中,然后将MWCNTs加入到5.0 mmol/L K3Fe(CN)6、5.0 mmol/L FeCl3和KCl混合溶液中并用3 mol/L HCl调节至pH约为1.5.搅拌反应20 h后,将溶液离心分离并用二蒸馏水洗涤至中性,即得PB@MWCNTs纳米棒.图1为PB@MWCNTs纳米棒的透射电镜图(TEM),由图可见PB纳米颗粒已均匀牢固地吸附于碳纳米管外管壁.

图1 PB@MWNTs纳米棒的透射电镜图Fig.1 The TEM image of PB@MWNTs nanorodes
1.3 AChE/CS-PB@MWCNTs/GCE传感器的制备实验前,将玻碳电极(GCE)表面用0.5 μm的Al2O3粉末进行抛光处理,并依次用二次蒸馏水、HNO3(1.0 mol/L)、NaOH(1.0 mol/L)、丙酮以及二次蒸馏水各超声清洗电极5 min.10 mg CS粉末溶解于5 mL质量分数1.0%的HAc溶液中,制得质量分数0.2%的CS溶液,加入5 mg PB@MWCNTs纳米棒,搅拌均匀,即制得1 mg/mL CS-PB@MWCNTs悬浊液.取10 μL CS-PB@MWCNTs悬浊液滴涂于玻碳电极表面,室温晾干.将CS-PB@MWCNTs/GCE电极置于0.3单位/mL AChE溶液中浸泡1 h后取出,用二次蒸馏水沿电极侧壁冲洗,氮气吹干备用.
1.4 AChE/CS-PB@MWCNTs/GCE传感器应用于有机磷农药的检测在5.0 mL PBS溶液中加入一定量的ATCh,使其浓度为1.0 mmol/L,搅拌5 min后,在溶液静置状态用循环伏安法进行扫描,记录下扫描过程中产生的峰电流;另取一份相同的ATCh溶液,同时加入一定量的已知浓度的有机磷农药样品,待抑制时间达到10 min后,检测有机磷农药的不同浓度情况下对峰电流的影响.利用公式计算即可得到有机磷农药对传感器的抑制率.
1.5 实际样品准备与测试采摘新鲜的卷心菜、生菜和小白菜.将蔬菜剪碎,称取其试样10.00 g,置于50 mL烧杯中,加入10 mL水和20 mL丙酮,用超声仪超声15 min.然后将超声萃取得到的悬浊液在离心机上离心分离后,取上层清液进行检测,根据由标准溶液作出的农药工作曲线,可以检测出蔬菜上的农药含量.
2 结果与讨论
2.1 AChE/CS-PB@MWCNTs/GCE传感器的电化学行为实验研究了传感器在pH 7.1的PBS中不同扫速下的循环伏安图.其结果见图2所示,扫描速度从20 mV/s到300 mV/s,氧化还原峰电流随着扫描速度的增大而增大,并且由图中可知峰电流与扫描速度的平方根成线性关系,由此可见该电极反应受表面扩散的控制.
2.2 AChE/CS-PB@MWCNTs/GCE传感器检测机理有机磷农药对AChE的催化活性具有抑制作用,导致AChE对底物催化产生的ATCh浓度下降,电流减小[14].同时随着有机磷农药质量浓度的不断增大,有机磷农药对酶电极的抑制率也不断增大.所以,通过比较AChE水解产生ATCh的氧化电流大小,可以计算得到有机磷农药对ATCh的抑制率,同时可以用来计算有机磷农药的浓度.ATCh的抑制率可由[15-16]
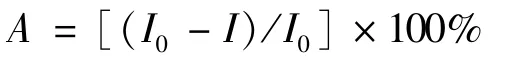
计算得出,式中,A指酶抑制率(与农药残留具有正相关性),I0为ATCh传感器对一定质量浓度的ATCh产生的稳态响应电流(空白电流),I指被毒剂抑制酶电极稳态响应电流.
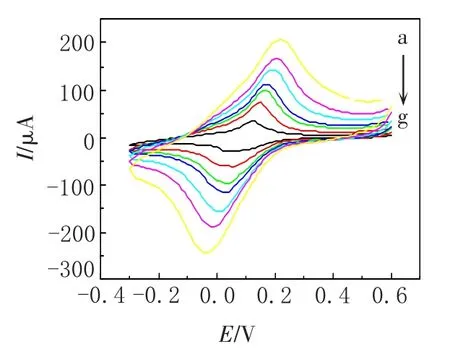
图2 传感器在pH 7.1的PBS中不同扫速的循环伏安图Fig.2 Cyclic voltammograms of the AChE/CS-PB@MWNTs/GCE modified electrode in pH 7.1 PBS solution at different scan rates
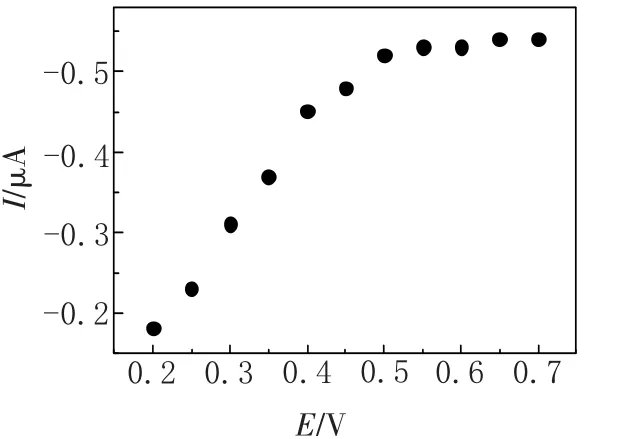
图3 电位对电流响应的影响Fig.3 Effect of potential on the amperometric response of the sensor to 1.0 mmol/L ATCh
2.3 测定条件的优化
2.3.1 pH值的影响 在实验中还考察了磷酸缓冲液的pH值对酶传感器催化ATCh电流响应的影响.在 pH值7.0~8.0之间,AChE催化活性较高[17],但pH值的增大,会导致有机磷发生水解,故选择pH值7.1的PBS缓冲液作为测试底液.
2.3.2 工作电位优化 实验考察了不同工作电位对酶传感器电流响应的影响,实验结果如图3所示.随着工作电位的逐渐增大,电流响应也不断增强,当工作电位达到0.5 V后电流的增大情况趋于稳定.由于电位过高会影响传感器的抗干扰能力,同时传感器使用寿命也会降低[18],所以实验中选择0.5 V为工作电位.
2.3.3 底物浓度的影响 底物浓度会影响检测的稳定时间,底物浓度太小,无法确保每次测量的顺利完成;底物浓度太大,又会造成残留,对第二次的检测带来影响.对底物浓度进行了优化选取,如图4可见,0.50 mmol/L和2.0 mmol/L的底物无法达到稳态的电流,以1.0 mmol/L比较适宜.
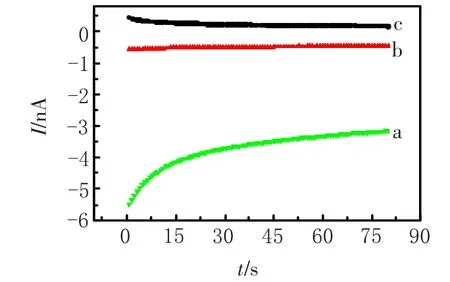
图4 不同浓度的硫代乙酰胆碱(底物)对应的电流-时间关系曲线Fig.4 Acetylthiocholine different concentrations(substrate)corresponds to the I-t curve
2.4 AChE/CS-PB@MWCNTs/GCE传感器对硫代乙酰胆碱的线性范围及其酶动力学研究在优化实验条件下,图5为AChE/CS-PB@MWCNTs/GCE传感器对不同浓度硫代乙酰胆碱的电流响应及工作曲线.图5中显示了在PBS中,连续加入不同浓度的硫代乙酰胆碱,响应电流和硫代乙酰胆碱浓度的关系.由此可知,该传感器对硫代乙酰胆碱检测的线性范围为 1.68×10-5~4.25×10-3mol/L,相关系数为0.999 2.
根据图5中传感器对硫代乙酰胆碱线性响应,利用Lineweaver-Burk公式[19]

得到乙酰胆碱酯酶的表观米氏常数Km为0.52 mmol/L.较低的米氏常数,说明通过链接反应固定的乙酰胆碱酯酶保持了良好的酶动力学响应,并且符合米氏动力学方程.

图5 连续改变不同浓度的硫代乙酰胆碱后的I-t响应及工作曲线Fig.5 Amperometric response of AchE/CS-PB@MWNTs/GCE on the addition of different concentrations of ATCh at 0.5 V in 1.0 mmol/L PBS(7.1)
2.5 农药的测定首先考察孵育时间对OPs抑制AChE效果的影响,由图6可见,从0~10 min内OPs对酶的抑制率增加迅速,随后抑制率的变化趋于稳定.即使对于极低浓度的呋喃丹,10 min的孵育时间足以使农药对酶产生10%的抑制率.为了提高此方法对OPs农药的检测效率,实验过程中的孵育时间以10 min作为标准.检测了不同浓度下有机磷农药呋喃丹对AChE活性的抑制率.由图7可见,该酶传感器对有机磷农药吠喃丹的检测范围为6~80 nmol/L,由于有文献报道10%的抑制率(I%)所对应的抑制剂浓度可以定义为理论检测限[20],因此该传感器对有机磷农药呋喃丹的检测限为3 nmol/L.
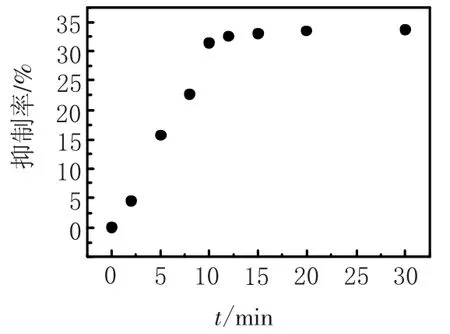
图6 不同抑制时间对传感器电流响应的影响Fig.6 The effect of the inhibition time on the response of the sensor
2.6 传感器的稳定性将制备好的酶传感器悬于PBS缓冲溶液上方,置于4℃冰箱中保存,一周内传感器对ATch的响应无明显变化,15 d后,响应电流下降了7.8%,30 d后,响应电流仍保持为86.5%,此结果表明,该酶传感器的稳定性能良好,使用寿命较长.
3 结论
本文以壳聚糖(CS)为交联剂,研究制备了PB@MWCNTs纳米棒修饰的乙酰胆碱酯酶传感器,通过酶抑制法对OPs残留进行了检测,对有机磷农药呋喃丹的检测限为3 nmol/L.制备的PB@MWCNTs纳米棒具有大的比表面积、好的导电性和优良的生物兼容性,使该传感器具有检测限低、稳定性好、灵敏度高及使用寿命长等优点,并对其它OPs也有较好的响应.因此,本方法在快速检测OPs残留的应用中有着广阔的前景.
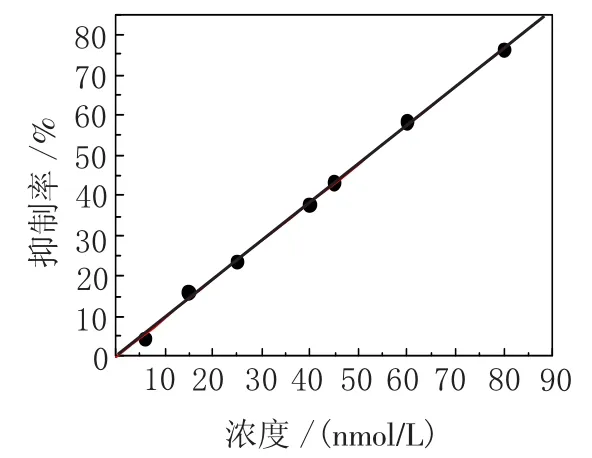
图7 不同浓度呋喃丹对乙酰胆碱酯酶活性的抑制率Fig.7 The inhibition rate of the acetylcholinesterase on the sensor with different concentrations of carbofuran
致谢四川文理学院特色植物开发研究四川省高校重点实验室项目(SCTZ201305)对本文给予了资助,谨致谢意.
[1]Okazaki S,Nakagawa H,Fukuda K,et al.Re-activation of an amperometric organophosphate pesticide biosensor by 2-pyridinealdoxime methochloride[J].Sens Actuat,2000,B66:131-134.
[2]Lacorte S,Barcelo D.Validation of an automated precolumn exchange system(PROSPEKT)coupled to liquid chromatography with diode array detection.Application to the determination of pesticides in natural waters[J].Analytica Chimica Acta,1994,296:223-234.
[3]叶瑞洪,苏建峰.分散固相萃取-超高效液相色谱-串联质谱法测定果蔬、牛奶、植物油和动物肌肉中残留的61种有机磷农药[J].色谱,2011,7:618-623.
[4]刘咏梅,王志华,储晓刚.凝胶渗透色谱净化-气相色谱分离同时测定糙米中50种有机磷农药残留[J].分析化学,2005,6:808-810.
[5]曲云鹤,肖飞,程欲晓,等.Tyr/Glu/Fe3O4/Nafion/CNT/GCE酪氨酸酶生物传感器的制备及应用于农药检测的研究[J].化学学报,2010,68:535-539.
[6]Georgiou,Claude M,Nicole J R.Early-warning electrochemical biosensor system for environmental monitoring based on enzyme inhibition[J].Sens Actuat,2005,B60:81-87.
[7]Garccia Armada M P,Losada J,CuadradoI,et al.Electrodes modified with a siloxane copolymer containing interacting ferrocenes for determination of hydrogen peroxide and glucose[J].Sensors Actuators,2003,B88:190-197.
[8]Liu Q,Lu X B,Li J,et al.Direct electrochemistry of glucose oxidase and electrochemical biosensing of glucose on quantum dots/carbon nanotubes electrodes[J].Biosens Bioelectron,2007,22:3203-3209.
[9]Chen X L,Chen J H,Deng C Y,et al.Amperometric glucose biosensor based on boron-doped carbon nanotubes modified electrode[J].Talanta,2008,76:763-767.
[10]Zhang Y,Yuan R,Chai Y Q,et al.Simultaneous voltammetric determination for DA,AA and NO2-based on graphene/polycyclodextrin/MWCNTs nanocomposite platform[J].Biosens Bioelectron,2011,26:3977-3980.
[11]Gooding J J,Wibowo R,Liu J Q,et al.Protein electrochemistry using aligned carbon nanotube arrays[J].J Am Chem Soc,2003,125:9006-9007.
[12]Liu J Q,Chou A,Rahmat W,et al.Achieving direct electrical connection to glucose oxidase using aligned single walled carbon nanotube arrays[J].Electroanal,2005,17:38-46.
[13]Zhai J F,ZhaiY M,Wen D,et al.Prussianblue/multiwalled carbon nanotube hybrids:synthesis,assembly and electrochemical behavior[J].Electroanal,2009,21:2207-2212.
[14]闵红,曲云鹤,李晓华,等.Au掺杂Fe3O4纳米粒子酶传感器的制备及其应用于有机磷农药检测的研究[J].化学学报,2007,65(20):2303-2308.
[15]Qu Y H,Sun Q,Xiao F,et al.Layer-by-Layer self-assembled aeetyleholinesterase/PAMAM-Au on CNTs modified electrode for sensing pesticides[J].Bioeleetrochemisty,2010,77:139-143
[16]孙春燕,李宏坤,平红,等.AuNPs/Sol-gel复合膜法固定乙酰胆碱酯酶生物传感器检测有机磷农药[J].高等学校化学学报,2011,11(32):2533-2538.
[17]Vangelis G A,Yannis D C.Novel fiber-optic biosensor based on immobilized glutathione S-transferase and sol-gel entrapped bromcresol green for the determination of atrazine[J].Anal Chim Acta 2002,460:151-161.
[18]Joshi K A,Tang J,Haddon R,et al.A disposaple biosensor for organophosphorus nerve agents based on car-bon nanotubes modified thick film strip electrode[J].Electroanalysis,2005,17(1):54-58.
[19]Kamin R A,Wilson G S.Rotating ring-disk enzyme electrode for biocatalysis kinetic studies and characterization of the immobilized enzyme layer[J].Anal Chem,1980,52:1198-1205.
[20]Lee H S,KimY,ChoY A.Oxidation of organophosphorus pesticides for the sensitive detection by a cholinesterase-based biosensor[J].Chemosphere,2002,46:571-576.
