改性绿茶对Pb2+的吸附性能研究
2014-08-07李华兰
尤 伟, 李华兰
(1.中南财经政法大学法学实验教学中心,湖北武汉430074;2.绵阳师范学院化学与化学工程学院,四川绵阳621000)
采矿、电镀、冶炼等行业产生的重金属离子废水进入生态环境后,不如有机物那样能被生物降解,而是通过食物链进一步富集,将对环境和人体健康造成严重的危害.含重金属离子废水的处理成为很多国家、地区环境治理的重点关注领域.传统治理重金属污染水体的物理和化学方法如离子交换法、化学吸附法、反渗透膜以及膜析法等具有费用较高、容易产生二次污染[1-2]等缺点.近年来,一些研究表明[3-6],利用来源方便、具有较好再生性和较强选择性的生物材料作为吸附剂用于吸附处理重金属离子取得了较好的效果.
茶叶表面具有多孔、网状结构、表面积大等特点,并且含有30%左右的多酚类物质,多酚类物质中具有活性羟基基团,可以与金属离子形成配合物从而将其富集并分离,利用此功能可以对水中的金属离子进行吸附处理[7].我国是产茶大国,成本低廉、来源丰富.目前,此类研究报道主要是直接利用茶叶、废弃的茶叶渣[8-12]来吸附重金属离子,对于经化学处理的茶叶运用于吸附重金属离子也有报道[13-14],但是,将绿茶改性后用于重金属铅离子的吸附还少见报道.
本文用甲醛对绿茶进行前处理改性后进行溶液中Pb2+的吸附研究,在讨论Pb2+溶液pH值、吸附时间和Pb2+初始质量浓度影响的基础上,初步探讨了改性绿茶的特殊结构与Pb2+吸附机理之间的内在联系,对Pb2+在改性绿茶上的吸附等温线、吸附动力学进行了初步研究,为茶叶在重金属废水处理领域提供理论依据.
1 材料与方法
1.1 仪器与试剂TAS-986F原子吸收光谱仪(北京普析通用仪器责任有限公司);PHS-25酸度计(上海理达仪器公司);KS康氏振荡器(上海精密仪器仪表有限公司);101A-2电热恒温干燥箱(杭州汇普化工仪器有限公司);AUW220电子天平(日本岛津科技有限公司).铅粉(上海山浦化工有限公司)、硫酸、盐酸、甲醛(开封东大化工有限公司);氢氧化钠、氯化钙(天津市东丽区泰兰德化学试剂厂),以上化学试剂均为分析纯;绿茶(产地为河南信阳).
1.2 改性绿茶的制备按每克茶叶量加入5 mL甲醛、20 mL 0.02 mol/L H2SO4,在康氏震荡器上充分混匀后,置于60℃水浴回流2 h,将茶叶以蒸馏水清洗数遍后滤出茶叶,置于80℃电热恒温干燥箱中烘干;再按每克茶叶量加入20 mL 0.02 mol/L NaOH溶液,浸泡1 h后过滤,以蒸馏水洗至中性,置于电热恒温干燥箱中,110℃处理6 h,将干燥后的茶叶研细,过80目分样筛备用.
1.3 Pb2+溶液配制称取一定量的铅粉加入适量稀硝酸定容、稀释成一系列的Pb2+校准溶液,并分别用原子吸收光谱仪测定各标准溶液吸光度,绘制吸光度-Pb2+质量浓度校准曲线.本实验所用的Pb2+溶液均以标准溶液用去离子水、HCl溶液、NaOH溶液调节至所需要的pH值.
1.4 实验方法
1.4.1 溶液pH值对Pb2+吸附率的影响 称取7份0.50 g处理后的茶叶,于具塞锥形瓶中,对应加入 pH 值为2.0、3.0、3.5、4.0、4.5、5.0 和5.5 的50 mg/L Pb2+溶液150 mL,在康氏震荡器上充分震荡90 min后,过滤,离心,分别测定各滤液中Pb2+含量,计算不同pH值下改性绿茶对Pb2+的吸附率.
1.4.2 吸附时间对Pb2+吸附率的影响 称取7份0.50 g处理后的茶叶,于具塞锥形瓶中,分别加入pH值为4.5的50 mg/L Pb2+溶液150 mL,置于康氏震荡器上,分别震荡 15、30、45、60、90、120、150和180 min,其余操作同上,计算不同吸附时间下改性绿茶对Pb2+的吸附率.
1.4.3 Pb2+初始质量浓度对Pb2+吸附率的影响称取7份0.50 g处理后的茶叶,于具塞锥形瓶中,分别加入pH值为4.5初始质量浓度分别为5、10、20、30、40、50、100 和 200 mg/L 的 Pb2+溶液各 150 mL,其余操作同上,计算不同Pb2+初始质量浓度下改性绿茶对Pb2+的吸附量与吸附率.
2 结果与讨论
2.1 溶液pH值对吸附率的影响图1显示了待吸附Pb2+溶液的pH值变化对吸附率的影响.由图可知,随着待吸附溶液的pH值升高,改性绿茶对Pb2+的吸附率增加,在pH值为4.5时达到最大值77.37%;但是当溶液pH值超过4.5之后,改性绿茶对Pb2+吸附率逐渐降低.当溶液pH值较低时,溶液中H+浓度较高,茶叶分子中的羟基、羧基电离受到抑制,不利于形成稳定的配合物;随着pH值逐渐升高,H+浓度降低,茶叶分子中的羟基、羧基以离子形态(—O-、—COO-)存在,并且与金属离子的配合能力也随之提高,吸附率逐渐增大[11];随着pH值继续增大(本实验中pH>4.5),溶液中逐渐增多的OH-与茶叶中的活性吸附位点竞争而使吸附率降低.由此可见,pH值对于改性绿茶吸附Pb2+效果的影响较大,pH值在3.5~5.5之间均可以达到70%以上的吸附率,而这也正是大多数电镀厂直接排放出电镀废水的pH值范围.
2.2 吸附时间对吸附率的影响从图2可知,Pb2+的吸附率首先随反应时间增加而迅速增大,在90 min时达到最大值;达到150 min时,吸附率略有下降,但总的趋势趋于稳定;超过150 min,吸附率下降较快.由此得出,最佳的吸附时间在90 min.这是由于在吸附初期,改性绿茶本身含有大量酚类衍生物对于重金属离子的配合作用,改性后茶叶特有的网状、多孔的特殊结构及其含有大量的自由基和不饱和离子,孔道效应明显,导致了对于Pb2+迅速的吸附作用,吸附率迅速提高;随着时间增加,孔道趋于饱和以及溶液中离子结合与交换也同时趋于饱和,因此,吸附率趋于稳定;在本实验研究中,150 min后出现了吸附率略有下降的原因,可能是由于过长的接触震荡时间导致金属离子之间的斥力增大而出现了部分脱附现象.
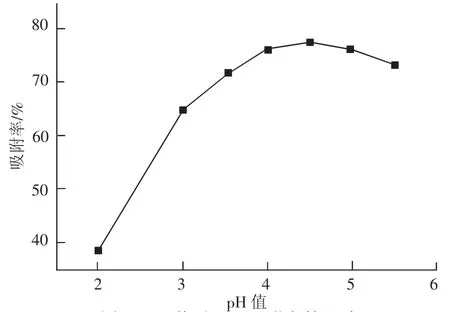
图1 pH值对Pb2+吸附率的影响Fig.1 Effect of pH value on adsorption rate of Pb2+
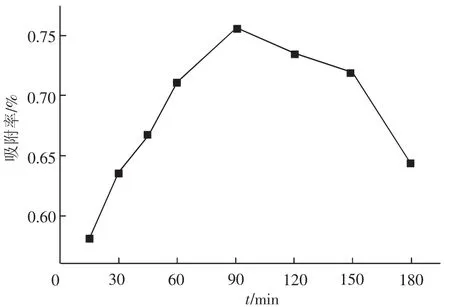
图2 吸附时间对Pb2+吸附率的影响Fig.2 Effect of time on adsorption rate of Pb2+
2.3 Pb2+初始质量浓度对茶叶吸附能力的影响由图3可以得到,Pb2+质量浓度对吸附量有较大的影响,当Pb2+初始质量浓度从5 mg/L提高到200 mg/L时,改性绿茶的单位吸附量从1.44 mg/g增加到12.5 mg/g,表明当Pb2+质量浓度为5~50 mg/L时,改性绿茶的单位吸附量未达到饱和状态,随着Pb2+质量浓度的升高,茶叶表面液膜和溶液本体之间存在着较大的质量浓度差促使Pb2+向茶叶表面移动从而被吸附.但是继续增大Pb2+质量浓度,改性绿茶表面的活性基团已基本达到饱和状态,因此,其吸附量不会随着Pb2+质量浓度的升高而显著增大.
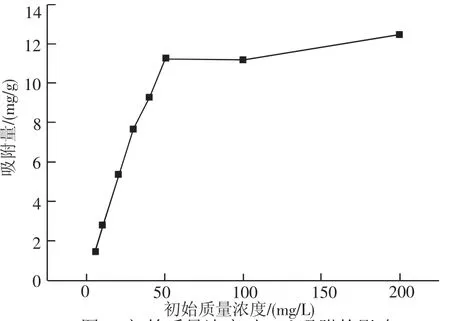
图3 初始质量浓度对Pb2+吸附的影响Fig.3 Effect of initial concentration on adsorption quantity of Pb2+
2.4 吸附动力学研究研究固液静态吸附动力学主要是研究吸附量对时间的动力学曲线.目前常用来探讨吸附过程机理的动力学模型有准一级动力学模型和准二级动力学模型等.本研究采用Y.S.Ho等[15]的准二级吸附速率方程式进行积分、重新进行变换后得到方程为
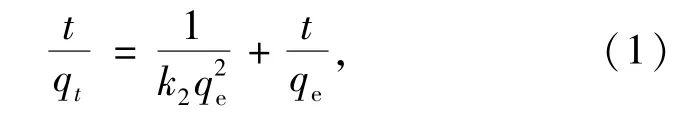
其中,qe/(mg/g)为平衡吸附量;qt/(mg/g)为t时刻吸附量;k2/(g·mg-1·min-1)为二级吸附率常数.由于本实验在180 min后出现了明显脱附现象,本次拟合时间范围在15~150 min进行.根据(1)式作t/qt-t图,如图4所示,直线拟合方程为t/qt=0.088t+0.381,拟合出的直线有很好的线性相关性,相关系数r达到0.998 4,计算出吸附动力学二级速率常数k2为0.020 3 g·mg-1·min-1,qe=11.36 mg/g.
2.5 等温吸附研究吸附平衡决定被吸附组分在吸附剂上的极限吸附量,一般用吸附等温线来描述吸附平衡.本文采用吸附等温线:Langmuir方程来拟合图3中的实验数据.Langmuir吸附等温方程为
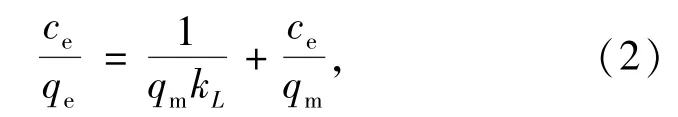
其中,ce/(mg/L)为平衡质量浓度,qe/(mg/g)为平衡吸附量;qm/(mg/g)为吸附剂的饱和吸附量;kL/(L/mg)为表征吸附表面强度的常数.按照(2)式拟合,结果见图5,拟合得到的直线具有较好的线性关系,相关系数r为0.998 9,拟合的方程为ceqe=0.079ce+0.226,由此计算出qm为12.6 mg/g,吸附常数kL为56.01 L/mg.可以推断,在本实验条件下,改性绿茶对Pb2+的吸附很好地符合Langmuir等温线模型的变化规律,Pb2+吸附在改性绿茶的活性位点上属于单层吸附.

图4 准二级吸附动力学线性相关图Fig.4 The linera correlation diagram of preudosecond-order adsorption kinetic model

图5 Langmuir型吸附等温线Fig.5 Langmuir isothermal adsorption curve
3 结论
以甲醛改性后的绿茶茶叶吸附溶液中Pb2+进行研究,结果表明,改性绿茶对Pb2+有着较强的吸附能力,Pb2+溶液的pH值、吸附时间、初始质量浓度均影响吸附率.
1)Pb2+溶液在pH值为4.5时,改性绿茶对Pb2+的吸附率最高.
2)当吸附时间在90 min时,吸附基本达到平衡,此时绿茶对Pb2+的吸附率最高;若继续增加时间,吸附率增加缓慢,在150 min后出现了部分Pb2+脱附的现象.
3)Pb2+初始质量浓度增加可以显著增加改性绿茶的吸附能力,但是当Pb2+初始质量浓度超过50 mg/L后,改性绿茶很快趋近于饱和吸附量(12.6 mg/g),继续增大初始质量浓度对于吸附并无显著影响.
4)Pb2+在改性绿茶上的吸附动力学符合准二级动力学方程式(r=0.998 4);等温吸附行为可以用Langmuir等温方程来描述(r=0.998 9).
[1]张少峰,胡熙恩.含铅废水处理技术及其展望[J].环境污染治理技术与设备,2003,4(11):68-71.
[2]杨正亮,冯贵颖,呼世斌.水体重金属污染研究现状及治理技术[J].干旱地区农业研究,2005,23(1):219-222.
[3]曹军,尤雅婷,徐国想.海带吸附铜、镍离子的研究[J].安徽农业科学,2010,38(14):7435-7436.
[4]秦益民,陈洁,宋静,等.改性海带对铜离子的吸附性能[J].环境科学与技术,2009,32(5):147-149.
[5]张进忠,罗爱民,周志峰,等.小球藻吸附汞离子的研究[J].西南大学学报:自然科学版,2009,31(1):155-160.
[6]章明奎,方利平.利用非活体生物质去除废水中重金属的研究[J].生态环境,2006,15(5):897-900.
[7]Mahvi A H.Tea waste as an adsorbent for heavy metal removal from industrial waste waters[J].Am J Appl Sci,2005,2(1):372-375.
[8]谢小风,周发连,杨小冰.绿茶对金(Ⅲ)、锗(Ⅳ)离子捕集性能的研究[J].分析试验室,2001,20(6):41-44.
[9]钱国勇,侯明,汪菊玲.绿茶对水溶液中Pb2+和Cd2+吸附性能初步研究[J].分析试验室,2008,27(1):63-66.
[10]何猛雄,李承琳,李改仙.茶叶渣对Cu(Ⅱ)的吸附研究[J].海南师范大学学报:自然科学版,2009,22(3):283-285.
[11]张军科,郝庆菊,江长胜,等.废弃茶叶渣对废水中铅(Ⅱ)和镉(Ⅱ)的吸附研究[J].中国农学通报,2009,25(4):256-259.
[12]谢红梅,周桂林,娄泽鹏.废弃茶叶脱除废水中Cr6+效果研究[J].云南农业大学学报:自然科学版,2010,25(5):675-679.
[13]董娴连,慧亮,耿世彬.废弃绿茶对水溶液中Co2+的吸附研究[J].环境污染与防治,2012,34(5):72-75.
[14]侯明,钱建平,胡存杰,等.改性绿茶对汞的吸附作用[J].广西科学,2002,9(4):298-301.
[15]Ho Y S,McKay G.The sorption of lead(Ⅱ)ions on peat[J].Water Res,1999,33(2):578-584.
