手性HPCE整体柱非衍生化法拆分苯丙氨酸
2014-08-06沈静茹吴天骄余学红柯雅莉
沈静茹,张 祎,吴天骄,余学红,柯雅莉
(1 中南民族大学 化学与材料科学学院分析化学国家民委重点实验室;2 中南民族大学 校医院,武汉 430074)
苯丙氨酸又称α-氨基-β-苯丙酸(缩写phe),有一个手性碳(图1),一对对映异构体.L-苯丙氨酸具有生物活性,是高血压、心脏病、糖尿病人理想的甜味剂,还是合成抗病毒和抗癌药物的原料;D-苯丙氨酸能增加人体的免疫功能,具有强的镇痛作用,还可作为生产艾滋病毒抑制剂的药物中间体,被广泛应用[1].高效毛细管电泳(HPCE)法成为商用仪器后[2],因其分离效率高、分析时间短和样品用量少等特点,大规模用于分离分析,特别是在手性化合物的分析测定方面[3,4].Zou Min等[5]使用HPCE仪,通过监控溶质的紫外吸收峰和计算扩散系数的效率关系,建立了测量苯丙氨酸含量的方法.Li Q等[6]在FITC荧光标注氨基酸后,用高速自动化HPCE系统检测苯丙氨酸样品.Yang BC等[7]也采用荧光标记样品,HPCE分离检测苯丙氨酸含量.Li Lian等[8]用加热法制成均一稳定的硅胶毛细管微柱,采用凝胶电泳技术分离苯丙氨酸,上述方法均只适用于外消旋体的含量测定.人工合成的苯丙氨酸多为外消旋体,传统的拆分方法中,苯丙氨酸的分离大都通过手性衍生的间接方法[9].β-环糊精(β-CD)及其衍生物是常用的手性选择剂[10-12],通过在β-CD支链上引入特定的结构侧链和官能团来提高手性分离能力.Li等[13]采用PLS最小二乘法结合紫外可见光谱测量苯丙氨酸对映体含量,该法将样品衍生,通过化学计量法推算单一对映体的含量.近年来,有一些HPCE拆分苯丙氨酸的工作,如张春雨等[14]以DOCB-β-CD作为流动相手性添加剂,利用HPCE对氨基酸和手性药物对映体进行拆分研究,D,L-苯丙氨酸达到基线分离,该法需消耗大量手性添加剂,且操作繁琐.
本文利用自制的双-(6-氧-间羧基苯磺酰基)-β-CD(简称β-CD-M1)作为手性选择剂,不仅保留了β-CD疏水空腔的立体选择性,而且引入了羧基和苯磺酰基,使β-CD衍生物具有良好的水溶性,将其作为固定相中单体,制备出性质稳定的HPCE有机整体柱,用于拆分苯丙氨酸,无需样品柱前衍生,找到了最佳的分离条件,分离度Rs可达4.46.该方法为分离该対映异构体及其单一对映体含量测定提供了一种HPCE整体柱拆分的新思路.同时,方法简单、高效、低消耗,且符合绿色化学要求.
图1 苯丙氨酸的结构Fig.1 The structure of phenylalanine
1 实验部分
1.1 主要仪器和试剂
高效毛细管电泳仪(P/ACETMMDQ型, 美国BACKMAN),酸度计(ZD-2型, 自动电位滴定仪,上海伟业仪器厂),超声波清洗器(KS-80D型,宁波科生仪器厂),电子分析天平(FA2004型, 上海舜宇恒平科学仪器有限公司),电磁搅拌器(7901型,上海华光仪器仪表厂),融硅石英毛细管(75μm ID, 有效长度
55cm, 河北永年光纤厂),微孔滤膜(0.22 μm,上海市新亚净化仪器厂) .
三羟甲基氨基甲烷(Tris, 上海山浦化工有限公司),磷酸(天津市科密欧化学试剂有限公司),盐酸(信阳市化学试剂厂),D-苯丙氨酸(上海晶纯试剂有限公司),L-苯丙氨酸(武汉中合科技发展有限公司), 超纯水(美国 Moleculer 超纯水机), 双-(6-氧-间羧基苯磺酰基)-β-环糊精(按文献[15]合成),其他试剂均为分析纯.
1.2 电泳条件
电泳柱:双-(6-氧-间羧基苯磺酰基)-β-CD (β-CD-M1)制备的整体柱(参照文献[16]制备);流动相:Tris-H3PO4缓冲液, 按实验需要配置成不同浓度和pH;所有溶液均经0.22 μm的微孔滤膜过滤;设置好分离电压和检测波长,电泳整体柱每次运行前,用Tris-H3PO4缓冲液冲洗1h,采用压力进样;所有溶液均在室温下配制.
2 结果与讨论
2.1 缓冲液pH值对分离的影响
在β-CD-M1衍生物HPCE整体柱上,检测波长选择254 nm,工作电压25 kV,6.2×10-3mol/L苯丙氨酸,进样压力0.5 psi,进样时间10 s,柱温25 ℃,缓冲液Tris-H3PO4的总浓度50 mmol/L的电泳条件下,改变缓冲液的pH值,依次为2.5、2.6、2.9、3.0、3.2、3.6、3.8、4.0、4.2、4.4、4.6、4.8、4.9、5.0,两对映体拆分的HPCE结果如图2所示.

a) pH 3.0;b) pH 3.2;c) pH 3.7;d) pH 4.6;e) pH 4.8;f) pH 5.0图2 缓冲液pH对苯丙氨酸手性分离的影响Fig.2 Effect of the buffer pH on the separation of phenylalanine enantioseparation
酸度对分离度影响结果如图3所示.由图3可见,当pH≤3.0(pH 2.5~3.0)时,苯丙氨酸两对映体无拆分迹象;随着pH值的增大,苯丙氨酸对映体开始分离,且基线平稳.pH≥5.0时,也无法拆分苯丙氨酸对映异构体.苯丙氨酸的等电点pI为5.48,缓冲液pH值的变化影响了苯丙氨酸两对映体表面的带电量,进而改变了两对映体在电场中的迁移速度.当缓冲液的pH<5.48时,溶质荷净正电荷,仅在pH 3.4~4.8的环境下两对映体带电量差异较大,粒子迁移的总速度为电泳淌度和电渗流之和,在此酸度范围内整体柱有手性分离苯丙氨酸的能力.当pH为4.6时,苯丙氨酸对映体完全分离,分离度Rs值最大,前后峰对称性良好,洗脱强度和基线均较理想.故选取pH4.6为缓冲液的最佳分离pH值,最佳分离酸度范围为pH 3.4~4.8.

图3 不同pH对苯丙氨酸分离度的影响Fig.3 Effect of different pH buffers on the separation of phenylalanine enantioseparation
2.2 缓冲液浓度对分离的影响
在β-CD-M1衍生物HPCE整体柱上,检测波长选择254 nm,工作电压25 kV,6.2×10-3mol/L苯丙氨酸,进样压力0.5 psi,进样时间10 s,柱温25 ℃,pH 4.6缓冲液Tris-H3PO4的电泳条件下,改变缓冲液Tris-H3PO4的浓度分别为20,30,40, 50, 60 mmol/L,分离结果如图4所示.

a) 40 mm/L;b) 50 mm/L;c) 60 mm/L图4 缓冲液浓度对苯丙氨酸手性分离的影响Fig.4 Effect of the buffer concentration on the separation of phenylalanine enantioseparation
上述条件下分离度数据如表1.由表1可见,随着缓冲液浓度的增大,溶液粘度增大,电渗流降低,苯丙氨酸在毛细管内的迁移时间延长.在2.2实验条件考察中,当缓冲液浓度高于60 mmol/L,后峰的出峰时间在60 min之后,实际分析中不适用;当浓度低于30 mmol/L的情况时,两峰部分重叠,未达到基线分离.故缓冲液浓度为50 mmol/L为最佳分离浓度,此时缓冲液对苯丙氨酸两对映体的洗脱强度适宜,分析时间和分离度适中,基线平稳,对映体达到完全分离.

表1 不同缓冲液浓度对苯丙氨酸对映体分离的影响
2.3 不同电压对分离的影响
在β-CD-M1衍生物HPCE整体柱上,检测波长选择254 nm,6.2×10-3mol/L苯丙氨酸,进样压力0.5 psi,进样时间10 s,柱温25 ℃,缓冲液Tris-H3PO450 mol/L,pH 4.6的电泳条件下,分别考察电压为23、25、28 kV时苯丙氨酸的分离情况,如图5所示.由图5可见,电压为25 kV时基线平稳,分析时间适当,分离度大.故最佳分离电压为25 kV.

a ) 23 kV;b) 25 kV;c) 28 kV图5 电压对苯丙氨酸对映体分离的影响Fig.5 Effect of voltages on the separation of phenylalanine enantioseparation
2.4 方法评价
2.4.1 苯丙氨酸对映体拆分的线性范围
在β-CD-M1为单体制备的手性HPCE整体柱上,Tris-H3PO4缓冲液50 mmol/L,pH 4.6,进样0.5 psi,10 s,分离电压25 kV,检测波长254 nm,柱温25 ℃,用浓度为2.1×10-3~1.0509×10-2mol/L苯丙氨酸标准品水溶液,考察苯丙氨酸的线性范围,L-苯丙氨酸峰高-浓度线性关系为y=4.55×102+3.12×105x,线性相关系数r=0.9916;峰面积-浓度线性关系为y=5.25×103+5.00×106x,线性相关系数r=0.9942;D-苯丙氨酸峰高-浓度线性关系为y= 4.68×102+1.24×104x,线性相关系数r=0.9952;峰面积-浓度线性关系为y=1.29×104+1.42×106x,线性相关系数r=0.9341.由此初步确定,若以峰高为定量参数可定量测定苯丙氨酸两对映体的含量,若以峰面积为定量参数则只能对L-苯丙氨酸进行定量测定.
2.4.2对比实验
在HPCE最佳分离条件下,用纯水作对照实验,进纯水样时基线平稳,排除了样品配置中水溶液在同一分离条件下的影响.分别在β-CD-M1衍生物HPCE整体柱和空毛细管电泳柱中对比了拆分苯丙氨酸两对映体的分离情况.在空毛细管电泳柱上用同样的Tris-H3PO4缓冲液,无法洗脱苯丙氨酸两对映体,如图6曲线b所示,而该缓冲液在β-CD-M1衍生物HPCE整体柱上,在最佳分离条件下,不仅对两对映体有较强的洗脱能力,还有较好的拆分效果,如图6曲线a所示,D,L苯丙氨酸两对映体分离度可达到4.46.
3 结语
制备了β-CD-M1手性HPCE整体柱,将其用于拆分D,L-苯丙氨酸,考察了缓冲液的酸度、浓度和分离电压等条件对分离的影响,对比了空柱的分离效果,建立了新的高效毛细管电泳手性整体柱拆分无衍生化苯丙氨酸的方法.结果表明:通过对β-CD改性,用间羧基苯磺酰基修饰后,弥补了β-CD自身的不足.苯丙氨酸结构中的苯环能在β-CD衍生物的腔体内产生包合作用,与衍生物上的苯环也可产生π-π共轭作用,同时,样品中存在的羧基、氨基基团能与衍生物中的羟基、羧基等极性基团产生相互诱导的极化作用,使苯丙氨酸对映异构体在适宜的条件下达到完全分离.实验结果重现性好,在pH 4.6, 50 mmol/L的Tris- H3PO4缓冲液中进样0.5 psi、10 s,工作电压25 kV,检测波长254 nm条件下,D,L苯丙氨酸两对映体得到基线分离,分离度Rs达到4.46.
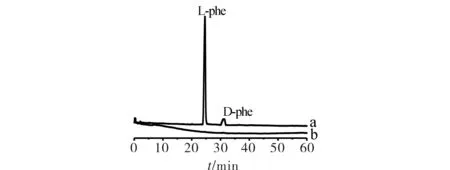
a)整体柱;b)空柱图6 苯丙氨酸对映体在不同毛细管柱下的分离Fig.6 The separation of phenylalanine enantioseparation with different column
参 考 文 献
[1] Pogson C I, Knowles R G, Salter M. The control of aromatic amino acid catabolism and its relationship to neurotransmitter amine synthesis[J]. Crit Rev Neurobiol, 1989, 5(1): 29-64.
[2] Cemil Aydogan, Fatma Yilmaz, Duygu Cimen, et al. Enantioseparation of aromatic amino acids using CEC monolith with novel chiral selector, N-methacryloyl- L -histidine methyl ester[J]. Electrophoresis, 2013, 34(13): 1908-1914.
[3] Allen D, Rassi Z E. Silica-based monoliths for capillary electrochromatography: methods of fabrication and their applications in analytical separations[J]. Electrophoresis, 2003, 24(22/23): 3962-3976.
[4] Weinberger R. Practical capillary electrophoresis[M]. Academic Press: Amsterdam, 2000.
[5] Zou M,Han Y L, Qi L,et al.Fast and accurate measurement of diffusion coefficient by Taylor′s dispersion analysis[J]. Chin Sci Bull, 2007, 52(24):3325-3332.
[6] Li Q, Zhang T, Zhu Y Q, et al. Automated high-speed CE system for multiple samples[J]. Electrophoresis, 2013, 34(4): 557-561.
[7] Yang B C, Tan F, Guan Y F. A laser diode double-pumped solid-state laser-induced fluorescence detector for capillary electrophoresisand liquid chromatography[J]. LCGC North America, 2005, 23(10): 1100-1112.
[8] Li L, He Y Z, Gan W E, et al. Electrophoretic separa-tion with 2-mm inner diameter fused-silica microcolumn packed with quartz microncrystals and its application[J]. Talanta, 2009, 79(2): 460-465.
[9] István Ilisz, Anita Aranyi, Antal Péter. Chiral derivati-zations applied for the separation of unusual amino acid enantiomers by liquid chromatography and related techniques[J]. J Chromatogr A, 2013, 1296(28):119-139.
[10] Reijenga J C, Ingelse B A, Everaerts F M. Thermody-namics of chiral selectivity in capillary electrophoresis: separation of ibuprofen enantiomers withβ-cyclodextrin[J].J Chromatogr A, 1997, 792(1/2) : 371-378.
[11] Wang H S, Jiang P, Zhang M, et al. Synthesis of a novel restriacted access chiral stationary phase based on atom transfer radical polymerization and click chemistry for the analysis of chiral drugs in biological matrices[J].J Chromatogr A, 2011, 1218(9): 1310-1313.
[12] Tian Y, Zhong C, Fu E, et al. Novel beta-cyclodextrin derivative functionalized polymethacrylate-based monolithic columns for enantioselective separation of ibuprofen and naproxen enantiomers in capillary electrochromatography[J]. J Chromatogr A, 2009, 1216(6): 1000-1007.
[13] Li Q, Duan J, WU L J, et al. Sucrose as chiral selector for determining enantiomeric composition of phenyla-lanine by UV-vis spectroscopy and chemometrics[J]. Chin Chem Lett, 2012, 23(9): 1055-1058.
[14] 张春雨, 李英杰, 郝秀菊,等. 毛细管电泳法手性拆分4种氨基酸和2种手性药物对映体[J]. 应用化学, 2011, 28(11): 1055-1058.
[15] 丁志刚, 刘学群, 詹国庆, 等.β-CD与间羧基苯磺酰氯及Fe3+构筑氧化还原酶[J]. 化学学报, 1995, 53(6): 578-582.
[16] 蔡 薇. 双-(6-氧间羧基苯磺酰基)-β-环糊精HPCE整体柱拆分手性药物[D]. 武汉: 中南民族大学, 2013.
