毛细管电泳法测定水体中四环素类抗生素的基质效应及场放大进样技术的应用
2014-08-03李爱梅卢文平徐中其
李爱梅, 黄 茁, 卢文平, 徐中其,3*
(1.东华大学化学化工与生物工程学院,上海201620;2.长江水利委员会长江科学院,湖北武汉430010;3.生态纺织教育部重点实验室,上海201620)
由于污水处理能力的限制以及畜牧水产养殖中的直接排放,环境水体中药品与个人护理用品(pharmaceuticaland personalcare products,PPCPs)的残留是当前环境领域关注的焦点问题[1]。抗生素是一种常见的PPCPs,特别是四环素类抗生素(tetracyclines,TCs),其价格低廉,常被广泛用于动物疾病的治疗,并长期以亚治疗剂量添加于动物饲料中用于动物疾病的预防和促进动物生长,是目前用量最大且使用最为广泛的药物之一,其长期、大量、持续性地排放会造成水环境抗生素“假性持久性”污染,对生态环境以及人类健康造成危害[2]。因此,对环境水体中的 TCs,包括四环素(tetracycline,TC)、金 霉 素 (chlortetracycline,CTC)、土霉素(oxytetracycline,OTC)及强力霉素(doxycycline,DC)的监测具有非常重要的意义。
目前,对 TCs的监测主要集中在鱼肉[3]、蜂蜜[4]及牛奶[5]等食品领域。环境水体中 TCs的残留浓度较低且基质成分复杂,通常需要繁琐的前处理过程,如采用 C18 柱[6]、HLB 柱[6,7]以及双柱串联[8,9]等固相萃取(SPE)技术萃取富集水环境中的抗生素;其分离主要采用高效液相色谱(HPLC)配合紫外(UV)[8]、质谱(MS)[9-11]、荧光(FLD)[12]等检测技术或酶联免疫[13]等方法。刘虹等[8]采用SPE-HPLC-UV技术检测了水、沉积物和土壤中的氯霉素和3种 TCs,检出限(LOD)在18~32 μg/L之间;魏瑞成等[11]采用SPE-HPLC-MS技术对江苏省畜禽养殖场水环境中的TCs进行了测定,TCs的检出率在17.0%~60.4%之间,质量浓度在0.07~72.9 μg/L之间。HPLC-MS联用技术具有良好的灵敏度及选择性,但仪器价格昂贵;免疫检测虽然成本低、速度快,但灵敏度不够。毛细管电泳(CE)技术具有样品前处理简单、试剂消耗少(μL级别)与样品用量小(nL级别)、分离速度快及分离效能高等优点,能够满足水环境快速监测的要求,降低采样和运送难度以及环境污染和对分析人员的伤害,是进行水环境分析的一种有效手段。虽然CE的重现性和灵敏度(UV检测)不高,但在许多方面CE拥有超越HPLC的能力,是仍在不断发展的重要分离技术[14,15]。为了提高 CE分析的灵敏度,可以结合SPE样品前处理技术,或者使用高灵敏的检测技术,如质谱[14]、电致化学发光[16]、化学发光[17]、激光诱导荧光[18]等。Miranda等[19]用 SPE 和离子交换树脂两种预处理方法,采用CE-UV检测了鸡肉中的TC、OTC、DC的含量,LOD最低可达 61~68 μg/kg。此外,CE柱内预浓缩技术(stacking)也是有效提高灵敏度的途径之一。Wang等[20]采用场放大电动进样模式(field-amplified sample injection,FASI)柱内预浓缩技术,结合MS检测了牛奶中TC、CTC及OTC的含量,LOD可达到7.14~14.9 μg/L。
本研究采用压力进样技术(hydrodynamic injection,HDI)发展了对水体中4种TCs的CE分离方法;在UV检测条件下,综合对比并评价了CE与HPLC这两种分离技术对TCs的分析效率、重现性和灵敏度方面的优劣;探究了水体基质(如pH和水硬度)对TCs分离的影响;研究了FASI柱内预浓缩技术提高CE对TCs分析灵敏度的可行性。
1 实验部分
1.1 仪器与试剂
P/ACETMMDQ毛细管电泳仪(美国贝克曼库尔特公司),配光电二极管阵列(PDA)检测器,波长范围为190~600 nm,数据处理使用其自带的32 Karat软件。非涂层石英毛细管(60 cm(有效长度50 cm)×75 μm,河北永年锐沣色谱器件公司)。LC-20AT HPLC色谱仪,配SPD-20A型UV检测器(日本岛津公司)。
标准样品为各盐酸四环素类抗生素,包括TC、OTC、CTC和DC,购于上海麦仓生物科技有限公司;甲醇和乙腈均为色谱纯(Adamas公司);其他试剂如 Na2HPO4·12H2O、NaOH、Na2EDTA·2H2O、草酸、硫酸镁及无水氯化钙均为分析纯,购自国药集团化学试剂有限公司。
1.2 标准溶液及缓冲溶液的配制
准确称取适量的TCs标准物质,用甲醇配成0.10 g/L的储备液,置于-18℃冰箱中避光保存。CE实验前,用超纯水稀释混合标准溶液至所需的浓度;HPLC实验前,用流动相稀释混合标准溶液至所需浓度。
CE背景缓冲电解液(background electrolyte,BGE)为30 mmol/L Na2HPO4+1.5 mmol/L Na2EDTA,用1.0 mol/L NaOH溶液调pH至11.0。为了保证BGE的稳定性,需每周配制,并用0.22 μm的微孔滤膜过滤。
模拟水体不同的pH值由缓冲溶液控制:pH 2.0~3.0(30 mmol/L NaH2PO4+30 mmol/L H3PO4);pH 3.5~6.0(30 mmol/L柠檬酸钠+30 mmol/L柠檬酸);pH 7.0~9.0(30 mmol/L Tris+1.0 mol/L HCl);pH 9.5~10.0(30 mmol/L Na2B4O7+1.0 mol/L NaOH);pH 11.0~12.0(30 mmol/L Na2HPO4+1.0 mol/L NaOH)。
1.3 实验方法
1.3.1 CE 条件
新毛细管分别用超纯水、甲醇、超纯水、1.0 mol/L NaOH 及超纯水冲洗 3.0、3.0、3.0、30、2.0 min后开始实验;连续分析过程中,每次分析前用超纯水、BGE各冲洗3.0 min。HDI进样模式的压力为3.45 kPa(0.5 psi),持续5.0 s;FASI进样模式下进样端施加电压为+10 kV,持续2.0 min。CE分离电压为+20 kV。毛细管采用液冷方式控制温度为25℃,TCs的检测波长为275 nm。
1.3.2 HPLC 分离条件
色谱柱为InerSustain C18(250 mm×4.6 mm,5 μm)(日本岛津公司),流动相为水-甲醇-乙腈(70∶10∶20,v/v/v;含 0.01 mol/L 的草酸,pH 2.13),流速为1.0 mL/min,进样量为 20 μL,柱温为 30℃,UV检测波长为275 nm。
1.3.3 环境水样品的前处理
实际水样品分别为上海松江家庭饮用自来水及某鱼塘水,采集后经0.22 μm的滤膜过滤后直接用于测定。
2 结果与讨论
2.1 CE分离条件的优化
2.1.1 缓冲液pH和浓度
TCs为氢化并四苯环衍生物,含有酚羟基、酰氨基(-CONH2)和二甲氨基(-N(CH3)2)等官能团,是一种酸碱两性化合物。图1和表1为TCs的结构式及在水溶液中的三级平衡常数[21],可见4种TCs具有相似的化学性质和相近的各级pKa值。CE是基于带电离子在电场下淌度的差异而分离,所以缓冲溶液的pH选择对TCs的分离尤为重要。TCs分离的常用缓冲体系主要有磷酸体系[19]和硼酸体系[4],前者因缓冲范围广而较受欢迎。本实验为了了解磷酸缓冲体系对TCs分离的影响,详细考察了浓度为30 mmol/L Na2HPO4,用1.0 mol/L柠檬酸或1.0 mol/L NaOH调节pH为2.5~12(间隔pH为0.5)情况下,TCs水溶液的分离情况。实验表明:当pH小于10.0时,目标物不能完全分离;当pH介于10.5~11.5之间时,4种TCs可以达到基线分离且峰形良好(见图2)。本实验在该pH范围内更仔细地考察了pH(间隔pH为0.2)对TCs的分离影响,发现:随着 pH值增大,TC、OTC和 DC的峰形变化不明显,但CTC在11.0时峰最高。根据CTC在强碱性条件下容易形成内酯结构的异氯四环素的性质[22],BGE碱性增强易削弱CTC自身结构的峰信号,所以确定 BGE的最佳 pH值为11.0。在该条件下4种TCs均以阴离子形式存在,且药物相对稳定,分离选择性好,平均分离度(Rs)为2.78。

图1 四环素类抗生素的化学结构Fig.1 Chemical structure of tetracyclines
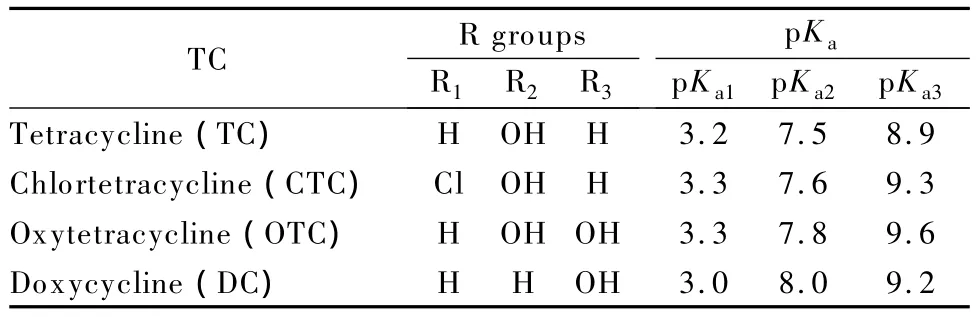
表1 4种TCs的pKa值Table 1 pKaof the four TCs
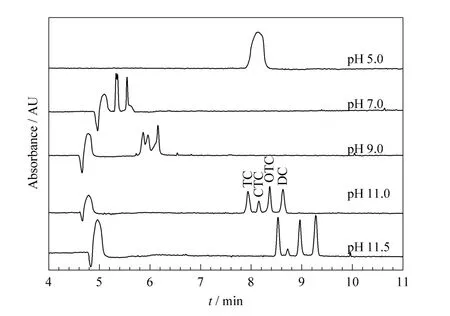
图2 4种TCs在不同pH值BGE下的电泳谱图Fig.2 Electropherograms of the four tetracyclines in the BGEs with different pHs
确定缓冲体系为Na2HPO4(pH 11.0)后,实验考察了Na2HPO4的浓度(10~150 mmol/L)对TCs分离的影响。结果发现,随着缓冲液浓度的升高,BGE的离子强度和电导率增强,体系的电渗流(EOF)减小,分离度得到提高,但分离电流增大导致焦耳热严重,且迁移时间明显增加;当Na2HPO4浓度低于30 mmol/L时,TCs不能达到基线分离,故选择30 mmol/L Na2HPO4(pH 11.0)作为最优的BGE。
2.1.2 分离电压的选择
因焦耳热会影响样品的出峰时间,并引起峰扩展,CE分离一方面希望在高电压下得到更快的分离速度,同时又希望毛细管内产生的焦耳热不影响峰形的尖锐与对称,从而不影响Rs。实验考察了分离电压在+5~+25 kV的范围内对分离的影响。结果显示:当分离电压为+5 kV时,出峰时间延长至35 min;当分离电压为+10 kV时,出峰时间为15 min;当分离电压大于+20 kV时,焦耳热增加且Rs降低。综合考虑,选择+20 kV作为最优的分离电压,此时出峰时间为7~9 min。
2.2 水体基质效应对TCs分离的影响
2.2.1 水体 pH 值
环境水体的pH值会受到方方面面的影响:当水中含有大量的游离二氧化碳,或受酸性工业废水等污染时,水的pH值会降低;当水中含有碱性物质(碳酸盐或氢氧化物)时,水的pH值则会增高。天然水体的pH一般在6.0~9.0范围内,饮用水的pH值则要求在6.5~8.5之间。研究不同pH值水体中TCs的分离情况,有助于对环境中该类污染物的准确定性和定量分析。为了构建稳定的pH值环境,实验中将TCs混合标准溶液用不同pH值的模拟水体(从强酸到强碱,见1.2节)稀释到一定浓度后进行CE分析,结果发现,水体的pH主要影响CTC和DC的出峰,当pH值大于7时,CTC的峰高会随pH增大而降低,同时DC的峰会增高(见图3)。通过对单标准溶液CTC做相同实验,发现在pH大于7时,CTC位于8.06 min的出峰峰高会逐渐降低,而位于8.56 min的出峰峰高会逐渐增高,与DC的出峰时间重合。该结果证明:在碱性条件下,CTC转化为内酯结构,其峰与DC出峰重叠。在强碱性(pH 12.0)条件下,CTC会全部转变为其内酯结构;在弱酸性(pH 4.60)条件下,CTC主要以其自身的结构存在,所以测定碱性水体中的CTC和DC时需要注意水体pH值的影响。在pH为4.60~12.0时通过对CTC单标准溶液定量分析发现,随着pH值的增大CTC转换成为内酯结构的比率由18.7%增加到100%。

图3 不同pH值模拟水样中4种TCs的电泳谱图Fig.3 Electropherograms of the four tetracyclines in artificial environmental water with different pHs
2.2.2 水体硬度
天然环境水体中含有各种金属离子,特别是含有大量的钙离子和镁离子,其总量即为水体总硬度。实验中考察了水体基质中钙、镁离子对TCs分离的影响。在混合标准溶液(总浓度约24.0 μmol/L)中分别添加浓度为0~1.0 mmol/L的 Mg2+和Ca2+后进行CE分析,其TCs电泳谱图见图4a和b。结果显示:当Mg2+浓度较低时,TCs峰形变化不明显;Mg2+浓度增加至0.3 mmol/L时,峰会展宽;Mg2+浓度较高(>0.3 mmol/L)时,峰形变差,TCs不能达到基线分离(见图4a)。通过研究Mg2+对各单标准溶液出峰的影响,发现:Mg2+大量存在将导致TC和DC的峰严重扩展,从而使得整体分离情况严重恶化。此外,当Ca2+浓度低时,对TCs的分离影响较小;但随着浓度的增加,TCs的峰会发生扩展,但峰形尚可(见图4b)。由此可见,Ca2+比Mg2+对水体中TCs的分离影响小。由于TCs分子中含有许多羟基、烯醇基及羰基,在近中性条件下,这些基团能与金属离子形成不溶性配合物,如与钙或镁离子形成不溶性的钙盐或镁盐,而与Mg2+的结合强度大于Ca2+,因此Mg2+对于TCs分离的影响更强。
在BGE中加入添加剂是一种有效消除基体干扰的方式。在水溶液中EDTA具有广泛的配位性能,几乎能与所有金属离子迅速形成配合物。因此,实验考虑在BGE中添加一定量的EDTA来排除Ca2+和Mg2+(特别是Mg2+)对TCs分离的影响。结果显示,在BGE中添加1.5 mmol/L Na2EDTA后,即使样品中含有较高浓度的Mg2+,TCs的整体分离情况也不会受到影响(见图4c)。除了考察了Ca2+和Mg2+对TCs分离的影响外,也考察了Na+和Fe2+对TCs分离的影响,发现Na+由于不具备配合效应,对TCs的分离基本没有影响;而Fe2+则会对TCs的分离有影响。
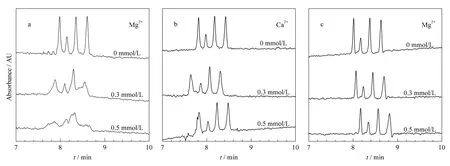
图4 BGE中(a,b)不添加EDTA时不同浓度的Mg2+、Ca2+及(c)添加1.5 mmol/L EDTA时不同浓度的Mg2+对4种TCs分离的影响Fig.4 Effects of(a,b)different concentrations of Mg2+,Ca2+without addition of EDTA in BGE and(c)different concentrations of Mg2+with addition of 1.5 mmol/L EDTA in BGE on the separation of the four tetracyclines
2.3 CE与HPLC对TCs分析性能的比较
HPLC是公认的TCs有效分析方法,为了探究CE对TCs分析的适用性,本文全面对比了CE和HPLC对4种TCs的分析性能,包括分析时间、精密度、线性范围以及灵敏度。
(1)分析时间:采用CE方法在9.0 min内可以对4种TCs完成分离;采用HPLC方法,在等度洗脱模式下需要18.0 min能完成分离;采用梯度洗脱模式时分析时间可缩短至13 min,但TC与OTC的分离度降低,且随着样品浓度的降低基线受流动相变化影响严重,不利于CTC和DC灵敏度的提高,且连续实验之间柱平衡时间较长。图5a为HPLC分离谱图,图5b和c为CE分离谱图。可见,CE具有更快的分离速度,分析时间较HPLC可缩短一半左右;且两次分析之间,CE只需要用超纯水和BGE分别冲洗毛细管3.0 min即可,因此CE方法的分离效率明显优于HPLC。
(2)精密度:在CE分离中,出峰时间和峰面积的精密度影响着对目标物的正确定性和定量。在CE进样方式中,HDI是一种最常见、重现性最好的方式。本文采用HDI方式考察其精密度。日内连续6次测定的结果可见,4种TCs出峰时间的RSD在0.42%~0.56%之间,峰面积的RSD在2.24%~2.95%之间;连续5日测定的日间RSD也均低于5%。采用HPLC方法,TCs出峰时间和峰面积的RSD范围分别为0.13%~0.77%和1.62%~3.05%(见表2)。可见CE-HDI和HPLC方法均具有良好的精密度,均可以对一定浓度的样品进行准确的定性和定量分析。
(3)线性范围及LOD:采用CE和HPLC两种方法对不同浓度的混合标准溶液进行测定,得到峰面积平均值(重复3次)与浓度的线性关系。采用CE-HDI方法,4种TCs在所考察的浓度范围内线性关系良好,其相关系数R2平均为0.996 4;LOD(S/N=3)为0.28~0.62 mg/L。采用HPLC分析时,为避免背景电解质浓度变化引起的基线波动,实验选择用流动相稀释得到系列浓度的混合标准溶液,4种TCs在所考察的浓度范围内线性关系良好,平均相关系数R2为0.999 5;LOD(S/N=3)在4.6~22.0 μg/L之间(见表2)。可见,采用 HPLC方法比CE-HDI具有更高的灵敏度,其平均LOD约为CE的1/40,因此提高CE对TCs分析的灵敏度是增加其实用性的关键。
2.4 加标回收率
采用CE-HDI方法对采集的自来水及鱼塘水进行检测,均未检出TCs的存在。以自来水和鱼塘水作为空白基质,考察了4种TCs的加标回收率。分别在自来水和鱼塘水中添加3.0 mg/L的TCs混合标准溶液进行回收率测定试验,谱图见图5d。结果显示,该添加水平下TC、CTC、OTC及DC在自来水中的平均回收率(n=3)分别为101.4%、96.3%、107.2%、97.2%,鱼塘水中的平均回收率分别为92.4%、87.1%、91.4%、105.2%,表明本文所建立的分析方法可靠。

表2 CE-HDI、CE-FASI和HPLC方法测定TCs的线性范围、重现性及灵敏度比较Table 2 Comparison of linear ranges,repeatabilities and sensitivities of CE-HDI,CE-FASI and HPLC methods for the determination of TCs

图54 种TCs混合标准溶液的(a)HPLC、(b)CE-HDI和(c)CE-FASI分析谱图及(d)CE-HDI检测鱼塘水中添加混合标准溶液(3.0 mg/L)的电泳谱图Fig.5 Chromatograms of mixed solutions of the four TCs by(a)HPLC,(b)CE-HDI and(c)CE-FASI,and(d)a fishpond water sample spiked with 3.0 mg/L TCs by CE-HDI
2.5 FASI技术对TCs分析灵敏度的提高
上述实验表明,采用CE-HDI-UV技术对TCs的分析灵敏度在mg/L级,而自然环境水体中TCs的含量通常为痕量,故需要进一步提高CE方法的灵敏度。在CE进样方式中,场放大电动进样(FASI)是一种简单有效的柱内预浓缩技术,通常样品的电导率远低于BGE的电导率,当毛细管整体被施加一定电压时,样品区带处的电场强度会远高于BGE处的场强。当样品离子迁入BGE时,由于场强突降,样品离子的移动速度迅速变小,因此离子就会在不同区带的界面处堆积。将4种TCs的混合标准溶液的浓度降为原来的1/10(即0.3 mg/L),在HDI进样模式下检测不到目标峰。另外,此浓度样品的pH值约为4.6,而TCs的等电点(pI)为5.0左右[23],因此,被分析物是以正离子形态存在。在进样口施加+10 kV电压,进样时间优化后为2.0 min(避免样品超载的同时尽量增加进样量),得到的电泳谱图如图5c所示。在FASI进样模式下4种TCs在0.2~2.0 mg/L范围内峰面积与浓度的线性关系良好(R2=0.995 8),各组分的LOD在17.8~35.5 μg/L之间,其灵敏度较HDI提高(平均约为HDI的1/16),可以满足畜禽养殖场水环境中TCs污染水平的检测要求,达到了HPLC的数量级(μg/L)。为了考察FASI方法的重现性,日内连续6次进样,结果(见表2)显示,出峰时间的RSD在0.85%~0.95%之间,峰面积的RSD在1.69%~3.43%之间;连续5日测定的日间RSD也均小于5%,表明CE-FASI具有良好的重现性。
3 结论
本研究建立了水体中4种TCs的CE分析方法,考察了BGE组成、pH值、添加剂及分离电压等因素对4种TCs分离的影响。详细考察了水体的基质(pH值和水硬度)对TCs分离的影响,发现在强碱性条件下,金霉素易形成内酯结构,其出峰与强力霉素重叠,影响两者的定量分析。通过在BGE中添加EDTA,可消除水体中钙、镁离子因与TCs形成配合物而对TCs分离产生的严重干扰。采用FASI进样方式,将CE方法的灵敏度提高(检出限约为CE-HDI的1/16),在同样采用紫外检测的条件下,LOD 达到 μg/L级,在17.8~35.5 μg/L之间,该灵敏度与本文中的HPLC-UV方法及文献报道的SPEHPLC-UV方法[8]处于同一数量级,但分析时间、采集样品量及样品前处理等方面,CE方法具有显著优势,能够满足畜禽养殖场水环境中TCs的检测要求。因此,CE方法具有巨大的潜力,结合样品前处理或开发柱内预浓缩技术,进一步改善其分析灵敏度,将极大地促进CE方法在水环境监测中的广泛应用。
[1] Jia A,Hu J Y,Sun J X,et al.Progress in Chemistry(贾瑷,胡建英,孙建仙,等.化学进展),2009,21(2/3):389
[2] Zhang H,Luo Y,Zhou Q X.Journal of Agro-Environment Science(张浩,罗义,周启星.农业环境科学学报),2008,27(2):407
[3] Gao F K,Chen L S,Liu Y M,et al.Chinese Journal of Analytical Chemistry(高福凯,陈璐思,刘永明,等.分析化学),2013,41(2):273
[4] Casado-Terrones S,Segura-Carretero A,Busi S,et al.E-lectrophoresis,2007,28(16):2882
[5] Zhang J,Yan L J,Pan C S,et al.Chinese Journal of Chromatography(张洁,严丽娟,潘晨松,等.色谱),2012,30(10):1031
[6] Zhu J,Snow D D,Cassada D A,et al.J Chromatogr A,2001,928(2):177
[7] Yang C Q,Wang L X,Hou X H,et al.Chinese Journal of Chromatography(杨常青,王龙星,侯晓虹,等.色谱),2012,30(8):756
[8] Liu H,Zhang G P,Liu C Q.Chinese Journal of Analytical Chemistry(刘虹,张国平,刘丛强.分析化学),2007,35(3):315
[9] Ruan Y F,Chen J M,Guo C S,et al.Journal of Agro-Environment Science(阮悦斐,陈继淼,郭昌胜,等.农业环境科学学报),2011,30(12):2588
[10] Gao L H,Shi Y L,Li W H,et al.Chinese Journal of Chromatography(高立红,史亚利,厉文辉,等.色谱),2010,28(5):491
[11] Wei R C,Ge F,Chen M,et al.Journal of Agro-Environment Science(魏瑞成,葛峰,陈明,等.农业环境科学学报),2010,29(6):1205
[12] Bonvehi J S,Gutierrez A L.J Sci Food Agric,2009,89(1):63
[13] Kumar K,Thompson A,Singh A K,et al.J Environ Qual,2004,33(1):250
[14] Suarez B,Santos B,Simonet B M,et al.J Chromatogr A,2007,1175(1):127
[15] Nozal L,Arce L,Simonet B M,et al.Anal Chim Acta,2004,517(1/2):89
[16] Liu Y M,Shi Y M,Liu Z L,et al.J Sep Sci,2010,33(9):1305
[17] Liu Y M,Jia Y X,Tian W.J Sep Sci,2008,31(21):3765
[18] Lombardo-Agui M,Gamiz-Gracia L,Garcia-Campana A M,et al.Anal Bioanal Chem,2010,396(4):1551
[19] Miranda J M,Rodriguez J A,Galan-Vidal C A.J Chromatogr A,2009,1216(15):3366
[20] Wang S F,Yang P,Cheng Y Y.Electrophoresis,2007,28(22):4173
[21] Ibarra I S,Rodriguez J A,Miranda J M,et al.J Chromatogr A,2011,1218(16):2196
[22] Anderson C R,Rupp H S,Wu W H.J Chromatogr A,2005,1075(1/2):23
[23] Guo F Q.Tianjin Pharmacy(郭福庆.天津药学),2000,12(3):67
