格氏试剂衍生-气相色谱-串联质谱法同时测定水果和蔬菜中的三环锡、三苯锡和苯丁锡残留
2014-08-03崔宗岩张进杰刘永明李阿丹曹彦忠
崔宗岩, 孙 扬, 葛 娜, 张进杰, 刘永明, 李阿丹, 曹彦忠*
(1.秦皇岛出入境检验检疫局检验检疫技术中心,河北秦皇岛066004;2.燕山大学环境与化学工程学院,河北秦皇岛066004)
有机锡类农药主要包括三环锡、三唑锡、苯丁锡、薯瘟锡(三苯基乙酸锡)和毒菌锡(三苯基氢氧化锡)等,常作为杀螨剂和杀菌剂广泛用于农业生产[1]。这5种化合物均具有较强的生物毒性,而且在环境中有良好的稳定性,残留期较长,存在对人体的潜在健康风险[2]。我国于1987年禁用三环锡。三唑锡主要官能团与三环锡相同,二者施用后在农产品中残留物均为三环锡。薯瘟锡和毒菌锡主要官能团也相同,残留物均为三苯锡。
我国新近实施的食品安全国家标准GB 2763-2012规定了苹果、梨、柑橘、番茄、土豆等水果和蔬菜中三唑锡、三苯锡和苯丁锡的残留限量,限量范围为0.1~2.0 mg/kg。国外对蔬菜和水果中有机锡类农药残留有更严格的要求,如日本肯定列表规定部分水果蔬菜中三苯锡和苯丁锡的残留限量分别达到0.02 mg/kg和0.05 mg/kg。因而,研究建立食品中有机锡类农药残留的检测方法,对于规范进出口商品检验行为,应对国外贸易技术壁垒,维护国家经济利益和保护国民健康具有重要的意义。
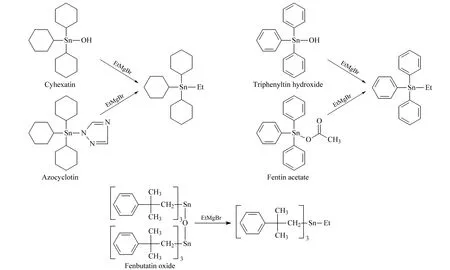
图1 三环锡、三苯锡和苯丁锡的乙基化衍生反应Fig.1 Ethylation of cyhexatin,triphenyltin and fenbutatin oxide by EtMgBr
目前国内外有机锡类农药残留的仪器检测方法包括气相色谱-火焰光度检测法[3,4]、气相色谱-原子发射光谱法[2,5,6]、气相色谱-电子俘获检测法[7,8]、气相色谱-质谱法[9-12]、液相色谱-质谱法[13]、液相色谱-电感耦合等离子体质谱法[14]和红外光谱法[15]等。有机锡化合物的样品前处理方法包括液固萃取[3,4,10]、固相萃取[13]和固相微萃取[2,14,16]等。然而,现有很多方法仅能检测单一或两种有机锡农药,国内外尚未见蔬菜或水果中三环锡、三苯锡和苯丁锡这3种有机锡农药残留同时检测的报道。
本文研究建立了格氏试剂衍生结合气相色谱-串联质谱的检测方法,可以实现水果和蔬菜中三环锡、三苯锡和苯丁锡的同时检测。
1 实验部分
1.1 方法原理
三环锡、三苯锡和苯丁锡中的锡元素均为Ⅳ价,连接若干有机和无机基团,由于其具有一定的极性或较高的相对分子质量,难以直接气化进行气相色谱分析,通常需要将Ⅳ价锡衍生为全有机基团取代的形式。本实验采用格氏试剂乙基溴化镁(EtMgBr)作为衍生试剂,衍生反应如图1所示。三环锡、三苯锡和苯丁锡的衍生产物分别为三环己基乙基锡、三苯基乙基锡和三(2-甲基-2-苯基丙基)乙基锡。
1.2 仪器和装置
Quattro micro型气相色谱-串联质谱(美国Waters公司),配置 Agilent 7890气相色谱仪;SA300型振荡器(日本Yamato公司);EL131型旋转蒸发仪(瑞士Büchi公司),配有BP-51型真空冷却系统(日本Yamato公司);KDC-40型低速离心机(科大创新股份有限公司);8893型超声仪(美国Colc-Parmer公司);12通道固相萃取装置(美国Phenomenex公司);N-EVAPTM112型氮吹仪(美国Organomation公司)。Milli-Q高纯水发生器(美国Millipore公司)。
1.3 试剂和材料
三环锡(cyhexatin,纯度97%),三唑锡(azocyclotin,纯度98%)和苯丁锡(fenbutatin oxide,纯度99.5%)购自德国Dr.Ehrenstorfer公司。三苯基乙酸锡(fentin acetate,纯度99.6%)和三苯基氢氧化锡(triphenyltin hydroxide,纯度99%)购自美国Sigma Aldrich公司。有机锡标准品储备液0.2 g/L(以Sn计),配制于丙酮溶液中,储存在-20℃冰箱中。工作液质量浓度1 mg/L(以Sn计),用超纯水对储备液进行稀释获得。衍生试剂EtMgBr乙醚溶液(3 mol/L)购自日本TCI公司。弗罗里硅土固相萃取柱(Florisil,1 g/6 mL)购自美国Dikma公司。
所用其他试剂均为分析纯及以上纯度。所有玻璃容器在洗涤后用去离子水冲洗,用50%(v/v)硝酸溶液浸泡过夜,再用超纯水清洗后烘干备用。
1.4 样品前处理
1.4.1 提取
称取2 g(精确到0.01 g)匀浆后的蔬菜或水果试样于80 mL离心管中,加入10 mL盐酸/四氢呋喃溶液(1∶10,v/v),剧烈振荡2 min,放置 1 h。再加入20 mL正己烷,振荡提取 45 min,在 3 000 r/min下离心3 min,取上清液于150 mL浓缩瓶中。残渣中再次加入正己烷20 mL,振荡提取15 min,合并提取液,于35℃水浴中减压浓缩至近干。向其中加入约1 mL正己烷溶解残渣,待衍生。
1.4.2 衍生
向上述提取液中加入3 mol/L EtMgBr乙醚溶液1 mL,密闭瓶塞,手动振摇后超声反应15 min,然后在冷水浴条件下向其中逐滴加入5 mL 0.5 mol/L稀硫酸溶液,边滴加边手动振摇。将溶解液完全转移至10 mL离心管中,在3 000 r/min下离心5 min。此过程中需要注意的是,格氏试剂遇水剧烈反应,容易引起危险和导致目标物的损失,衍生过程中必须严格控制,保持无水的环境,稀硫酸必须在冷水浴和手动振摇的条件下逐滴加入。
1.4.3 净化
将Florisil固相萃取小柱(柱内填约1 cm的无水硫酸钠)安装在固相萃取的真空抽滤装置上,先用6 mL正己烷预淋洗小柱。将上述衍生的上层有机相全部转移至Florisil柱上,分两次分别用1 mL正己烷清洗衍生液,并待Florisil柱中溶液的液面降至无水硫酸钠层时,将其转移至柱上。再用10 mL正己烷/丙酮(99∶1,v/v)溶液进行洗脱,控制流速≤3 mL/min,收集全部流出液,35℃下氮气吹干,用正己烷溶解并定容至1 mL,供GC-MS/MS测定。
1.5 GC-MS/MS 条件
气相色谱条件:DB-1701色谱柱(30 m×0.25 mm×0.25 μm);进样口温度290℃,不分流进样;载气为高纯氦(纯度≥99.999%),恒定流速为1.5 mL/min;升温程序:初始温度50℃,保持1 min,以30℃/min升至290℃,保持10 min。
串联质谱条件:电子轰击离子(EI)源,温度230℃,传输线温度为280℃,采用多反应监测(MRM)模式,每个化合物监测两对母离子-子离子。
本实验采用基质匹配标准曲线进行定量。选取与待测样品同类型的空白样品基质,向其中加入系列混合标准溶液,混匀后依据上述流程进行前处理和仪器检测,获得基质标准曲线,用于该类样品中有机锡化合物的定量。
2 结果和讨论
2.1 特征离子对的选择
在选定的实验条件下,首先通过单级质谱的全扫描方式(full scan,m/z 50~550)获得3种有机锡乙基化衍生产物的总离子流色谱图(TIC),然后在其中选择丰度较高和质荷比较大的离子作为母离子(parent ion);在不同碰撞能量(CE,eV)下进行二级质谱扫描(daughters scan),从二级质谱图中选择子离子(daughter ion)及对应碰撞能量,从而获得特征离子对。3种有机锡化合物的串联质谱实验条件见表1。

表1 三环锡、三苯锡和苯丁锡的定量离子对、定性离子对及碰撞能量Table 1 Quantitative ion pairs,qualitative ion pairs and collision energies of cyhexatin,triphenyltin and fenbutatin oxide
在选定的GC-MS/MS条件下,3种有机锡化合物的乙基化衍生产物均可以得到良好的分离(见图2)。

图2 苹果基质中三环锡、三苯锡和苯丁锡的多反应监测色谱图(加标量200 μg/kg,以Sn计)Fig.2 MRM chromatograms of cyhexatin,triphenyltin and fenbutatin oxide spiked in apple at 200 μg/kg(as Sn)for each analyte
2.2 前处理条件优化
三环锡、三苯锡和苯丁锡均为高沸点化合物,难以直接进行气相色谱分析,需要将其衍生为全有机取代的形式进行检测。本实验选取最常用的格氏试剂进行衍生。对衍生试剂乙基溴化镁的加入量进行了优化,结果见图3。在0.2~1.0 mL范围内,随衍生试剂用量增加,目标物响应提高;而当衍生试剂用量增加至2.0 mL时,3种有机锡化合物的响应与1.0 mL时相比略有增加或下降,变化不明显。说明1.0 mL的衍生试剂可以满足衍生反应的要求,因而实验选择衍生试剂加入量为1.0 mL。
为了提高样品的提取和衍生效率,在提取前采用10 mL的HCl/THF溶液对均质的样品进行酸化消解。以苹果作为代表性样品基质,对HCl/THF的体积比进行了考察,结果见图3,在HCl/THF为1∶10(v/v)的比例下,目标物获得最高响应。确定HCl/THF的体积比后,对提取溶剂的类型进行了选择,考察了正己烷、正己烷/丙酮(1∶1,v/v)和正己烷/二氯甲烷(1∶1,v/v)3种提取溶剂,结果表明提取效果无明显差异。最终选择单一溶剂正己烷为提取溶剂。
水果和蔬菜中有机锡化合物的净化常采用固相萃取的方式,最常用正相萃取柱,如硅胶或Florisil等[11,12]。本实验选用 Florisil柱作为净化柱,可以有效去除基质干扰。实验发现,采用正己烷进行洗脱,需要消耗20 mL以上的溶剂,并且洗脱效率较低。而在其中添加少量丙酮(1%,v/v),即可使得目标物在10 mL以内获得完全洗脱,而且大量杂质不会一起洗脱下来,节约有机溶剂用量。因而,实验选取正己烷/丙酮(99∶1,v/v)作为洗脱溶剂。
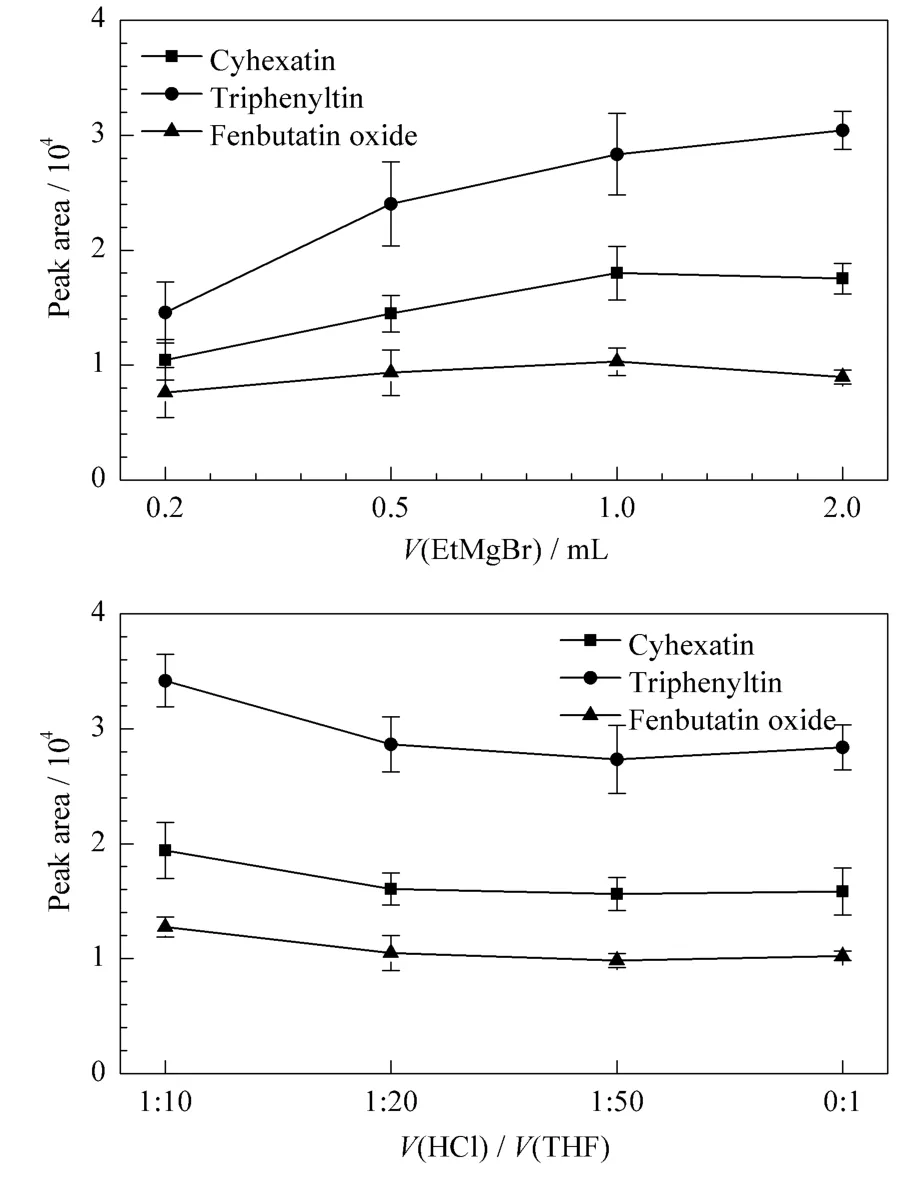
图3 衍生试剂(EtMgBr)体积和HCl/THF的体积比对三环锡、三苯锡和苯丁锡响应的影响Fig.3 Effects of EtMgBr volume and volume ratio of HCl and THF on the peak areas of cyhexatin,triphenyltin and fenbutatin oxide
2.3 线性关系和检出限
依照样品前处理方法,以苹果为代表性样品基质做基质匹配校正曲线,选择含量点包括2、5、10、20、50、100、200、500、1 000 μg/kg(以 Sn 计)。以目标物含量(μg/kg)为横坐标,以目标物峰面积为纵坐标,绘制标准曲线;以S/N=3确定检出限,以S/N=10确定定量限,结果见表2。实验结果显示,线性相关系数(r2)均不小于0.997;该方法对于三环锡、三苯锡和苯丁锡的检出限分别为2.0、1.5和3.4 μg/kg(以Sn计),转换为5种有机锡农药的含量,该方法对三环锡、三唑锡、薯瘟锡、毒菌锡和苯丁锡的检出限分别 6.5、7.3、5.2、4.6 和 15.1 μg/kg,完全满足国内外限量检测的要求。与文献[10-12]等报道的方法相比,本文所建立的方法灵敏度较高或与之相当,加之3种有机锡农药可同时检测的优势,使得本方法具有更广泛的适用性。

表2 代表性样品基质(苹果)中三环锡、三苯锡和苯丁锡的线性方程、相关系数(r2)、检出限及定量限Table 2 Linear equations,correlation coeffecients(r2),limits of detection(LODs)and limits of quantification(LOQs)of cyhexatin,triphenyltin and fenbutatin oxide in a representative matrix of apple
2.4 回收率和精密度
参照GB 2763-2012,选取其中对有机锡化合物有限量要求的5种水果和蔬菜(苹果、梨、柑橘、西红柿和土豆)作为样品基质,向其中添加10、20、50和200 μg/kg(以Sn计)共4个水平的三环锡、三苯锡和苯丁锡混合标准溶液,每个添加水平设置4个平行,计算加标回收率和精密度,具体结果见表3。结果表明,平均回收率范围为72.4%~107.1%,相对标准偏差为0.4%~14.2%。
2.5 基质效应考察
由于样品基质复杂,而且本实验前处理过程用到大量有机溶剂、酸和衍生试剂,可能对目标物的响应产生一定的影响。因此考察了添加200 μg/kg(以Sn计)条件下,不同基质条件对3种有机锡化合物响应的影响,结果见图4。标准品直接衍生条件下,苯丁锡的响应较低;而经过提取后衍生,苯丁锡的峰面积明显提高。对不同样品基质而言,在柑橘基质中,三环锡存在明显的基质抑制效应,其峰面积明显较在其他基质中低。
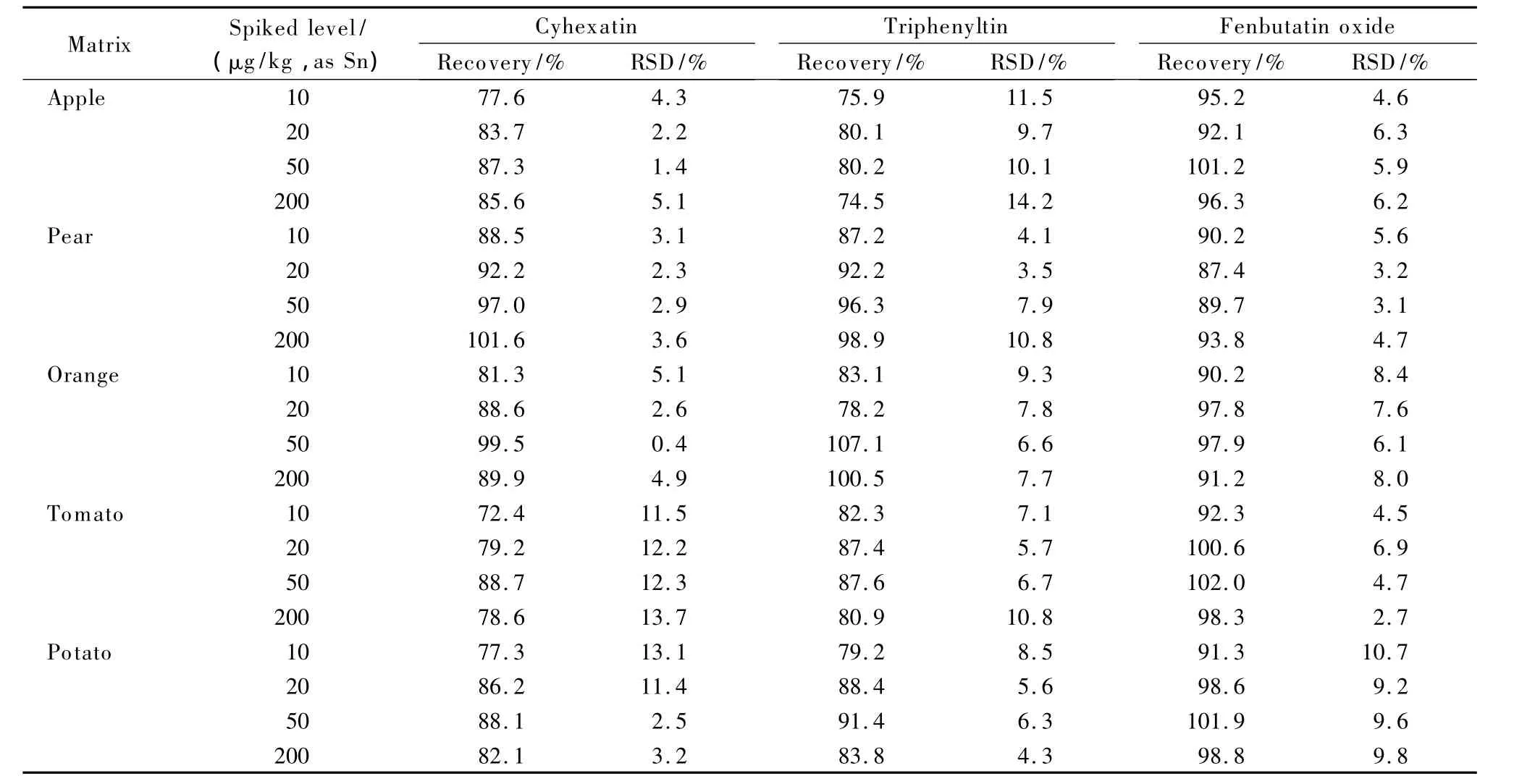
表3 5种蔬菜和水果基质中三环锡、三苯锡和苯丁锡的添加回收率和相对标准偏差(RSD,n=4)Table 3 Recoveries and relative standard deviations(RSDs)of cyhexatin,triphenyltin and fenbutatin oxide spiked in 5 kinds of fruits and vegetables(n=4)
在基质效应明显存在的情况下,本实验中选取基质匹配标准曲线进行定量,可以有效降低基质效应的影响,使得定量结果更加准确。
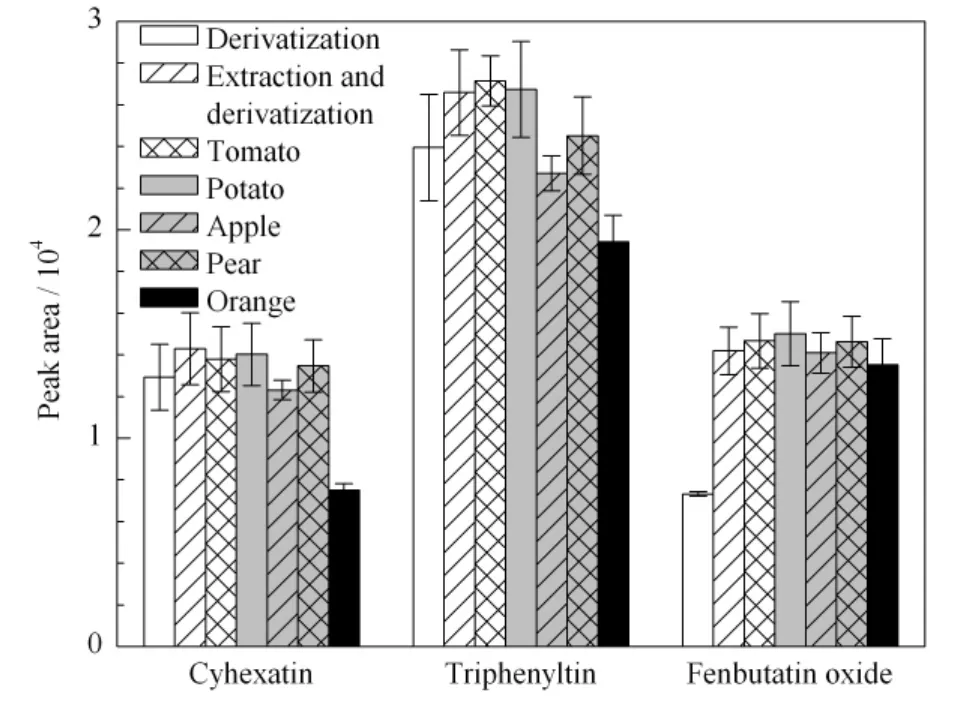
图4 不同基质条件对三环锡、三唑锡和苯丁锡响应的影响Fig.4 Effects of different matrices on the peak areas of cyhexatin,triphenyltin and fenbutatin oxide
2.6 实际样品检测
应用本文所建立的方法检测了市场上随机购买的10个蔬菜和水果样品中的三环锡、三苯锡和苯丁锡残留,样品类型包括苹果、梨、番茄等,结果均未检出3种有机锡化合物。
3 结论
本文建立了水果和蔬菜中3种有机锡化合物同时检测的格氏试剂衍生-气相色谱-串联质谱法。与现有方法相比,本实验方法具有选择性好、灵敏度高等优点,其独特优势还在于实现了蔬菜和水果样品中三环锡、三苯锡和苯丁锡的同时检测,结果满足国内外限量标准的检测要求,具有广泛的适用性。
[1] Jiang Q,Shi P F,Hu X L.Chemical Reagents(姜琴,施鹏飞,胡喜兰.化学试剂),2011,33(11):1014
[2] Campillo N,Vinas P,Penalver R,et al.J Food Compos Anal,2012,25(1):66
[3] Li D L.Physical Testing and Chemical Analysis Part B:Chemical Analysis(李德良.理化检验:化学分册),2010,46(5):518
[4] GB/T 5009.215-2008
[5] Montes R,Canosa P,Lamas J P,et al.Anal Bioanal Chem,2009,395(8):2601
[6] Canosa P,Montes R,Lamas J P,et al.Talanta,2009,79(3):598
[7] Wu M,Lu J,Zhu Y H,et al.Chinese Journal of Pesticide Science(吴珉,卢军,朱亚红,等.农药学学报),2011,13(5):503
[8] SN 0592-1996
[9] Devos C,Moens L,Sandra P.J Sep Sci,2005,28(7):665
[10] Wang J H,Zhao L,Cai F,et al.Food Science(王建华,赵亮,蔡发,等.食品科学),2007,28(9):446
[11] SN/T 1990-2007
[12] SN/T 3149-2012
[13] Zhu W X,Liu Y F,Yang J Z.Chinese Journal of Chromatography(祝伟霞,刘亚风,杨冀州.色谱),2010,28(9):867
[14] Vercauteren J,De Meester A,De Smaele T,et al.J Anal Atom Spectrom,2000,15(6):651
[15] Gao W P,Hu X G,Sun S J,et al.Chinese Journal of Spectroscopy Laboratory(高伟平,胡新功,孙书军,等.光谱实验室),2006,23(6):1143
[16] Jiang S X,Feng J J.Chinese Journal of Chromatography(蒋生祥,冯娟娟.色谱),2012,30(3):219
