QuEChERS结合高效液相色谱-串联质谱法测定饲料中的18种β-兴奋剂
2014-08-03吴玉杰赵永锋李丽华马燕娟
郑 玲, 吴玉杰, 赵永锋, 李丽华, 马燕娟
(广西出入境检验检疫局,广西南宁530021)
β-兴奋剂(β-agonist),俗称瘦肉精,在化学上属于苯乙胺类药物,一般具有含苯乙醇胺的母体结构。最早用于1988年,主要用于防治人、畜的支气管哮喘和支气管痉挛。这些药物高剂量添加在饲料中,可以选择性地作用于肾上腺素,导致动物体内的脂肪分解代谢增强,增加蛋白质的合成,显著提高胴体瘦肉率。但如果长期食用含有大量β-兴奋剂残留的动物组织,会对人体健康造成很大伤害,包括中毒、引起恶性肿瘤,甚至致人死亡[1,2]等。农业部于2002年2月发布的176号公告[3]《禁止在饲料和动物饮用水中使用的药物品种目录》,其中就将克仑特罗、莱克多巴胺、西马特罗等列为违禁药物。之后,β-兴奋剂类药物一直是国家相关监管部门的重点监测项目之一。由于多年来对禁用药物的严厉监管,犯罪分子转而添加同类替代药物,比如:班布特罗、喷布特罗、苯乙醇胺A等。β-兴奋剂的滥用严重威胁着人们的身体健康,农业部于2010年12月再次发文(农业部公告第1519号[4]),禁止在饲料和动物饮水中使用班布特罗、齐帕特罗、氯丙那林、马布特罗、阿福特罗、溴布特罗、喷布特罗、苯乙醇胺A等物质。因此,建立多组分的同时测定方法,在实际监督和执法工作中对饲料进行实时监测具有重要的意义。
QuEChERS 方法[5,6]利用吸附剂填料与基质中的杂质相互作用吸附杂质,从而达到除杂、净化的目的。因具有快速(quick)、简单(easy)、廉价(cheap)、有效(effective)、可靠(rugged)和安全(safe)的特点而得名。此方法一经问世就受到各国农药残留分析者的普遍关注,发展十分迅速,现已成功地用于多种食品中多种农药残留的分析[7-12]。QuEChERS方法很灵活,可根据分析物、基质、仪器和分析者的偏好对净化剂、盐量、水含量和吸附剂等做改进,改进的方法也适用于含中等或高脂的食物。因此,近年来该技术也开始应用于兽药残留检测领域[13-15]。
有关β-兴奋剂的分析测定方法涉及液相色谱法[16]、(气相、液相)色谱-质谱法[17-19]、酶联免疫吸附法[20]等。实际工作中,多采用液相色谱-质谱联用法进行确证,因为此法可以同时满足高灵敏度、高选择性的定性定量要求。但在已报道的液相色谱-串联质谱测定方法中,前处理方法多为固相萃取方法,鲜有QuEChERS方法在饲料中β-兴奋剂类违禁药物检测中的应用报道。目前已发布的饲料中β-兴奋剂类违禁药物的国家标准[21,22]及报道的测定方法[23]使用的也是固相萃取法。本文建立了QuEChERS结合HPLC-MS/MS同时测定饲料中18种β-兴奋剂的方法,为饲料中β-兴奋剂类违禁药物的监控提供了又一个快速、有效的方法,有利于提升对β-兴奋剂类违禁药物的监控水平。
1 实验部分
1.1 仪器与试剂
液相色谱-串联质谱仪:Agilent 1200 RRLC+Agilent 6410B质谱仪,配电喷雾离子源(ESI)(美国安捷伦科技有限公司);高速离心机:Sigma3-18k(德国Sigma公司);振荡器:YAMATO SA300(日本Yamato Scientific Co.Ltd.);超纯水器:Milli-Q Reference(美国Millipore公司)
克仑特罗(clenbuterol)、班布特罗(bambuterol)、马布特罗(mabuterol)、克仑丙罗(clenproperol)等标准物质纯度均大于98%,喷布特罗(penbutolol)纯度96%,莱克多巴胺(ractopamine)纯度97%,购自 Dr.Ehrenstorfer GmbH;西马特罗(cimaterol)、西布特罗(cimbuterol)、氯丙那林(clorprenaline)、溴布特罗(brombuterol)、马贲特罗(mapenterol)、溴代克伦特罗(bromchlorbuterol)等纯度均为99%,购自WITEGA Laboratorien Berlin-Adlershof GmbH;苯乙醇胺A(phenylethanolamine A)、妥布特罗(tulobuterol)、利托君(ritodrine)等纯度均为98%,齐帕特罗(zilpaterol)纯度95%,购自Toronto Research Chemicals Inc.;阿福特罗(arformoterol)纯度99.9%,购自International Laboratory USA;苯氧丙酚胺(isoxsuprine)纯度99.5%,购自U.S.Pharmacopeia。
C18、PSA 粉末(40 ~63 μm,CNW 公司);甲醇、乙腈、甲酸(色谱纯);无水硫酸钠、氯化钠(分析纯);水为Milli-Q超纯水。
1.2 标准溶液的配制
称取各标准品10.0 mg,用甲醇溶解并定容至100 mL棕色容量瓶中,配成浓度为100 mg/L的标准储备液,在-18℃保存。使用时根据需要用相应的空白样品基质提取液配制适当浓度的标准工作液。
1.3 样品处理
称取样品2 g(精确至0.01 g),加水10 mL,涡旋30 s,超声5 min。加入20 mL乙腈(含4%(v/v)氨水)、6 g无水硫酸钠、2 g氯化钠、涡旋混匀后振荡20 min,于4 000 r/min下离心10 min,取2 mL上层清液于净化管中(已加入25 mg C18和50 mg PSA),涡旋2 min,于10 000 r/min下离心10 min,取1 mL净化液于45℃氮气吹干,1 mL流动相(甲醇-0.1%甲酸水溶液(1∶9,v/v))溶解,LCMS/MS测定。
1.4 HPLC-MS/MS 条件
1.4.1 HPLC 条件
色谱柱:ZORBAX Eclipse XDB-C18柱(50 mm×4.6 mm,1.8 μm)。流动相:A 为甲醇,B 为0.1%甲酸水溶液。梯度程序:0~1 min,10%A;1~3 min,10%A~40%A;3~5 min,40%A~70%A;5~7 min,70%A~90%A;7~10 min,90%A;10~11 min,90%A~10%A;11~15 min,10%A。流速:0.4 mL/min;柱温:40 ℃;进样量:10 μL。
1.4.2 质谱条件
离子源:ESI;扫描方式:正离子扫描;检测方式:多反应监测(MRM);毛细管电压:4 000 V;雾化气温度:350℃;雾化气流速:12 L/min;雾化气压力:310.05 kPa(45 psi)。MRM监测模式下的参数见表1。
2 结果与讨论
2.1 提取试剂的优化
应用QuEChERS方法进行兽药残留测定时,乙腈或酸化乙腈是常用的提取溶剂。文献[13]显示,添加4%氨水的乙腈能提高β-兴奋剂的提取率,因此,本实验比较了乙腈、2%(v/v)氨水乙腈、4%(v/v)氨水乙腈、2%(v/v)乙酸乙腈、5%(v/v)乙酸乙腈的提取效果。结果显示,用4%(v/v)氨水乙腈提取,90%的目标化合物回收率在85%~115%范围内,结果优于其他的提取试剂。部分待测物,如克仑特罗、马布特罗、溴代克仑特罗等,用以上几种试剂提取,回收率无明显差异;而西马特罗、西布特罗、利托君等,在碱性条件下提取,回收率明显高于中性及酸性条件。尤其是齐帕特罗,用4%氨水乙腈提取的回收率高于95%,而在中性和酸性条件下提取的回收率不足50%。原因可能是碱性条件能有效抑制这些化合物的离子化,从而增加其在有机相中的分配比例。因此本实验选择4%氨水乙腈为提取溶剂。

表1 18种分析物的MRM参数Table 1 MRM parameters of the 18 analytes
2.2 净化吸附剂的优化
在QuEChERS净化方法中,PSA、C18及石墨化炭黑(GCB)是常用的吸附剂。PSA可去除提取液中的脂类和糖类物质,C18具有良好的除脂能力,GCB通常用于除去植物提取液中的色素成分,但对含苯环官能团的化合物有较强的吸附作用[16]。饲料中含有脂类、蛋白(在乙腈提取时已被沉淀)、糖类等干扰组分,而β-兴奋剂类一般具有苯乙醇胺的母体结构,故本研究只选取PSA和C18作为净化吸附剂进行优化。在同一加标浓度的样品提取液中,分别加入6个不同组合的PSA和C18(1:25 mg C18;2:50 mg C18;3:75 mg C18;4:25 mg C18+50 mg PSA;5:25 mg C18+100 mg PSA;6:50 mg C18+50 mg PSA)吸附剂净化,结果如图1所示。由图1可以看出,各待测物在采用组合4(C1825 mg+PSA 50 mg)净化时有较好的回收率,90%的目标化合物回收率在90%~111%范围内。且实验发现,仅使用C18(组合1、2、3)净化时,样品溶液颜色仍较深,吹干后剩余残渣较多,进样检测后,离子源污染较严重。而组合4、5、6的净化效果均较好。其中采用组合4、6净化时,绝大部分待测物的回收率相当,但其中待测物喷布特罗在组合4的回收率明显高于组合6。比较6个组合的回收率可以看出,PSA和C18使用量的增加都会引起喷布特罗的回收率下降,因此,选择组合4(即25 mg C18+50 mg PSA)作为净化剂。
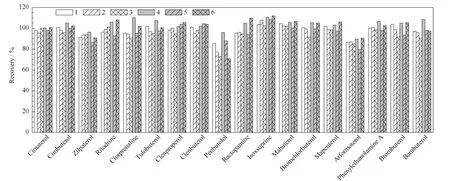
图1 不同净化剂组合对18种待测物回收率的影响Fig.1 Effects of the usage amount of C18and PSA on recoveries of the 18 compounds
2.3 净化方式及时间的选择
净化时采用的方式有两种,涡旋或振荡。实验比较了涡旋1、2 min和振荡5、10、20 min的净化效果。结果显示,不同振荡时间对回收率和净化效果无明显影响,且与涡旋2 min的结果相当。而涡旋1 min的样品,其响应均有不同程度的降低,50%的待测物响应降低20%以上。原因在于吸附时间过短,杂质吸附不完全。考虑到建立本实验方法是为了快速前处理,且在实验室也可实现批量样品同时涡旋,因此选择涡旋2 min为净化条件。
2.4 基质效应评价及消除
基质效应是指由于基质成分和目标化合物在电喷雾离子源进行离子化时相互竞争而导致目标化合物的信号强度有不同程度的增强或减弱。基质效应包括基质增强效应和基质抑制效应。尽管样品经过乙腈沉淀蛋白、分散固相萃取后取得了良好的净化效果,但仍无法完全消除基质效应,而基质效应的存在会对测定结果的准确性产生影响。因此,在建立LC-MS/MS检测方法时应对基质效应进行评价,并采取措施进行消除,以保证结果的准确可靠。基质效应可采用(基质匹配标准溶液所做曲线的斜率/无基质标准溶液所做曲线的斜率-1)×100%进行评价[24],负值表示存在基质抑制效应,正值表示存在基质增强效应,绝对值越大则基质效应越强。本实验对18种待测物的基质效应进行了评价(见表2),可以看出,莱克多巴胺的测定基本不受基质影响,基质对班布特罗的测定有增强效应,其余化合物均存在一定的抑制效应。其中,除氯丙那林和妥布特罗的抑制效应大于25%外,其余化合物的抑制效应均小于15%。这也可在一定程度上说明本实验所建立的净化方法具有较好的净化效果。
可使用同位素内标[25,26](理化性质与目标物几乎一致)或配制基质匹配标准溶液(为标准溶液提供与样品溶液相似的离子化环境)的方法消除基质效应的影响。同位素内标一般都很昂贵,且已经商品化的同位素内标种类也非常有限,在已报道的使用 LC-MS/MS 的多组分残留测定方法[14,15]中,大多采用基质匹配标准溶液进行定量。本方法采用配制基质匹配标准溶液的方法很好地消除了基质影响,完全能满足测定的要求。

表2 18种化合物的基质效应评价Table 2 Evaluation of matrix effects of the 18 compounds
2.5 质谱条件的优化与质谱定性
根据待测物的性质,分别配制1 mg/L的各种标准溶液,在ESI正离子模式下分别进行质谱条件优化。第一步进行母离子扫描,确定母离子,并优化得到源内碎裂电压,然后在选定的源内碎裂电压条件下,对选定的母离子进行子离子扫描,选取丰度相对最强的子离子为定量离子,其次为定性离子,并分别对子离子的碰撞能进行优化。最后,在MRM模式下优化了雾化气温度、雾化气流速及压力。优化的质谱参数见表1及1.4.2节。
2.6 线性范围、检出限、定量限、回收率与精密度
用空白样品基质提取液配制 5、10、20、50、100、200 μg/L的系列混合标准溶液,在优化的实验条件下分离检测,以质量浓度(x)为横坐标,以峰面积(y)为纵坐标作标准曲线,得各目标化合物的线性回归方程和相关系数(r2)(见表3)。结果显示,18种待测物的r2为0.991 2~0.999 5,表明各目标化合物在5~200 μg/L范围内呈良好的线性关系。
在阴性饲料样品中添加不同浓度的待测物,按本研究建立的方法进行检测,以信噪比≥10确定各化合物的定量限均为0.05 mg/kg,以信噪比≥3确定各化合物的检出限均为0.015 mg/kg。阴性饲料样品添加0.05 mg/kg待测物的谱图略。
取阴性饲料样品,分别添加3个浓度水平的18种待测化合物,每个水平测定6份平行样品,考察方法的回收率和精密度。结果见表4。可以看出,各化合物在3个加标水平的平均回收率为78.4%~107.1%,相对标准偏差(RSD)为3.5% ~12.3%。将该方法用于猪配合饲料、鸡预混料、鸡浓缩料等不同饲料样品的检测,加标回收率结果均一致。
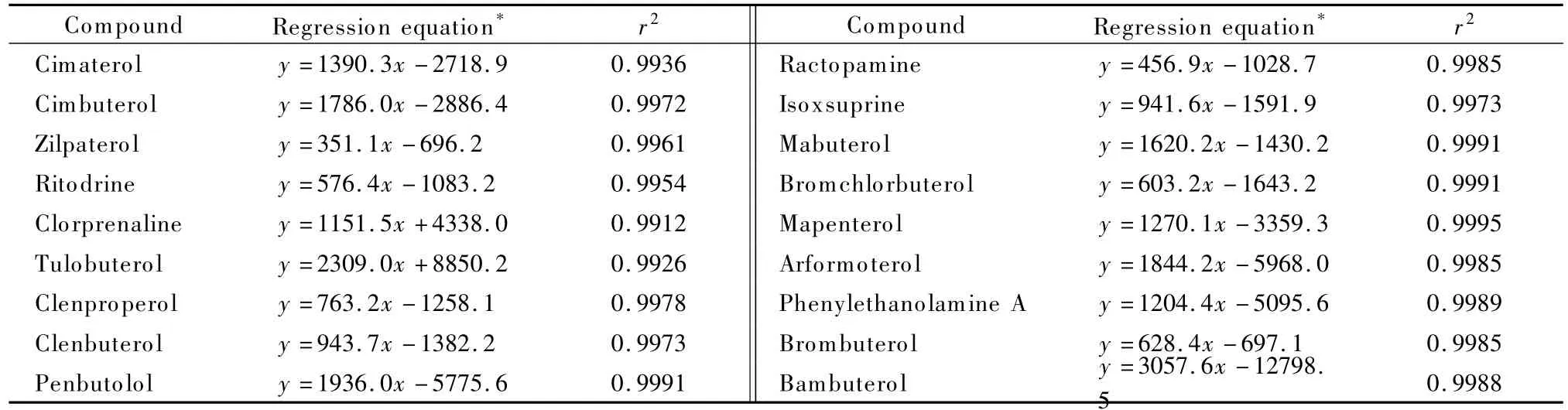
表3 各化合物的线性方程和相关系数Table 3 Regression equations and correlation coefficients(r2)of the 18 compounds

表4 阴性饲料样品中18种β-兴奋剂的加标回收率与相对标准偏差(n=6)Table 4 Recoveries and relative standard deviations(RSDs)of the 18 β-agonists spiked in a blank sample(n=6)
2.7 实际样品测定
应用本研究建立的方法对30个不同厂家的鸡、猪饲料样品进行了18种β-兴奋剂的检测,结果表明,所有饲料样品中均未发现这18种β-兴奋剂。
3 结论
本文将QuEChERS前处理方法应用于饲料中18种β-兴奋剂的检测,通过对QuEChERS前处理方法及仪器条件进行优化,建立了定性、定量测定饲料中18种β-兴奋剂的液相色谱-串联质谱检测方法。该方法操作简便,灵敏度高,对饲料基质净化效果好,可用于饲料中多种β-兴奋剂类药物的快速筛查和确证。
[1] Guo W,Yang L J,Shi W C,et al.Chinese Journal of Analysis Laboratory(郭伟,杨丽君,时文春,等.分析试验室),2010,29(4):92
[2] Teng N Y,Liu X H,He S H,et al.Chinese Journal of Health Laboratory Technology(滕南雁,刘向红,何颂华,等.中国卫生检验杂志),2011,21(7):1617
[3] Ministry of Agriculture.No.176 Bulletin of the Ministry of Agriculture of the People’s Republic of China(农业部. 中华人民共和国农业部公告第176号).[2002-02-09].http://www.moa.gov.cn/zwllm/tzgg/gg/201104/t20110422_1976307.htm
[4] Ministry of Agriculture.No.1519 Bulletin of the Ministry of Agriculture of the People’s Republic of China(农业部. 中华人民共和国农业部公告第1519号).[2010-12-27].http://www.moa.gov.cn/zwllm/tzgg/gg/201104/t20110422_1976294.htm
[5] Liu X G,Xu J,Dong F S,et al.Anal Bioanal Chem,2011,401(3):1051
[6] Wang J,Chow W,Cheung W.J Agric Food Chem,2011,59:8589
[7] Xu J,Chen J,Ye H Y,et al.Journal of Instrumental Analysis(徐娟,陈捷,叶弘毅,等.分析测试学报),2011,30(9):990
[8] Xu J,Chen J,Wang L,et al.Journal of Instrumental Analysis(徐娟,陈捷,王岚,等.分析测试学报),2013,32(3):293
[9] Zhang Z Y,Gong Y,Shan W L,et al.Chinese Journal of Chromatography(张志勇,龚勇,单炜力,等.色谱),2012,30(1):91
[10] Wang L Z,Zhou Y,Chen Y,et al.Chinese Journal of Chromatography(王连珠,周昱,陈泳,等.色谱),2012,30(2):146
[11] Sung W L,Jeong H C,Soon K C,et al.J Chromatogr A,2011,1218:4366
[12] Ondrej L,Jana U,Jan P,et al.J Chromatogr A,2010,1217:648
[13] Lan F,Zhang Y,Yue Z F,et al.Journal of Instrumental Analysis(蓝方,张毅,岳振峰,等.分析测试学报),2012,31(12):1471
[14] Luo H T,Huang X L,Wu H Q,et al.Journal of Instrumental Analysis(罗辉泰,黄晓兰,吴惠勤,等.分析测试学报),2011,30(12):1329
[15] Bu M N,Shi Z H,Kang J,et al.Journal of Instrumental Analysis(卜明楠,石志红,康健,等.分析测试学报),2012,31(5):552
[16] Wang L,Li Y Q,Zhou Y K.Chinese Journal of Analysis Laboratory(王炼,黎源倩,周运柯.分析试验室),2009,28(3):78
[17] Wang P L,Fan L,Su X O,et al.Chinese Journal of Analytical Chemistry(王培龙,范理,苏晓鸥,等.分析化学),2012,40(3):470
[18] Lu Y F,Xu L J,Wang H,et al.Journal of Chinese Mass Spectrometry Society(卢艳芬,徐丽君,王辉,等.质谱学报),2012,33(5):280
[19] Cai Q R,Wu J S,Qian Z J,et al.Chinese Journal of Chromatography(蔡勤仁,吴洁珊,钱振杰,等.色谱),2013,31(3):200
[20] Wan Y P,Liu N,Tao G C,et al.Journal of Henan Agricultural Science(万宇平,刘宁,陶光灿,等.河南农业科学),2013,42(2):132
[21] No.1029-1-2011 Bulletin of the Ministry of Agriculture,National Standards of the People’s Republic of China(农业部1029号公告-1-2011,中华人民共和国国家标准)
[22] No.1486-1-2010 Bulletin of the Ministry of Agriculture,National Standards of the People’s Republic of China(农业部1486号公告-1-2010,中华人民共和国国家标准)
[23] Li D N,Yan F,Zhang W G,et al.Feed Research(李丹妮,严凤,张文刚,等.饲料研究),2011(12):43
[24] Tso J,Aga D S.J Chromatogr A,2010,1217:4784
[25] Liu Y T,Ai X H,Yang H.Journal of Instrumental Analysis(刘永涛,艾晓辉,杨红.分析测试学报),2011,30(6):640
[26] Zheng L,Wu Y J,Li Y,et al.Chinese Journal of Chromatography(郑玲,吴玉杰,李湧,等.色谱),2012,30(7):660
