高效液相色谱-三重四极杆质谱法同时测定羊栖菜5个部位中10种植物激素含量
2014-08-03徐继林郑立洋严小军骆其君
李 艳, 徐继林, 郑立洋, 李 敏, 严小军, 骆其君
(宁波大学海洋学院,浙江宁波315211)
羊栖菜,拉丁学名 Sargasum fusiforme(Hary.)Seichell,属于圆子纲马尾藻属植物,别名鹿角尖、海大麦等。羊栖菜具有抗肿瘤[1]、调节免疫功能[2]、降血糖[3]、降血脂[4]、抗凝血[3]、清除体内自由基[3,4]等药理作用,另有研究证明羊栖菜能够改善海域水质环境[5]。
植物激素在植物体内的含量极其小,但对植物的生长发育有重要的调控作用[6]。它能够调节植物细胞分裂与生长、各类组织分化、植物成熟与衰败,还能够影响植物形态建成,辅助离体组织培养[7]。对羊栖菜各部位的植物激素成分含量进行分析,不但能够帮助我们了解羊栖菜生长发育周期的各种生理变化,而且可以通过控制羊栖菜生长发育过程中外源激素的用量调控羊栖菜的生长发育。
植物激素的检测方法主要包括光谱法[8,9]、毛细管电泳法[10]、电化学生物传感器检测法[11]、气相色谱法[12]、高效液相色谱法[13,14]、液相色谱-质谱联用法等[15-18]。其中光谱法的准确度较低;毛细管电泳法重现性较差;电化学生物传感器检测法主要局限于检测单种植物激素,还有待于进一步研究开发;使用气相色谱法检测植物激素的缺点是样品需要预先进行衍生化处理,一方面步骤繁琐,另一方面不同的植物激素需要采用不同的衍生化方法,不能同时检测多种植物激素;采用高效液相色谱法检测植物激素,解决了气相色谱法需要衍生化的缺点,但是同时检测多种植物激素时,在几种成分保留时间非常接近的情况下会出现相互干扰的现象;相比较而言,液相色谱-质谱联用法是一种更为可靠的分析植物激素的方法。
目前尚未有对羊栖菜各个部位的激素含量进行全面系统分析的研究。本文建立了一种采用液相色谱-三重四极杆质谱联用方法,对羊栖菜主分支、侧分支、初生叶、次生叶、茎等5个部位的吲哚乙酸(indole-3-acetic acid)、异戊烯腺嘌呤[N6-(2-isopentenyl)adenine]、玉米素(zeatin)、异戊烯腺苷[N6-(2-isopentenyl)adenosine]、反式玉米素核苷(trans-zeatin riboside)、独角金内酯(strigolactone)、水杨酸(salicylic acid)、茉莉酸(jasmonic acid)、脱落酸(abscisic acid)、赤霉素(gibberellin A3)等10种植物激素含量进行了分析。该方法便捷、可靠,可以推广应用于同时分析不同植物的多种植物激素。
1 实验部分
1.1 仪器、材料与试剂
美国ThermoFisher Scientific公司TSQ Quantum Access液相色谱-三重四极杆质谱联用分析系统;法国Millipore公司超纯水系统;国产TP300超声波清洗机。
新鲜羊栖菜样品采集于浙江沿海,包含主分支、侧分支、初生叶、次生叶、茎等5个部位。标准品吲哚乙酸、异戊烯腺苷、异戊烯腺嘌呤、反式玉米素核苷、玉米素、独角金内酯、脱落酸、水杨酸、赤霉素、茉莉酸、2,6-二叔丁基-4-甲基苯酚(BHT)购自美国Sigma-Aldrich公司。色谱纯甲醇、甲酸、乙酸购自美国Tedia公司;超纯水系统自制纯水;其他为国产分析纯试剂。
1.2 激素提取方法
参照文献[19,20]的样品处理方法,准确称取新鲜采集的羊栖菜样品1 g(每组3份平行样),冷冻干燥、液氮冰浴研磨后,加入1 mL甲醇/水/甲酸(15∶4∶1,v/v/v)(含 0.5%BHT),超声(功率 30 W,频率40 kHz)提取20 min,放入-20℃冰箱内避光浸泡提取16 h,然后在4℃、10 000 r/min条件下离心10 min,吸取上清液置于4 mL棕色样品瓶中,用0.5 mL 甲醇/水/甲酸(15∶4∶1,v/v/v)(含 0.5%BHT)再提取2次;合并上清液,于35℃下减压蒸发至干,用 0.5 mL 甲醇/水/乙酸(90∶10∶0.05,v/v/v)复溶,于4℃、10 000 r/min条件下离心10 min,取上清液供LC-MS分析。每个样品平行分析3次,取均值。
1.3 混合标准储备液
1.3.1 用于正离子扫描模式的混合标准储备液
准确称取吲哚乙酸、异戊烯腺嘌呤、玉米素、异戊烯腺苷、反式玉米素核苷、独角金内酯标准品各10.0 mg。其中异戊烯腺苷、异戊烯腺嘌呤、反式玉米素核苷、玉米素标准品在甲醇中不易溶解,需先用少量的1 mol/L盐酸溶解;吲哚乙酸、独角金内酯标准品用少量甲醇溶解;将二者混合后用甲醇定容至10.0 mL,配成1 g/L用于正离子扫描模式的混合标准储备液。
1.3.2 用于负离子扫描模式的混合标准储备液
准确称取水杨酸、茉莉酸、脱落酸、赤霉素标准品各10.0 mg,用少量甲醇溶解、定容至10.0 mL,配成1 g/L用于负离子扫描模式的混合标准储备液。
1.4 色谱-质谱条件
色谱条件:Hypersil Gold C18色谱柱(100 mm×2.1 mm,1.7 μm)(美国 Thermo Fisher Scientific公司),流动相为水(A)和甲醇(B)。洗脱梯度:20 min内B相由15%升到100%,保持5 min;然后B相在1 min内降到10%,保持10 min。流速为0.3 mL/min,柱温为30℃,进样量为15 μL。
质谱条件:电喷雾电离源电离,在正离子电离模式下喷雾电压为3 kV,负离子电离模式下喷雾电压为2.5 kV;鞘气压力为30 L/min;辅助气流量为2 L/min;离子传输毛细管温度为300℃,Q2碰撞室碰撞诱导解离电压为1.5 V,采用选择反应监测(SRM)模式扫描;氩气的碰撞气压为0.199 5 Pa。
2 结果与讨论
2.1 提取方法的优化
按1.4节的色谱-质谱条件检测已提取了植物激素的羊栖菜样品残渣,残渣中没有检出10种植物激素。将该残渣干燥,取1 g干燥样品(每组3个平行样),加入20 μL 1 mg/L的混合标准溶液,再加入1 mL 甲醇/水/甲酸(15∶4∶1,v/v/v)(含 0.5%BHT),超声(功率30 W,频率40 kHz)提取20 min,放入-20℃冰箱内避光浸泡提取;分别提取1、8、16、24 h,然后进行测定,计算目标物的回收率,结果如图1所示。可以看出,随着提取时间的延长,回收率逐渐提高,但是提取16 h和24 h的回收率变化不大,甚至有个别植物激素在提取24 h时其回收率略有降低,这是因为植物激素较不稳定,提取时间过长反而引起部分损失。综合考虑,选取提取16 h。

图1 提取时间对10种植物激素回收率的影响Fig.1 Effect of extraction time on the recoveries of the ten phytohormones
2.2 植物激素标准品的LC-MS分析
取1.3节中配制的10种植物激素混合标准储备液,稀释成1 mg/L的植物激素混合标准溶液,按1.4节的色谱-质谱条件进样分析,从10种植物激素混合标准溶液的色谱图(见图2)可以看出,在该LC-MS条件下,10种植物激素互不干扰,能够得到较好的分离。
以流动注射方式对10种植物激素标准溶液进行ESI-MS分析,吲哚乙酸、异戊烯腺嘌呤、玉米素、异戊烯腺苷、反式玉米素核苷、独角金内酯在正离子模式下主要产生[M+H]+准分子离子峰,其m/z分别为 176.0、204.2、220.0、336.1、352.0 和 299.3;水杨酸、茉莉酸、脱落酸和赤霉素在负离子模式下主要产生[M-H]-准分子离子峰,m/z分别为137.0、209.0、263.0、345.0。
在SRM模式下获得10种植物激素的特征碎片离子(见表1)。选取通道1的离子为定量离子,其他离子为辅助定性离子。

图2 10种植物激素标准品的选择反应监测离子流图Fig.2 Selected reaction monitoring chromatograms of the ten phytohormone standards

表1 10种植物激素标准品在SRM模式下获得的特征碎片离子Table 1 Characteristic fragment ions of the ten phytohormone standards obtained by TQMS in SRM mode
2.3 线性范围与检出限
用混合标准储备液分别配制用于正、负离子扫描模式的系列浓度的混合标准溶液,并进行测定,每个浓度测定3次,以目标组分定量离子的峰面积平均值(Y)对质量浓度(X,μg/L)进行线性回归分析,得到10种植物激素的线性方程和相关系数(r);以信噪比(S/N)为3确定10种组分的检出限(LOD),结果见表2。
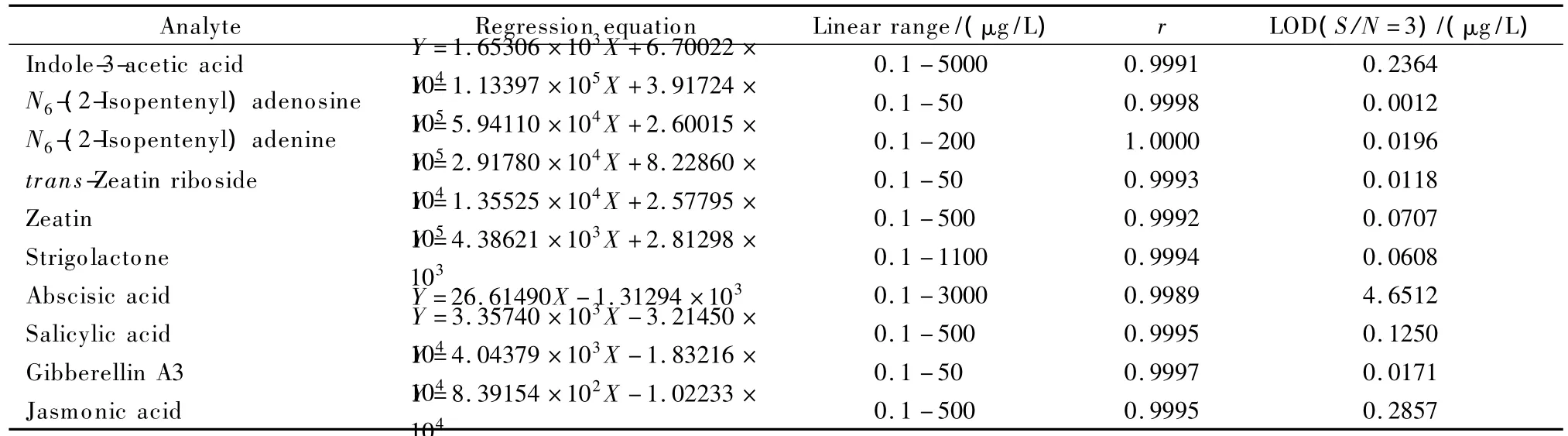
表2 10种植物激素的线性方程、线性范围、相关系数及检出限Table 2 Regression equations,linear ranges,correlation coefficients(r)and limits of detection(LODs)of the ten phytohormones
2.4 加标回收率和精密度
将已提取过植物激素的羊栖菜样品残渣干燥,取1 g干燥样品,加入质量浓度为1 mg/L的混合标准溶液20 μL,按照1.2节的方法处理样品,然后按1.4节的条件进行LC-MS分析,计算得到的加标回收率见表3。可见方法的加标回收率在72.24%~91.31%之间,相对标准偏差均不高于6.59%,表明本实验的可靠性较高。

表3 空白基质中10种植物激素的加标回收率和RSD(n=3)Table 3 Recoveries and RSDs of the ten phytohormones spiked in blank matrix(n=3)
2.5 羊栖菜各部位激素含量的测定
按照建立的方法对羊栖菜5个部位的10种植物激素含量进行了分析,每个部位样品测定3个平行样品,取平均值。表4为新鲜羊栖菜5个部位样品中10种植物激素含量的检测结果,可以看出,在新鲜样品中,各种激素的含量范围为未检出至4 041.431 ng/g。其中,吲哚乙酸、脱落酸在羊栖菜中总体含量比较高,吲哚乙酸主要分布在羊栖菜的茎中,含量达到4 041.431 ng/g,脱落酸主要分布在羊栖菜的主分支中,含量达到1 469.515 ng/g;茉莉酸和水杨酸都是特定环境刺激下诱导产生的植物激素,这两种激素在羊栖菜次生叶中含量较高,分别为259.983 ng/g和314.855 ng/g;异戊烯腺苷、异戊烯腺嘌呤、反式玉米素核苷和玉米素都属于细胞分裂素,表4中可见羊栖菜各部位异戊烯腺嘌呤的含量均高于异戊烯腺苷,这是因为在植物中异戊烯腺苷是游离态,异戊烯腺嘌呤是结合态。这也验证了植物中结合态细胞分裂素含量远远高于游离态的细胞分裂素这一结论[21]。赤霉素在羊栖菜次生叶及茎中含量较高,它的主要作用是促进细胞的伸长。独角金内酯是结构形式较新的一类植物激素,主要参与调控植物侧枝的形成[22-24],其含量在主分支中最高,达到534.833 ng/g,其次是在茎中,含量最低是在次生叶中,含量为3.360 ng/g。

表4 羊栖菜5个部位样品中10种植物激素的含量Table 4 Contents of the ten phytohormones in five parts of Sargasum fusiforme(Hary.)Seichell
3 结论
本文建立了一种采用液相色谱-三重四极杆质谱联用分析系统、电喷雾电离正/负离子扫描模式同时分析羊栖菜主分枝、侧分枝、初生叶、次生叶、茎等5个部位中吲哚乙酸、异戊烯腺苷、异戊烯腺嘌呤、反式玉米素核苷、玉米素、独角金内酯、脱落酸、水杨酸、赤霉素、茉莉酸等10种植物激素含量的方法。该方法的精密度良好,可靠性较高,可以用于同时分析多种植物激素。
[1] Luan Z W,Dong F,Ji Y B.Heilongjiang Medicine Journal(栾志伟,东方,季宇彬,等.黑龙江医药),2013,26(4):592
[2] Wang W,Lu J B,Wang C,et al.Inte J Biolog Macromole,2013,58:127
[3] Xie H J,Ye H X,Shen T,et al.Journal of Zhejiang Agricultural Sciences(谢何杰,叶慧娴,沈婷,等.浙江农业科学),2014(4):487
[4] Yu Z Q,Shuai L,Li S Y,et al.Journal of Medical Research(于竹芹,帅莉,李生尧,等.医学研究杂志),2011,40(8):43
[5] Si Y Y,Yu X Y,Li S B,et al.Guangdong Agricultural Sciences(司圆圆,余祥勇,李双波,等.广东农业科学),2013,40(4):144
[6] Zhang S S,Cai Z Y,Wang X L.PNAS,2009,106(11):4543
[7] Santner A,Calderon-Villalobos L I A,Estelle M.Nat Chem Biol,2009,5(5):301
[8] Li Y N,Wu H L,Zhu S H,et al.Anal Sci,2009,25:83
[9] Zhang L,Guan H L,He Z K.Science China:Chemistry,2010,53(1):245
[10] Ji Y B,Wang C,Wu T,et al.Chinese Journal of Chromatography(季宇彬,王翀,吴涛,等.色谱),2007,25(3):322
[11] Li Q,Wang R Z,Huang Z G,et al.Chinese Chemical Letters,2010,21:472
[12] Liu Z Y,Shen C Z,Dong Y Y.Chemistry and Bioengineering(刘志勇,沈春章,董元彦.化学与生物工程),2006,23(2):55
[13] Zhou Y M,Xin X.Food Science(周艳明,忻雪.食品科学),2010,31(18):301
[14] Zhang Y Q,Zhong Y L,Gao C Y,et al.Chinese Journal of Chromatography(张玉琼,仲延龙,高翠云,等.色谱),2013,31(8):800
[15] Durgbanshi A,Arbona V,Pozo O,et al.J Agric Food Chem,2005,53:8437
[16] Chiwocha S D S,Cutler A J,Abrams S R,et al.Plant J,2005,42:35
[17] Pan X,Welti R,Wang X.Phytochemistry,2008,69:1773
[18] Xie H B,Zhou M Y,Zhao H F,et al.Chinese Journal of Chromatography(谢寒冰,周明莹,赵海峰,等.色谱),2014,32(5):493
[19] Kojima M,Kamada-Nobusada T,Komatsu H,et al.Plant Cell Physiol,2009,50(7):1201
[20] Wu Q,Wang L,Wu D P,et al.Chinese Journal of Chromatography(吴倩,王璐,吴大朋,等.色谱),2014,32(4):319
[21] Olsson J,Claeson K,Karlberg B,et al.J Chromatogr A,1998,824:231
[22] Rameau C.C R Biologies,2010,333:344
[23] Gomez-Roldan V,Fermas S,Brewer P B,et al.Nature,2008,455:189
[24] Umehara M,Hanada A,Yoshida S,et al.Nature,2008,455:195
