VereFlu芯片检测 H 7 N 9亚型流感病毒的效果评价
2014-08-02李裕昌吴晓燕李佳明张晓松张雪松康晓平
李裕昌,张 雨,吴晓燕,李佳明,郑 旸,张晓松,张雪松,康晓平
VereFlu芯片检测 H 7 N 9亚型流感病毒的效果评价
李裕昌,张 雨,吴晓燕,李佳明,郑 旸,张晓松,张雪松,康晓平
目的:验证VereFlu芯片检测H7N9亚型流感病毒的特异性和准确性,为应对流感疫情提供新的实验室检测方法。方法:对流感病毒H7N9亚型、H5N1亚型、H1N1亚型的病毒培养物及10份H7N9感染疫区的鸡肛拭子标本,提取样本的RNA,采用VereFlu芯片法和Realtime RT-PCR两种检测方法。评估VereFlu芯片的检测效果。结果:对于3种病毒培养物的检测,VereFlu芯片均检测到不同亚型的特定阳性信号,每种亚型病毒均未出现交叉反应信号,表明VereFlu芯片具有较好的检测特异性;10份未知标本中有8份检测流感病毒阴性,2份检测流感病毒阳性,编号为106号及503号,其中106号检测到H7及H9亚型的阳性信号,503号仅检测到H9亚型的阳性信号。Realtime RT-PCR对10份未知标本进行H7亚型核酸检测,从两份流感阳性标本中均检测到H7亚型核酸,高通量测序证实106号和503号标本中均存在H7及H9亚型核酸。结论:VereFlu芯片可用于不同型别流感病毒的检测和分型,包括新爆发的H7N9亚型病毒同样适用,但检测H7N9亚型的灵敏度低于Realtime RT-PCR法。
H7N9亚型流感病毒;检测;基因芯片
流感病毒(Influenza virus),是一种分节段的单负链RNA病毒,属于正黏病毒科,包括人流感病毒和动物流感病毒,是流行性感冒的最主要的病原体。根据核蛋白(Nucleoprotein,NP)和基质蛋白(Matrix protein,MP)的抗原性不同,流感病毒被分为甲、乙、丙三型,其中甲型流感病毒抗原性易发生变异,多次引起世界性大流行。甲型流感病毒根据其表面病毒血凝素(Hemagglutinin,HA)和神经氨酸酶(Neuraminidase,NA)抗原性的不同,又分为若干亚型。迄今发现HA有16种亚型,NA有9种亚型。目前可引起人类感染的甲型流感病毒亚型主要有H1、H3、H5、H7、H9等亚型,1918~1919年的西班牙流感的世界性大流行导致2000万~4000万人死亡,2009年的新型H1N1流感在全球范围内共导致至少18 500人感染,今年我国禽流感病毒H7N9亚型流行已导致135例感染,其中44例死亡[1-2]。由于禽流感病毒H7N9亚型为新发病原体,目前仅有WHO推荐的荧光定量PCR可供使用,技术方法单一,开发H7N9的检测技术对于H7N9亚型病毒的快速准确诊断具有重要意义。
基因芯片技术是一种大规模集成的固相杂交技术,与传统基因诊断技术相比,DNA芯片技术具有微型化、高通量、高度平行性和高速性的显著特点[3]。新加坡Veredus laboratories所开发的VereFlu芯片,可靶向H1、H3、H5、H7、H9亚型及B型流感病毒,本研究利用H1N1、H5N1、H7N9亚型病毒培养物核酸,对VereFlu芯片检测系统的特异性及分型效果进行了初步验证;采集了H7N9感染疫区的禽标本,与荧光定量PCR方法相比较,并对我国2013年新出现的H7N9亚型病毒的检测效果进行了评估,拟为VereFlu芯片的应用提供参考。
1 材料和方法
1.1 病毒培养物及标本来源H5N1亚型及新甲型H1N1亚型流感病毒培养物为本实验室保存;H7N9亚型病毒培养物是从我国2013年流行的甲型流感H7N9确诊患者咽拭子分离到的;10份未知标本为同时期安徽疫区附近养鸡场采取的禽类肛拭子。
1.2 仪器及试剂VereFlu芯片反应控制仪和扫描仪均购自Veredus laboratories,离心机为Beckman公司的GS-15R,实时荧光定量PCR仪为Loche LightCycler 2.0,RNA提取试剂盒为ambion的PureLinkTMRNA Mini Kit,实时荧光定量试剂盒为TaKaRa的One Step primeScript RT-PCR kit, PCR扩增试剂盒为QIAGEN的Quantitect Virus+ ROX Viral Kit,VereFlu芯片试剂盒购自Veredus laboratories,该芯片包括34组甲型流感病毒种特异性的探针(人H1N1探针4组,新型H1N1探针7组,H3N2探针4组,H5N1探针8组,H7探针3组,H9N2探针5组,乙型流感探针3组,每组探针重复2个位点),2组RT-PCR质控探针(GAPDH、AT730),6个杂交阳性质控探针(AT683),8个杂交阴性质控探针(AT809)以及4个方位探针(psbA_4、psbA_6),其阵列设计见表1。
1.3 RNA提取 按试剂盒说明书操作。
1.4 RealtimeRT-PCR检测样本RNA按试剂盒说明书配制反应体系,引物和探针使用国家流感中心下发的CNIC H7F、CNIC H7R、CNIC H7P和CNIC N9F、CNIC N9R、CNIC N9P,反应条件:RT:42℃,10 min;95℃,10 s;PCR:95℃,10 s;55℃,30 s,采集荧光信号,40个循环。
1.4.1 RT-PCR反应条件:RT:50℃,20 min;95℃,5 min;PCR:95℃,15 s;50℃,30 s;72℃,45 s,45个循环。见表2。
1.4.2 杂交 按表3配制反应体系。反应条件:95℃,2 min;55℃,30 min。
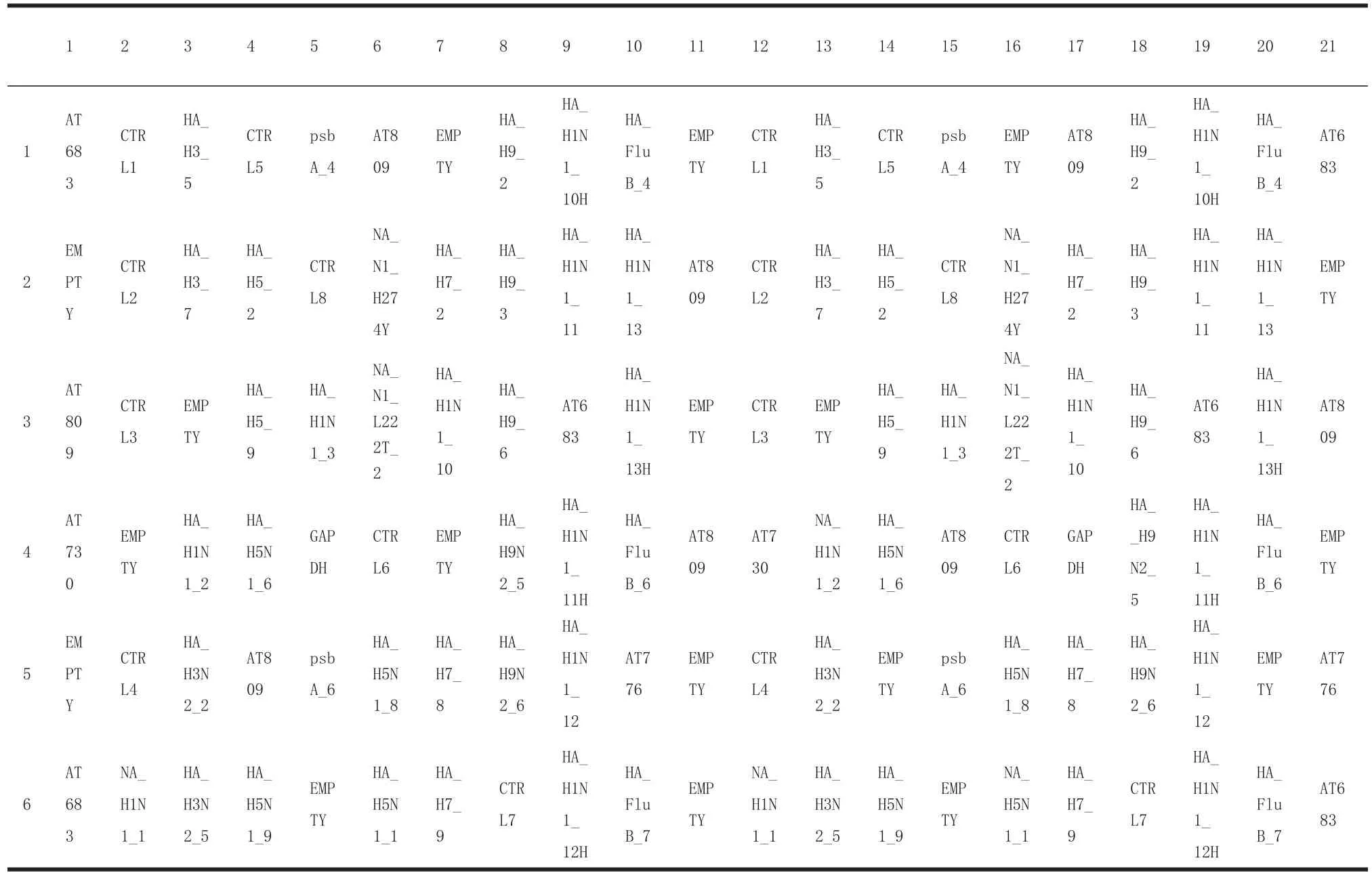
表1 VereFlu芯片探针阵列

表2 RT-PCR配制反应体系

表3 杂交反应体系
1.4.3 洗涤 用去离子水将Wash Buffer Concentrate稀释10倍,倒入50 ml离心管中,每管50 ml,将芯片置于上述装满洗涤液的离心管中,3000RPM离心2 min,然后倒出离心管中洗涤液,3000RPM离心2 min,甩干芯片。
1.4.4 扫描 将芯片置于扫描仪中扫描,读取结果。
2 结果
2.1 VereFlu芯片检测甲型流感病毒H5N1、H1N1和H7N9亚型病毒培养物核酸,基因芯片检测结果表明,H5N1的8条检测探针(图1,A)。H1N1的7条检测探针均为强阳性(图1,B)。荧光信号均大于10 000,并与其他型别探针无交叉反应。见表4、表5。而对于2013年新发的H7N9亚型病毒检测,3组探针也均检测到阳性信号(图1,C)。虽然仅有一组的阳性信号值大于10 000。见表6。同样表明该芯片能够检测到H7N9亚型病毒。由于该检测芯片研制时间早于H7N9亚型新发病毒的出现,而该芯片上的检测探针可特异检测到新发H7N9亚型病毒的核酸,表明该芯片对于新发流感病毒的分型检测具有重要意义。
10份禽未知样本的检测结果表明,其中有8份标本未出现任何亚型流感病毒的阳性信号,2份标本出现了流感病毒的阳性信号:编号为503号的标本出现了3组H9探针的阳性信号。见图1,D和表6。编号为106号的标本出现2组H9N2特异性探针的阳性信号和1组H7特异性探针的阳性信号。见图1,E和表7。

图1 VereFlu芯片检测甲型流感病毒培养物及标本注:A H5N1病毒培养物;B H1N1病毒培养物;C H7N9病毒培养物;D禽肛拭子标本503;E禽肛拭子标本106
2.2 Realtime RT-PCR检测甲型流感病毒 对10份样本,荧光定量PCR同样检测为8份流感病毒核酸阴性,2份流感病毒核酸阳性,但对于流感阳性标本106号和503号,两份标本均检测到了H7亚型核酸,仅样本编号为106标本检测到N9亚型核酸,考虑到H7特异性引物灵敏度高于N9特异性引物,样本编号为503号中可能含有N9核酸,并且106号标本检测CP值低于503号,表明106号中的H7及N9核酸含量高于503号。见表8、表9。

表4 VereFlu芯片检测 H 5 N 1阳性样本

表5 VereFlu芯片检测H1N1阳性样本
Kappa=0.615,VereFlu芯片法和RealtimeRT-PCR检测结果具有较好的一致性,通过对比检测结果不难看出两种方法的不一致性主要是由于检测灵敏度不同。见表10。

表6 VereFlu芯片检测 H 7 N 9阳性样本

表7 VereFlu芯片检测样本编号503

表8 VereFlu芯片检测样本编号106
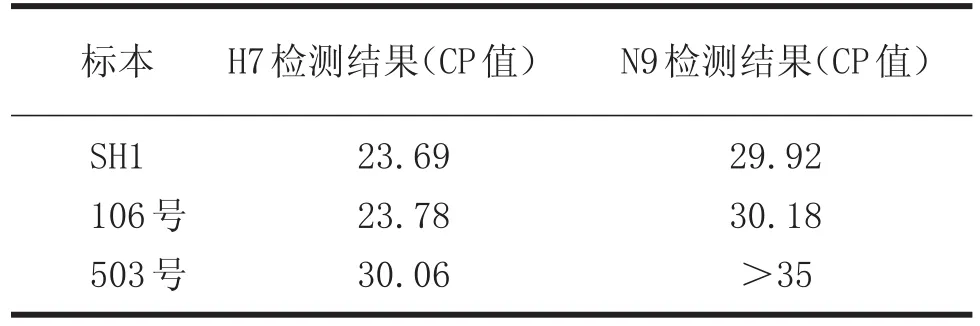
表9 Realtime RT-PCR检测结果
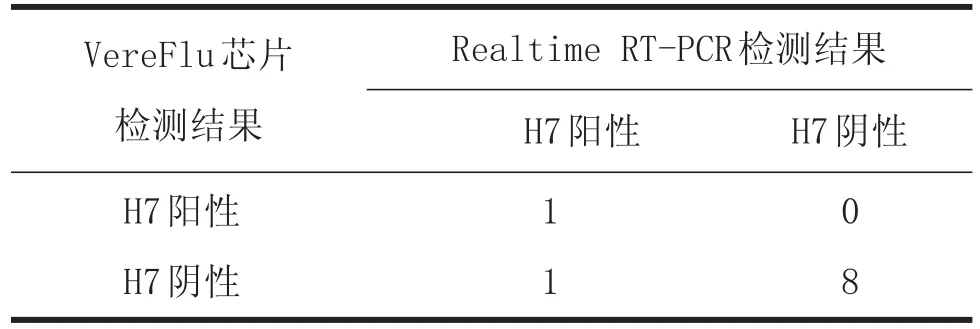
表10 两种方法检测结果比较

表11 高通量测序检测结果
2.3 高通量测序 对于样本编号106和503,高通量测序检测为H7N9和H9N2混合感染。见表11。
3 讨论
基因芯片技术已问世二十余年,其高通量的优势曾备受研究者的青睐,其研究应用屡见报道[4-15],但由于实验过程及结果分析程序相对复杂,鲜有商品化的检测试剂。本研究所使用的VereFlu芯片检测系统,集杂交系统与结果检测及分析系统为一体,仪器设备体积小,操作简便,扩增及杂交时间短,4 h即可完成整个检测流程,很适合基层检验单位的推广和使用。此外,VereFlu芯片具有34种甲型流感特异性探针,3组乙型流感探针,基本上对流行的流感病毒实现了全部覆盖,流感疫情爆发时,可快速对病原体进行分型,对疫情防控具有重要意义。
本课题组主要致力于新发病毒检测鉴定研究,引进VereFlu芯片检测系统,拟为流感病毒的检测、分型提供技术补充。本文初步探讨了对该检测系统的验证情况。
由于该检测系统在研发过程中,已对多种不同亚型的多种病毒株进行了检测验证,探针经过数轮优化,已基本可以保证检测分型结果的特异性和准确性。因此,本研究对该检测系统的验证过程中,重点关注其对新发病毒H7N9亚型的检测效果。本研究提取了高致病性H5N1、2009年流行的H1N1病毒培养物、2013年新爆发的H7N9病毒培养物的核酸及10份未知禽样本进行检测,病毒培养物样本的检测结果表明,该检测系统具有较高的特异性,芯片上其他亚型的甲型流感探针未与H5N1、H1N1和H7N9样本发生交叉反应,可准确用于病毒培养物核酸的分型。尽管H7N9亚型病毒的出现时间晚于该检测系统的组装时间,但该芯片同样可检测到H7亚型病毒核酸,但3条探针,仅一条出现强阳性,推测原因,在于新发H7N9亚型病毒核酸与芯片上的H7检测探针序列具有一定差异,从而导致两条检测探针未出现强阳性信号,同时也将影响芯片的检测灵敏度,探针优化后可以适用新爆发的H7N9亚型病毒。
目前市售的试剂盒仅能区分甲型流感和乙型流感,未见能鉴别甲型流感病毒亚型的相关产品,关于甲型流感分型检测多重PCR和基因芯片方法虽有报道,但是目前这些方法还仅限于实验室研究[16-17]。在对H7N9亚型流感的防控过程中,我们利用该芯片检测系统对从疫区采集到的10份禽肛拭子进行了检测。从中检测到1份H7亚型感染标本,而荧光定量PCR筛查到2份H7亚型病毒感染,进而对该两份流感阳性标本进行了高通量测序,确定该两份标本均为H7亚型及H9亚型的混合感染。表明对于新发病毒H7N9,VereFlu芯片的检测灵敏度低于荧光定量PCR,但VereFlu芯片可同时快速筛查多种流感病毒亚型,可以作为实验室对包括H7N9在内的多种亚型流感病毒检测分型的技术补充。
[1]李 凡,刘晶星.医学微生物学[M].人民卫生出版社(第7版),2010:246-250.
[2]Uyeki TM,Cox NJ.Global concerns regarding novelinfluenzaA(H7N9)virusinfections[J].N Engl J Med,2013,368(20):1862-1864.
[3]杨银辉,祝庆余.基因芯片技术在病毒性病原体检测中的研究进展[J].生物技术通讯,2008,19(4):600-603.
[4]Wang D,Coscoy L,Zylberberg M,et al.Microarray-based detect ion and genotyping of viral pathogens[J].Proc Natl Acad Sci USA,2002,99(24):15687-15692.
[5]杨银辉,韩伟国,胡玉洋,等.人类致病病毒属水平基因筛查芯片的制备及其在黄病毒属检测中的初步应用[J].2006,30(5):401-405.
[6]杨银辉,杨瑞馥,常国辉,等.基因芯片技术检测10种烈性RNA病毒[J].解放军医学杂志,2006,31(3):203-206.
[7]朱晓光,杨银辉,康晓平,等.13种虫媒病毒基因芯片检测方法的建立[J].解放军医学杂志,2007,8(32):832-835.
[8]BanérJ,GyarmatiP,YacoubA,et al.Microarray-based molecular detection of foot-and-mouth disease,vesicular stomatitis and swine vesicular disease viruses,using padlock probes[J]. J Virol Methods,2007,143(2):200-206.
[9]李永强,康晓平,王伟周,等.人兽共患病病毒基因芯片检测敏感性的测定[J].解放军医学杂志,2009,34(2):219-222.
[10]李永强,康晓平,孙庆歌,等.基因芯片技术检测重要人兽共患病病毒方法的建立[J].中国生物化学与分子生物学报,2009,25(11):1058-1063.
[11]Kang XP,Li YQ,Sun HH,etal.Subtype identification of the novel A H1N1 and other human influenza A viruses using an oligonucleotide microarray[J]. Archieves of Virology,2010,155(1):55-61.
[12]Kang XP,Qin CF,Li YQ,et al.Improvement of the specificity of a pan-viral microarray by using genus-specific oligonucleotides and reduction of interference by host genomes[J].Journal of medical virology,2011,83(9):1624-1630.
[13]Leveque N,Van Haecke A,Renois F,et al.Rapid virological diagnosis of central nervous system infectionsbyuseofamultiplexreverse transcription-PCR DNA microarray[J].JClin Microbiol,2011,49(11):3874-3879.
[14]Leblanc N,Cortey M,Fernandez Pinero J,et al. Developmentofasuspensionmicroarrayfor the genotyping of african swine fever virus targeting the SNPs in the C-terminal end of the p72 gene region of the genome[J].Transbound Emerg Dis,2013,60(4):378-383.
[15]Donatin E,Buffet S,Leroy Q,et al.A DNA microarray for the versatile diagnosis of infectious diarrhea[J].APMIS,2013,121(7):634-642.
[16]林 方,熊 伟,康晓平,等.人类流感病毒多重PCR分型方法的建立[J].军事医学科学院院刊,2010,34(4):331-333.
[17]李稀罕,王 宇,刘方政,等.甲型流感病毒流行毒株检测和分型基因芯片的研制[J].微生物学报,2010,50(3):400-405.
(收稿:2013-08-28修回:2013-12-20编校:齐 彤)
Evaluation of VereFlu gene microarray on detecting H 7 N 9 subtype influenza virus
LI Yu-chang,ZHANG Yu,WU Xiao-yan,LI Jia-ming,ZHENG Yang,ZHANG Xiao-song,ZHANG Xue-song,KANG Xiao-ping.Academy Fifth Institute of Military Medical Sciences,Beijing 100071,China
Corresponding author:KANG Xiao-ping,E-mail:kangxiaoping@163.com
Objeccttiive:To validate the specialty and accuracy of VereFlu detecting target sample,and provide a new laboratory approach to identify the influenza subtypes during flu breaks.Metthodss:Extract RNA of H7N9 sample,H5N1sample,H1N1sample and 10 anal samples from chickens fed in H7N9 affected areas,proceed VereFlu and Realtime RT-PCR to determine the pathogens.Ressullttss:We have found specific positive signal respectively from H7N9,H5N1 and H1N1 sample through VereFlu without any cross action,indicating VereFlu performs excellent in specificity.From 2 of the 10 anal samples coded as 106 and 503,we have got influenza A positive signal.In addition,sample 503 is H7 positive while sample 106 is positive for both H7 and H9.We have found both sample 106 and sample 503 are H7 positive through Realtime RT-PCR,furthermore,we have confirmed H7 and H9 gene in both 503 and 106 through High-throughput sequencing.Conclussiion:We could utilize VereFlu to detect the target gene in nucleic acid sample specifically,however,the sensitivity of which is lower than Realtime RT-PCR.
H7N9 influenza virus;detection;gene microarray
S 854.43
A
2095-3496(2014)01-0003-05
国家传染病重大专项课题(20112X10004-001;2013ZX10004-606;2013ZX10004-803)
100071北京,军事医学科学院五所(李裕昌,张 雨,吴晓燕,李佳明,郑 旸,张晓松,张雪松,康晓平)
康晓平,E-mail:kangxiaoping@163.com
