细胞外信号调节蛋白激酶5 / 凋亡调节蛋白信号途径在低温诱导心肌细胞损伤及凋亡中的调控作用
2014-07-31王耀晟程晓曙洪葵吴宗贵李毅刚
王耀晟, 程晓曙, 洪葵 ,吴宗贵, 李毅刚
人体正常核心体温保持在36.6~37.6 ℃,暴露于极端寒冷时,体内核心温度稳态被破坏[1],刺激交感神经,影响血管收缩,造成血压、心率波动,诱导血小板活化、促进血栓形成[2]。低温诱导心肌损伤的细胞和分子生物学机制仍不完全清楚。体外研究报告发现低温刺激加速心肌细胞(CMs)凋亡[3]。凋亡的机制涉及许多方面,如线粒体膜通透性、细胞内活性氧簇(ROS)和钙离子水平等[4]。线粒体膜电位(ΔΨm)破坏可导致电子传递链中断,停止氧化磷酸化,并增加细胞内活性氧,从而促进细胞损伤[5]。细胞内钙超载,也可导致异常线粒体氧化磷酸化,造成细胞的不可逆的损害[6]。故此本研究探讨了低温刺激诱导的心肌细胞损伤与线粒体途径细胞凋亡、ROS爆发,以及细胞内钙超载的关联性。凋亡调节蛋白Bim是Bcl-2家族中的促凋亡成员,其在各个器官中广泛表达[7]。在不同类型细胞中,Bim的转录水平、亚细胞定位和磷酸化形式各不相同[8]。目前,Bim在低温刺激引起心肌细胞凋亡中的具体机制不明。研究发现Bim的上游存在调控物质,可能与细胞外信号调节蛋白激酶(ERK)传导通路有关。抑制ERK可产生Bim的上调效应[9]。而同属丝裂原活化的蛋白激酶(MAPK)亚家族成员的ERK5是否参与其中,少见报道。本研究着重探讨ERK5 / Bim途径在低温诱导心肌细胞损伤及凋亡中的调控作用。
1 材料与方法
实验动物与材料:2012-01至2012-12选择新生1~2天的sprague dawley(SD)乳鼠(中国科学院上海实验动物中心,合格证号: 中科院动管会第005号)。改良Eagle 培养基( DMEM) 、胎牛血清、胰蛋白酶 (美国Gibco 公司) ,培养皿( 美国Corning公司),5-溴脱氧尿嘧啶核苷(BrdU,美国Sigma 公司),脂质体转染试剂盒(美国Invitrogen公司),蛋白抽提试剂盒(武汉博士德公司)。羊抗鼠 Bim EL抗体、ERK5抗体、p-ERK5抗体(北京爱迪博公司),β-肌动蛋白(β-actin内参照)抗体和抗山羊活化辣根过氧化物酶-IgG抗体(美国Santa Cruz 公司),化学发光试剂盒(英国Amersham公司)。膜联蛋白V- 荧光素 /碘化丙啶(Annexin V-FITC / PI)细胞凋亡检测试剂盒(美国 BD Pharmingen公司)。钙离子荧光(Fluo-3AM)探针(北京泛博生化公司)。 6 -羧基-2', 7'-二氯二氢荧光素二乙酸酯(6-carboxy-H2DCFHDA)、5, 5', 6, 6'- 四氯 - 1, 1, 3, 3'- 四乙基苯并咪唑-硫杂羰花青碘化物(JC-1,美国Invitrogen公司)。
原代心肌细胞培养:乳鼠浸泡在70%酒精内麻醉处死。取心室组织温浴PBS溶液洗涤后剪碎,以0.25%胰蛋白酶在37℃温浴消化10分钟。加入含10%胎牛血清DMEM终止消化。弃上清液后加入0.25%胰蛋白酶在37℃温浴消化15分钟,收集上清液。上述消化步骤重复四次。收集所有上清液室温下1500 转/分钟离心10分钟,细胞重悬后以 5×104cells/cm2密 度 铺 皿 培 养, 加 入 0.1 ml/ L BrdU。 24小时后换液备实验用。
小干扰RNA干预:针对大鼠Bim的siRNA购自美国Sigma公司(参考序列编号:NM_022612)。大鼠ERK5特异性siRNA设计序列如下:#1:5'-CAGUCACUUGUGCCACCUATT-3'# 2:5'-GGAGGAAUUCUUAAACCAATT-3';# 3:5'-GGCCCUGUAUCUCAGACUATT-3'(参考序列编号:NM_002749)。胰蛋白酶消化心肌细胞,接种于60毫米规格平皿,培养24小时后转染siRNA。使用脂质体为转染介质,以非编码siRNA作为对照。转染 48小时后,用于低温刺激干预。
低温刺激干预:低温刺激设定为:细胞置于35℃、5%CO2细胞培养箱,每天8小时,共干预4天(共计32小时的低温刺激)。低温刺激外的时间,细胞置于正常培养条件下(37℃,5%CO2)。对照组设定为正常37℃,5%CO2条件中全程培养4天。
实验分组:对照组;低温刺激组;低温刺激加非编码siRNA即阴性对照组;低温刺激加Bim siRNA组(加Bim组);低温刺激加ERK5 siRNA组(加ERK5组);低温刺激加ERK5 siRNA、Bim siRNA共转染组(共转染组)。所有实验检测均重复3次。
蛋白质的提取和免疫印迹分析:胰酶消化法收集各实验组细胞,蛋白提取遵试剂盒说明书。通过蛋白定量分析仪(德国Eppendorf公司)进行蛋白定量,-20℃储存蛋白样本用于免疫印迹分析(Western blot)。总蛋白提取物以8%凝胶电泳后半干转至硝酸纤维素膜,予以1:200稀释的BimEL、ERK5 / 磷酸化ERK5抗体,1:2000稀释的β-肌动蛋白抗体孵育过夜。TBST缓冲液洗膜,室温下以1:10000稀释的抗山羊IgG-HRP孵育60分钟。TBST缓冲液洗涤后,暴露于化学发光试剂,曝光胶片。条带量化分析使用Image J软件(美国国立卫生研究院)。
细胞凋亡检测:采用 Annexin V-FITC / PI细胞凋亡检测试剂盒,以流式细胞仪(美国BD公司)检测细胞凋亡。Annexin V-FITC可识别细胞凋亡, PI作为非特异性的DNA染料,可结合非存活细胞。Annexin V-FITC阳性细胞总百分比视为总细胞凋亡率。
细胞内钙离子水平检测:以 5 μmol/ L Fluo-3AM 加载细胞,在37℃孵育30分钟,488 nm氩激光流式细胞术进行检测(美国BD公司)。记录1×104个事件,计算荧光强度。细胞内钙离子水平的数值计算公式为:[Ca2+]i(nmol / L)= KD(F-F)/(Fmax-F)。Kd=400 nmol / L。Fmax为加入钙离子载体后的测量值,Fmin为加入钙离子螯合剂乙二胺四乙酸后的测量值[10]。
ROS检测:6 - 羧基 H2DCFHDA 作为细胞渗透性染料,可被活性氧氧化成高度荧光物质,用以测量各组细胞内ROS[11]。荧光测定条件设定为在488 nm激发,测量值单位表示为AU。
线粒体膜电位检测:线粒体膜电位(ΔΨm)通过JC-1染料结合流式细胞仪检测。 JC-1可聚集在完整的线粒体,发出明亮的红色荧光。线粒体膜电位中断时, JC-1染料聚集受到抑制,以单体形式保持在细胞质中,发出绿色荧光。 37℃下使用 10 μg/ml JC-1孵育细胞15分钟。荧光显微镜下观察红色和绿色荧光。重悬细胞后通过流式细胞仪进行荧光强度分析。
统计分析:数据均表示为平均值±标准差,进行单向方差分析(ANOVA)。方差不齐时使用秩和检验。P<0. 05 认为差异有统计学意义。统计图表由GraphPad Prism 4.0 软件生成。
2 结果
与对照组比较,低温刺激组、加ERK5组、阴性对照组的Bim蛋白表达明显增加(低温刺激组:1.04±0.09,加ERK5组:1.54±0.14,阴性对照组:1.04±0.08 vs 对照组:0.24±0.03),差异有统计学意义(P<0.01)。 与低温刺激组比较,加ERK5组Bim蛋白表达明显增加(低温刺激组:1.04±0.09 vs 加 ERK5 组:1.54±0.14,P<0.05),差异有统计学意义(图1A)。低温刺激组与对照组比较,心肌细胞的ERK5蛋白表达无明显差异,但磷酸化ERK5蛋白表达增高(低温刺激组:0.84±0.05 vs 对照组 0.41±0.02,P<0.01),差异有统计学意义(P<0.01)。低温刺激组与加Bim组比较, Bim siRNA不影响ERK5表达,但磷酸化ERK5蛋白表达减低(低温刺激组:0.84±0.05 vs 加Bim组:0.49±0.03,P<0.01),差异有统计学意义。图1B
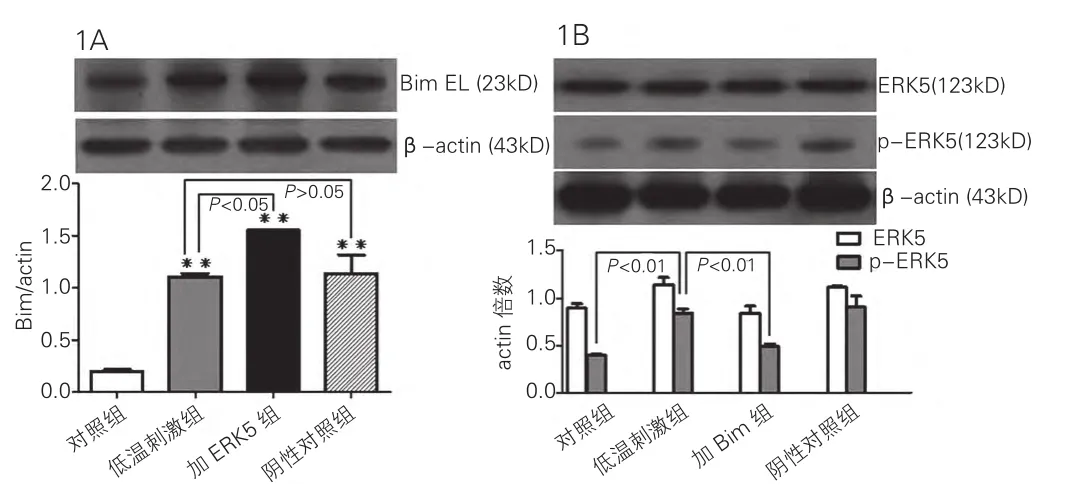
图1 在低温刺激干预下的心肌细胞中,ERK5 siRNA对Bim蛋白表达的影响(1A),以及Bim siRNA对ERK5 / p-ERK5蛋白表达的影响(1B)
细胞凋亡率检测示低温刺激组比对照组凋亡率明显增高[低温刺激组:(32.45±2.01)% vs 对照组:(9.08±1.46)%,P<0.01]。 Bim siRNA缓解低温刺激诱导的心肌细胞凋亡,加Bim组比低温刺激组明显减低 [加 Bim 组:(15.88±1.02)% vs 低温刺激 组 :(32.45±2.01)%,P<0.01], 而 加 ERK5组的ERK5 siRNA导致凋亡率比低温刺激组进一步增高[加ERK5组:(41.30±4.21)%vs 低温刺激组:(32.45±2.01)%,P<0.01]。Bim siRNA 可取消 ERK5 siRNA的促凋亡作用,加ERK5组比共转染组明显降低[加ERK5组:(41.30±4.21)% vs 共转染组:(27.01±2.82)%,P<0.05],差异均有统计学意义。图2
低温刺激下的心肌细胞内存在钙离子超载,低温刺激组明显高于对照组[低温刺激组:(625±27)nmol / L vs 对照组:(361± 52) nmol/L,P<0.01]。Bim siRNA减弱低温刺激诱导的细胞内钙离子超载,加Bim组明显低于低温刺激组[加Bim组:(469±33)nmol/L vs 低温刺激组:(625±27) nmol/L,P<0.05]。ERK5 siRNA则加重低温刺激诱导的细胞内钙离子超载,加ERK5组明显高于低温刺激组[加ERK5组:(1154±56)nmol/L vs 低温刺激组:(625±27) nmol/L,P<0.01]。Bim siRNA 可代偿 ERK5 siRNA 的钙离子超载效应,共转染组明显低于加ERK5组[共转染组:(673±59) nmol/L vs 加 ERK5 组:(1154±56) nmol/L,P<0.01],差异均有统计学意义(图3)。非编码siRNA对细胞内钙离子水平无影响。
低温刺激在心肌细胞中诱导ROS水平增高,低温刺激组明显高于对照组(低温刺激组:10.08±0.85 vs 对 照 组:3.61±0.71,P<0.01 ),Bim siRNA 可抑制此低温诱导的ROS爆发,加Bim组明显低于低温刺激组(加 Bim 组:4.82±0.48 vs 低温刺激组:10.08±0.85,P<0.01)。 ERK5 siRNA 诱 发 更 严 重的ROS激活,加ERK5组明显高于低温刺激组(加ERK5 组:18.34±1.22 vs 低 温刺 激组:10.08±0.85,P<0.01), Bim siRNA 则可缓解 ERK5 siRNA 对 ROS活性的增强,共转染组明显低于加ERK5组(共转 染 组:10.02±0.87 vs 加 ERK5 组:18.34±1.22,P<0.01),差异均有统计学意义。图4
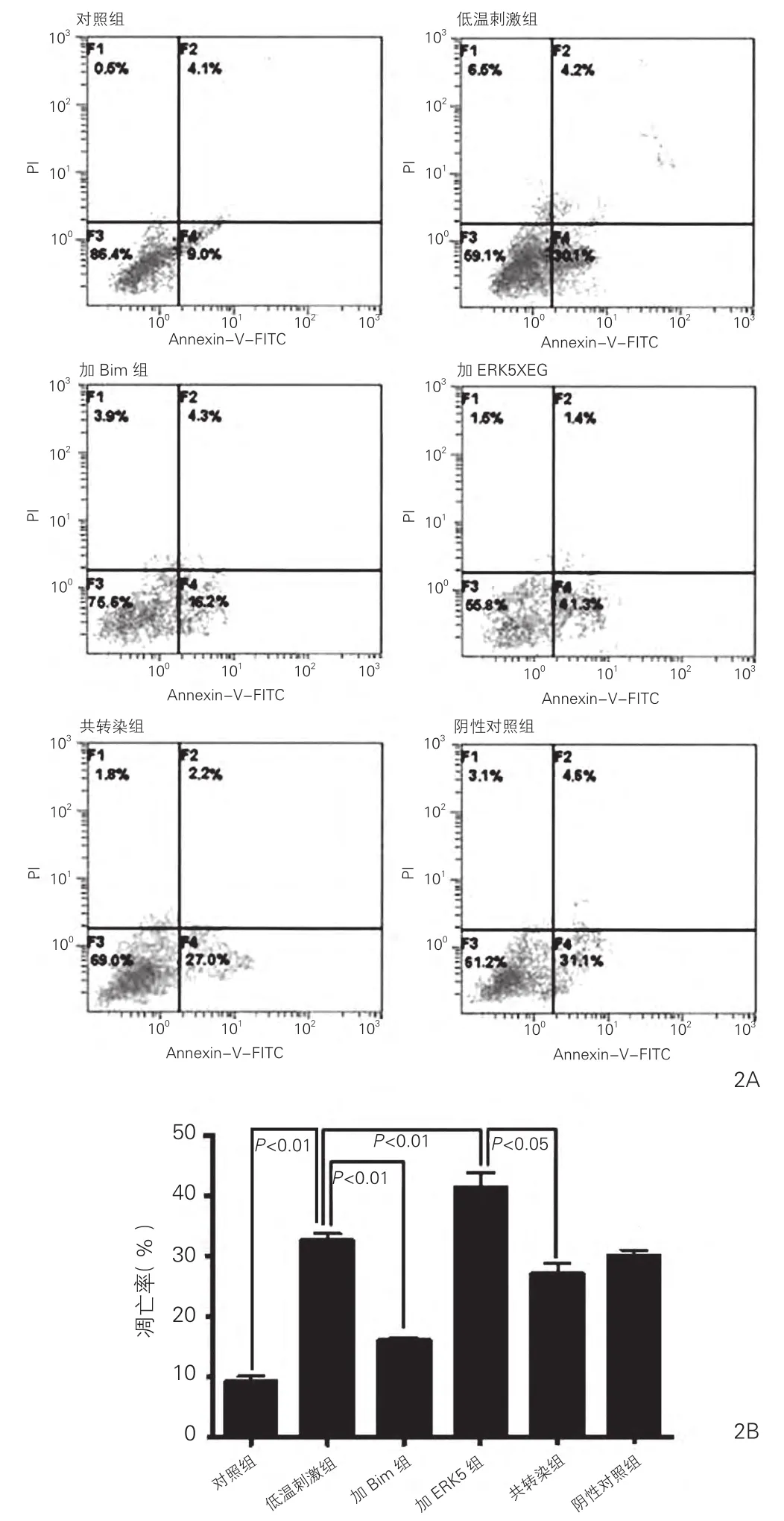
图2 ERK5 siRNA以及Bim siRNA 对低温刺激下心肌细胞凋亡的影响。流式细胞散点图(2A);各组凋亡率(2B)
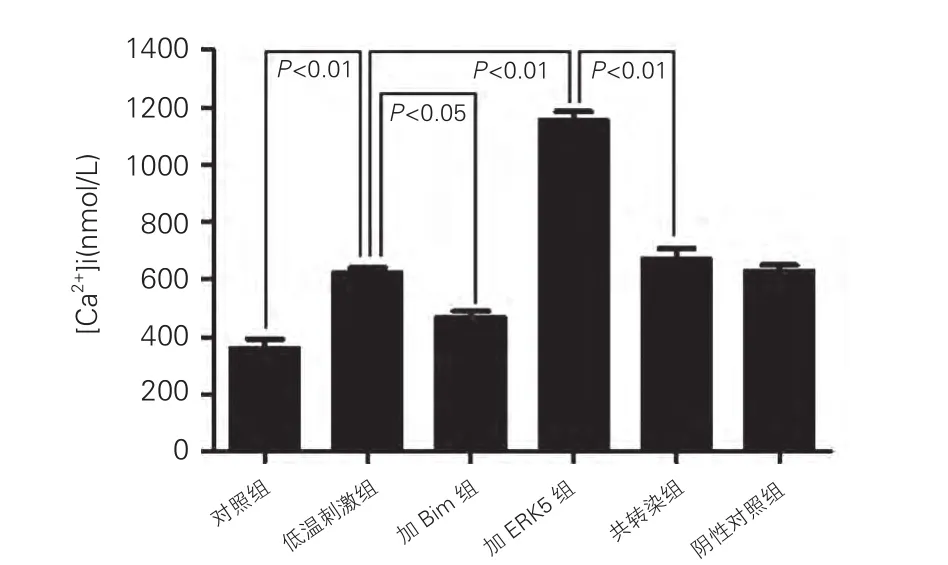
图3 ERK5 siRNA以及Bim siRNA 对低温刺激下心肌细胞内钙离子超载的影响。余注见图1
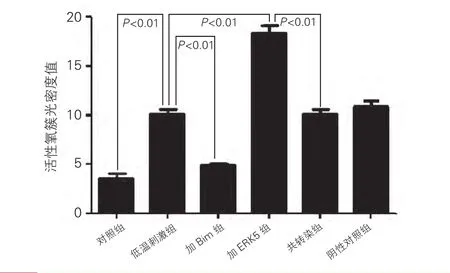
图4 ERK5 siRNA以及Bim siRNA对低温刺激下心肌细胞内活性氧活动的影响。余注见图1
心肌细胞线粒体膜电位在低温刺激下受到破坏,低温刺激组明显低于对照组(低温刺激组:51.32±5.57 vs 对 照 组:83.29±7.2,P<0.01),Bim siRNA可恢复低温刺激损害的ΔΨm,加Bim组明显高于低温刺激组(加Bim组:69.26±7.13 vs 低温刺激组:51.32±5.57,P<0.01),ERK5 siRNA诱导更严重的ΔΨm破坏,加ERK5组明显低于低温刺激组(加ERK5组:30.42±8.32 vs 低温刺激组:51.32±5.57,P<0.01),而 Bim siRNA可代偿ERK5 siRNA对ΔΨm的破坏,共转染组明显高于加 ERK5组(共转染组:47.18±5.11 vs 加ERK5 组:30.42±8.32,P<0.01 )。图 5
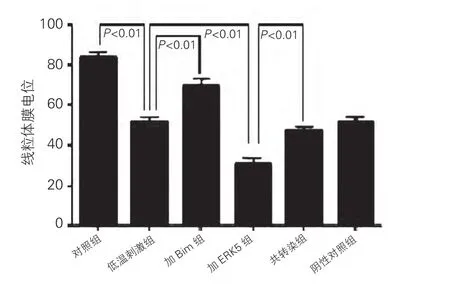
图5 ERK5 siRNA以及Bim siRNA对低温刺激下心肌细胞内线粒体膜电位的影响。余注见图1
3 讨论
低体温一般指身体核心温度低于35℃,是对人类机体存在潜在危害的病理状态[12]。 低温刺激对心脏的损害作用已被广泛报道,心肌细胞损伤及凋亡是重要环节。研究表明极短时间的低温预处理可缓解心肌缺血再灌注损伤,提高再灌注期间心脏泵功能,发挥抗心律失常作用[13],提示低温刺激并非诱导心肌细胞迅速坏死,而是缓慢的细胞凋亡。本研究证实了低温刺激下心肌细胞以凋亡为主,而非细胞完全死亡。
低温刺激在亚细胞水平产生多方面的病理变化。作为氧代谢水平极高的细胞种类,心肌细胞可产生一系列 ROS ,过高水平的ROS诱导细胞氧化应激,导致细胞损伤。有研究报道,低温刺激可使离体灌流心脏中的活性氧水平增高,并由此损害心肌细胞线粒体生物能[14]。此外,心肌细胞内钙超载可导致:线粒体氧化磷酸化障碍;线粒体膜电位下降;ATP代谢水平降低;细胞质磷脂酶和蛋白酶激活,这些均可导致不可逆转的细胞损害[15]。故此,ROS爆发,Ca2+超载和线粒体膜电位的破坏之间存在并发关系。本研究证实ROS爆发与细胞内钙超载均参与低温刺激诱导的心肌细胞损伤,同时证实了线粒体膜电位损坏,在低温刺激诱导心肌细胞损伤发挥重要作用,并与前述的低温诱导心肌细胞内钙离子超载趋势相吻合。
研究报道ERK与B细胞淋巴瘤/白血病-2基因(Bcl-2)家族通过线粒体途径密切参与细胞凋亡激活[16]。本研究在低温刺激下的心肌细胞中检测到明确的Bim蛋白高表达。通过RNA干扰技术我们下调Bim表达,获得细胞凋亡率降低、ROS水平减低、钙超载和线粒体膜电位破坏缓解等效应。结果高度提示Bim作为促凋亡蛋白在低温诱导的心肌细胞凋亡及损伤中发挥重要作用。我们同时发现低温刺激下的心肌细胞中,ERK5以及磷酸化的ERK5 存在高表达,下调Bim可抑制ERK5磷酸化并起保护性作用,缓解细胞凋亡、ROS爆发、细胞内钙超载以及线粒体膜电位障碍。下调ERK5则促进Bim蛋白表达,并加重上述低温诱导的一系列亚细胞水平损伤。结果充分体现了ERK5作为Bim上游抑制物的作用,以及ERK5 / Bim间存在负反馈关系。
综上所述,在低温刺激下的心肌细胞中,下调ERK5可释放对Bim的表达抑制,诱导更高的细胞凋亡率,以及更严重的细胞内钙离子超载、ROS活动、线粒体膜电位损伤。下调Bim则发挥反向的保护性作用。结果显示ERK5/ Bim途径在低温刺激诱导心肌细胞损伤中的明确调控作用。
[1]Israel A, Zavala LE, Cierco M, et al. Effect of AT(1) angiotensin II receptor antagonists on the sympathetic response to a cold pressor test in healthy volunteers. Am J Ther, 2007, 14: 183-188.
[2]Aronow WS, Ahn C. Elderly nursing home patients with congestive heart failure after myocardial infarction living in New York City have a higher prevalence of mortality in cold weather and warm weather months. J Gerontol A Biol Sci Med Sci, 2004, 59: 146-147.
[3]L'Ecuyer TJ, Aggarwal S, Zhang JP, et al. Effect of hypothermia on doxorubicin-induced cardiac myoblast signaling and cell death.Cardiovasc Pathol, 2012, 21: 96-104.
[4]王耀晟, 邹循锋, 鲍晓明, 等. 去铁敏在大鼠心肌细胞原代培养中的保护性应用 . 中国循环杂志 , 2009, 24: 387-390.
[5]Tsutsui H, Kinugawa S, Matsushima S. Mitochondrial oxidative stress and dysfunction in myocardial remodelling. Cardiovasc Res, 2009, 81: 449-456.
[6]Li XC, Wei L, Zhang GQ, et al. Ca2+cycling in heart cells from ground squirrels: adaptive strategies for intracellular Ca2+homeostasis. PLoS One, 2011, 6: e24787.
[7]罗富良, 孙嘉康, 唐跃, 等. 缺血后适应对大鼠移植心脏心肌细胞凋亡的影响 . 中国循环杂志 , 2012, 27: 470-472.
[8]Piñon JD, Labi V, Egle A, et al. Bim and Bmf in tissue homeostasis and malignant disease. Oncogene, 2008, 27( Suppl 1): S41-52.
[9]Takezawa K, Okamoto I, Nishio K, et al. Role of ERK-BIM and STAT3-survivin signaling pathways in ALK inhibitor-induced apoptosis in EML4-ALK-positive lung cancer. Clin Cancer Res, 2011, 17: 2140-2148.
[10]Kumar S, Kain V, Sitasawad SL. Cardiotoxicity of calmidazolium chloride is attributed to calcium aggravation, oxidative and nitrosative stress, and apoptosis. Free Radic Biol Med, 2009, 47: 699-709.
[11]Shao ZH, Sharp WW, Wojcik KR, et al. Therapeutic hypothermia cardioprotection via Akt- and nitric oxide-mediated attenuation of mitochondrial oxidants. Am J Physiol Heart Circ Physiol, 2010, 298:H2164-2173.
[12]Turk EE. Hypothermia. Forensic Sci Med Pathol, 2010, 6: 106-115.
[13]Khaliulin IG, Maslov LN, Podoksenov IuK, et al. Signalling mechanisms of cardioprotective effect of hypothermic preconditioning. Ross Fiziol Zh Im I M Sechenova, 2011, 97: 624-632.
[14]Camara AK, Riess ML, Kevin LG, et al. Hypothermia augments reactive oxygen species detected in the guinea pig isolated perfused heart. Am J Physiol Heart Circ Physiol, 2004, 286: H1289-299.
[15]Kumar S, Kain V, Sitasawad SL. High glucose-induced Ca2+overload and oxidative stress contribute to apoptosis of cardiac cells through mitochondrial dependent and independent pathways. Biochim Biophys Acta, 2012, 1820: 907-920.
[16]Zhang F, Kong DS, Zhang ZL, et al. Tetramethylpyrazine induces G0/G1 cell cycle arrest and stimulates mitochondrial-mediated and caspasedependent apoptosis through modulating ERK/p53 signaling in hepatic stellate cells in vitro. Apoptosis, 2013, 18: 135-149.
