输注人PBMC建立“人-鼠”异种移植物抗宿主病模型①
2014-07-30翁秀芳陆盛军吴雄文梁智辉
陈 俊 张 伟 翁秀芳 陆盛军 吴雄文 梁智辉
(华中科技大学同济医学院免疫学系,武汉 430030)
移植物抗宿主病是骨髓移植后出现的多系统损害的全身性疾病,是造成死亡的重要原因之一。临床表现较为复杂,皮肤损害最早出现的症状有红斑、丘疹、水疱,甚至皮肤剥脱,严重者皮损可在数天内扩展至全身。移植物抗宿主反应是一种特异的免疫现象,是由于移植物组织中的免疫活性细胞与免疫受抑制的、组织不相容性抗原受者的组织之间的反应。异种急性移植物抗宿主病模型是研究异种移植的有效途径,该模型可在受者体内观察供者免疫细胞对受者组织的攻击,进一步明确移植物抗宿主排斥反应情况;该模型还可用于体内药敏实验研究,预测指导临床治疗方案的选择和设计,以及探索放疗、内分泌治疗、免疫治疗、基因治疗及分子靶向治疗等新型治疗手段[1]。
目前对“人-鼠”模型的报道也较多,在选用动物的品系及种类等各方面都有不同的报道。本研究主要探讨选择合适小鼠品系,优化相关实验条件,建立稳定的“人-鼠”异种移植物抗宿主病(X-GVHD)模型,为异种移植提供可靠的实验模型。
1 材料与方法
1.1 材料
1.1.1 实验动物 裸鼠:购自武汉大学动物实验中心,BALB/c-nu,无菌级,雌性,4~5周龄,体重约12 g,质量合格证书编号00001655,饲养于华中科技大学同济医学院动物中心。
非肥胖糖尿病/重症联合免疫缺陷小鼠:购自北京华阜康生物科技股份有限公司,NOD/SCID,SPF级,雌性,5~6周龄,体重15 g,质量合格证书编号0180764,饲养于华中科技大学同济医学院动物中心。
1.1.2 试剂 RPMI1640细胞培养液为Gibco公司产品;胎牛血清为杭州四季青公司产品;人CD3、CD4、CD8等抗体购自Biolegend公司。
1.2 方法
1.2.1 X-GVHD模型小鼠的品系选择 参照相关文献,结合动物的易获得性及饲养条件,本实验选取裸鼠和NOD/SCID鼠建立“人-鼠”X-GVHD模型。两种小鼠均接受全身γ射线照射(300 cGy),之后随机分组如表 1,参考相关文献,选择7×107~8×107细胞,以腹腔输注途径输注人PBMC[2-7]。输注后第10天,采用流式细胞术及免疫组化检测各组小鼠体内各脏器中人淋巴细胞的浸润情况。
1.2.2 人PBMC输注途径的选择 常用的输注途径为腹腔和尾静脉[5,8],现设置实验探讨两种输注途径对建立模型是否有影响。由1.2.1的结果可知,NOD/SCID小鼠较裸小鼠更易建立“人-鼠”X-GVHD模型,故选用NOD/SCID小鼠,按照前期处理方案处理之后,随机分为对照组、腹腔输注组、尾静脉输注组,腹腔输注组通过腹腔输注途径输注7×107~8×107人PBMC,尾静脉输注组通过尾静脉途径输注7×107~8×107人 PBMC,对照组腹腔输注等体积的PBS。
1.2.3 建立X-GVHD模型最适细胞量的确定 由
1.2.1 、1.2.2 可知,NOD/SCID 小鼠采用腹腔输注途径,可较好的建立“人-鼠”X-GVHD模型。现设置实验,探索建立模型的最适细胞量。选取NOD/SCID小鼠,按照前期处理方案处理之后,随机分为对照组、实验组 1(2×107~3×107)、实验组 2(4×107~5×107)、实验组3(5×107~6×107)、实验组4(7×107~8×107)。
1.2.4 观察人T细胞表型动态变化与功能的最佳时间 第5天开始,模型鼠尾静脉采血。加入推荐量的人CD3抗体后,于4℃避光孵育45 min,用红细胞裂解液裂解红细胞,PBS洗涤后上机检测。
2 结果
2.1 NOD/SCID 鼠适合建立“人-鼠”X-GVHD 模型
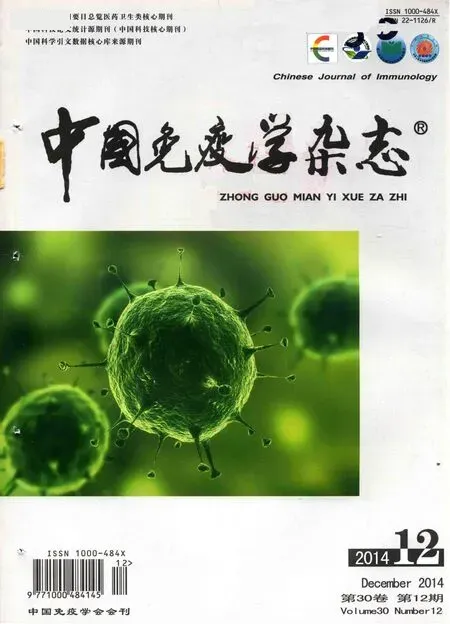
第10天眼球取血处死小鼠,检测模型鼠静脉血及各脏器中人T细胞浸润情况。NOD/SCID模型鼠外周血中人T细胞浸润比例高达(69.53±8.49)%,而裸鼠实验组仅为(5.6±1.81)%(图 1)。H&E 染色结果显示,NOD/SCID实验组较裸鼠实验组浸润情况严重。肺脏血管周围聚集大量人的相关免疫细胞(图2),与流式结果吻合。其他脏器的情况与肺脏趋势一样,NOD/SCID实验组较裸鼠实验组浸润情况严重。
2.2 腹腔输注途径与尾静脉输注途径无明显差异
第10天时眼球取血检测外周血中人T细胞所占比例,其中,腹腔输注组人 T细胞所占比例为(69.53±8.49)%,尾静脉输注组人T细胞所占比例为(71.20±5.78)%,腹腔输注途径与尾静脉输注途径无统计学差异(图3)。由于腹腔输注途径较尾静脉输注途径方便,故采用腹腔输注途径。
2.3 每只输注5×107以上的人PBMC能够建立“人-鼠”X-GVHD模型 100%死亡率代表100%XGVHD模型成功率。如图4所示,输注2×107~3×107人PBMC,有50%无法完全构建成功;输注4×107~5×107人PBMC,有25%无法完全构建成功;输注5×107~6×107人PBMC,可以全部构建成功,平均生存时间为(14.5±2.2)d;输注 7×107~8×107人PBMC,也可以全部构建成功,平均生存时间为(12±1.4)d。因此,可以得出结论:腹腔输注 5×10以上的人PBMC可以稳定建立X-GVHD模型。

表1 实验小鼠分组Tab.1 Groups of mice
2.4 观察人T细胞表型动态变化与功能的最佳时间为7~11 d 由图5可知,第5天时人T细胞在小鼠外周血中浸润比例较低,第11天时浸润达到最高,之后进入平台期。因此,我们认为7~11 d为观察人T细胞表型动态变化与功能的最佳时间。

图1 NOD/SCID鼠适合建立“人-鼠”X-GVHD模型Fig.1 NOD/SCID mice suitable for establishment of"human-mouse" X-GVHD model
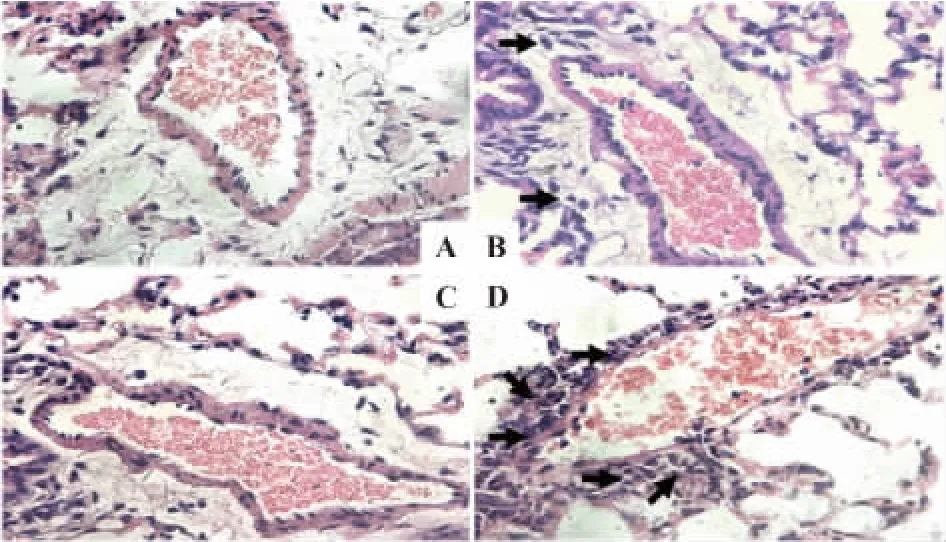
图2 NOD/SCID实验组模型小鼠肺脏组织血管周围有较多的人淋巴细胞浸润(H&E,×400)Fig.2 More human lymphocyte infiltration lung tissue in NOD/SCID experimental group(H&E,×400)
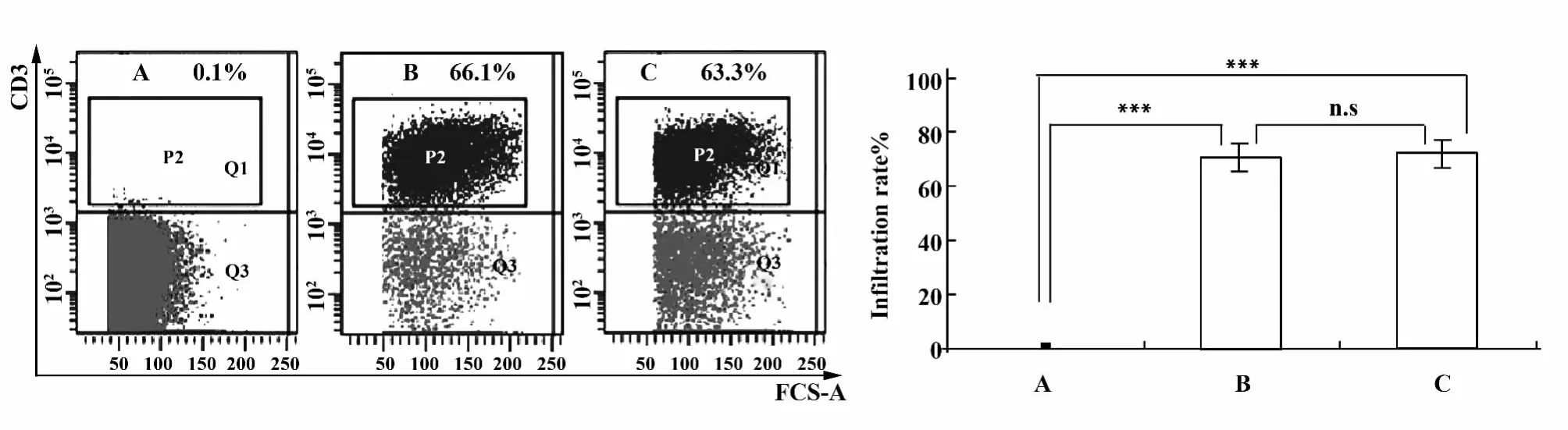
图3 腹腔输注途径与尾静脉输注途径无明显差异Fig.3 No significant difference between intraperitoneal infusion and intravenous infusion
图4 每只输注5×107以上的人PBMC能够建立“人-鼠”X-GVHD模型Fig.4 Each mice infusion of more than 5×107 human PBMC can establish "human-mouse" X-GVHD model
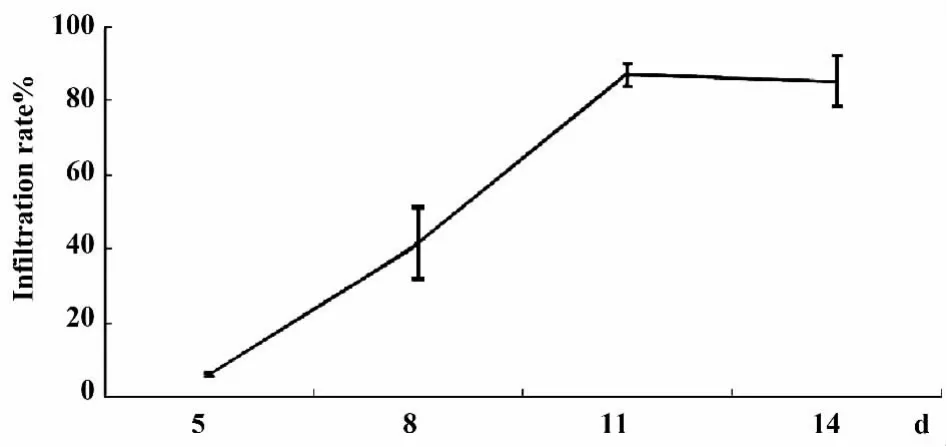
图5 观察人T细胞表型动态变化与功能的最佳时间为7~11 dFig.5 Best time to observe human T cell phenotype dynamics and function is 7 to 11 days
3 讨论
GVHD发生需要的一些特定条件[9-12]:①宿主与移植物之间的组织相容性不合;②移植物中必需含有足够数量的免疫细胞;③宿主处于免疫无能或免疫功能严重缺损状态。
裸小鼠是由于染色体上等位基因(第11对染色体上)突变引起的,已经没有正常的胸腺,原胸腺残留结构部分上皮样细胞呈巢状排列而部分呈外分泌腺结构。由于无胸腺,仅有胸腺残迹或异常上皮,而这种上皮不能使T细胞正常分化,从而缺乏成熟T细胞的辅助、抑制及杀伤功能,因而细胞免疫力低下。裸小鼠B淋巴细胞正常,但功能不全,免疫球蛋白主要是IgM,只含少量IgG。
NOD/SCID正式名称为 NOD.CB17-Prkdcscid/NcrCrl,为SCID突变(Prkdcscid)基因被转至 nonobese diabetic(NOD)的小鼠,Prkdcscid基因位于第十六对染色体上,转译为DNA-activated protein kinase(DNA-APK)催化的次单位,由于DNA-APK缺陷而影响淋巴干细胞分化为成熟的免疫细胞。NOD/SCID为近亲品系,是非肥胖糖尿病小鼠NOD/Lt与SCID小鼠杂交的[13],而SCID的特征为丧失B与T淋巴细胞的功能[14],NOD/Lt与SCID小鼠杂交得到NOD/SCID小鼠,除了丧失B与T淋巴细胞的功能特性外,还降低了 NK 细胞活性[15],即 T、B、NK 三缺陷[16]。
由于裸鼠仅仅是T细胞缺陷,而B细胞、NK细胞以及其自身免疫相对较强,300 cGy的γ射线照射也不能使其长时间处在免疫无能或免疫功能严重缺损状态,输注的PBMC未能引发GVHD的发生也就不奇怪了。而NOD/SCID小鼠,由于T、B、NK三缺陷,再加上300 cGy的γ射线照射,免疫无能或免疫功能严重缺损状态是完全可以达到的,只要输注足够数量的PBMC[2-7],必定可以导致GVHD的发生。
文献报道选择裸鼠具有以下优势:①国内有相关文献报道裸鼠可以建立“人-鼠”X-GVHD模型;②裸鼠较其他免疫缺陷鼠有价格优势,且易于购买;③饲养成本较低廉。但我们的实验结果显示,每只腹腔输注8×10 以上的人PBMC,使用裸鼠建立“人-鼠”X-GVHD模型成功率较低,只有 23.5%,而NOD/SCID小鼠成功建立“人-鼠”X-GVHD模型。经相关优化手段优化后,通过腹腔输注5×107人PBMC,可以稳定的建立“人-鼠”X-GVHD模型。结果还提示,输注后第7~11天是尾静脉动态观察过继的免疫细胞表型与功能的最佳时间窗口。
[1] Hiramatsu H,Nishikomori R, Heike T, et al. Complete reconstitution of human lymphocytes from cord blood CD34+cells using the NOD/SCID/gammacnull mice model[J].Blood,2003,102(3):873-880.
[2] Jeon MS1,Lim HJ,Yi TG,et al.Xenoreactivity of human clonal mesenchymal stem cells in a major histocompatibility complexmatched allogeneic graft-versus-host disease mouse model[J].Cell Immunol,2010,261(1):57-63.
[3] Tary-Lehmann MA,Saxon.Human mature T cells that are anergic in vivo prevail in SCID mice reconstituted with human peripheral blood[J].J Exp Med,1992,175(2):503-516.
[4] Hogan CJ,Shpall EJ,McNulty O,et al.Engraftment and development of human CD34(+)-enriched cells from umbilical cord blood in NOD/LtSz-scid/scid mice[J].Blood,1997,90(1):85-96.
[5] Pino S,Brehm MA,Covassin-Barberis L et al.Development of novel major histocompatibility complex class Iand class II-deficient NOD-SCID IL2R gamma chain knockout mice for modeling human xenogeneic graft-versus-host disease[J].Methods Mol Biol,2010,602:105-117.
[6] van Rijn RS,Simonetti ER,Hagenbeek A,et al.A new xenograft model for graft-versus-host disease by intravenous transfer of human peripheral blood mononuclear cells in RAG2-/-gammac-/-doublemutant mice[J].Blood,2003,102(7):2522-2531.
[7] Haraldsson A,Weemaes CM,De Boer AW,et al.Immunological studies in the hyper-immunoglobulin D syndrom[J].JClin Immunol,1992,12(6):424-428.
[8] Sandhu JS,Gorczynski R,Shpitz B,et al.A human model of xenogeneic graft-versus-host disease in SCID mice engrafted with human peripheral blood lymphocytes[J].Transplantation,1995,60(2):179-184.
[9] Oettinger MA,Schatz DG,Gorka C,et al.RAG-1 and RAG-2,adjacent genes that synergistically activate V(D)J recombination[J].Science,1990,248(4962):1517-1523.
[10] Mombaerts P,Iacomini J,Johnson RS,et al.RAG-1-deficient mice have no mature B and T lymphocytes[J].Cell,1992,68(5):869-877.
[11] Shinkai Y,Rathbun G,Lam KP,et al.RAG-2-deficient mice lack mature lymphocytes owing to inability to initiate V(D)J rearrangement[J].Cell,1992,68(5):855-867.
[12] Parkman,R.Graft-versus-host disease:an alternative hypothesis[J].Immunol Today,1989,10(11):362-364.
[13] Prochazka M,Gaskins HR,Shultz LD,et al.The nonobese diabetic scid mouse:model for spontaneous thymomagenesis associated with immunodeficiency[J].Proc Natl Acad Sci USA,1992,89(8):3290-3294.
[14] Bosma GC,Custer RP,Bosma MJ.A severe combined immunodeficiency mutation in the mouse[J].Nature,1983,301(5900):527-530.
[15] Roder J,Duwe A.The beige mutation in the mouse selectively impairs natural killer cell function[J].Nature,1979,278(5703):451-453.
[16] Shultz LD,Ishikawa F,Greiner DL.Humanized mice in translational biomedical research[J].Nat Rev Immunol,2007,7(2):118-130.