高同型半胱氨酸血症对实验性变态反应性脑脊髓炎小鼠的影响
2014-03-18复旦大学神经病学研究所上海200040
张 祥 乔 健 (复旦大学神经病学研究所,上海 200040)
同型半胱氨酸(Homocysteine,Hcy)是一种含硫的非必需氨基酸,是蛋氨酸代谢的中间产物,它在体内的蓄积,可造成高同型半胱氨酸血症(Hyper-homocysteinemia,HHcy)。HHcy 是心脑血管疾病重要的危险因素。然而,在多发性硬化(Mutiple Sclerosis,MS)等神经变性疾病中也发现存在HHcy[1-3],其病理机制和意义目前还不清楚。实验性变态反应性脑脊髓炎(Experiment autoimmune encephalomyelitis,EAE)是MS 较为理想的动物模型[4]。本研究旨在通过对伴或不伴HHcy 的EAE 小鼠的观察,探讨HHcy 在MS 中出现的原因及可能的病理意义。
1 材料与方法
1.1 主要试剂 普通育成料M02(上海斯莱克实验动物有限公司),MOG35-55 肽段(北京联科生物公司),结核菌素(Mycobacterium Tuberculosis H37Ra,TB,DIFCO Laboratory),百日咳毒素(Pertussis Toxin,PTX,List Biology Laboratory),SBDF(同仁化学研究所),蛋氨酸(Sigma-Aldreich 公司),磷酸二氢钾、甲醇、苏木精-伊红(HE)(国药集团),不完全弗氏佐剂(Sigma 公司),IL-17、IFN-γ 和TNF-α 细胞因子ELISA 检测试剂盒(eBioscience Company)。
1.2 实验小鼠和饮食 健康雌性8 周龄C57BL/6小鼠20 只,购自上海斯莱克实验动物有限公司,清洁级饲养,自由饮食,自然作息。以普通育成料M02喂养,其中10 只在制模前48 小时开始予饮水中添加4%蛋氨酸。
1.3 EAE 小鼠模型的建立及症状评估 称取MOG35-55 肽段粉剂3 mg,溶于1 ml PBS 中;取5 mg TB,溶于1 ml 不完全弗氏佐剂;上述所制备的两种液体以1 ∶1比例,采用针管混合器充分混合,制备成油包水样乳白色混悬液。
分别取5 只有和没有4% 蛋氨酸喂养的C57BL/6 小鼠,于背部脊髓二侧四点皮下注射含MOG35-55 混悬液各50 μl,同时尾静脉注射PTX 200 ng,48 h 后再次尾静脉注射PTX 200 ng 加强免疫。每2 d 记录小鼠体重,评估症状[0 分,无症状;1 分,垂尾;2 分,行路不稳/后肢力弱/翻正反射迟钝;3 分,后肢麻痹和(或)前肢力弱;4 分,前肢麻痹;5 分,死亡]。
1.4 小鼠血浆Hcy 的测定 Hcy 采用高效液相色谱-荧光法检测[1]。应用Waters 2690-2475 系统,衍生试剂为SBD-F,流动相为磷酸二氢钾-甲醇,流速1 ml/min;色谱柱为ODS Hypersil 柱(250×4 mm,5 mm),检测器为荧光检测器,激发波长385 nm,发射波长515 nm。
1.5 EAE 小鼠脾脏单个核细胞提取 EAE 小鼠颈椎脱臼处死,于无菌条件下取脾脏,并剪碎、研磨,100 目滤网过滤后,4℃,2 000 r/min 离心10 min,取沉淀,加入无菌水2 ml,涡旋振荡40 s 破除红细胞,加入无菌2.7% NaCl 溶液1 ml,迅速振荡混匀静止,待自然沉淀后取细胞悬液,4℃,2 000 r/min 离心5 min,弃去上清,用4℃无菌1×PBS 溶液洗涤2次,再次离心,细胞重悬于DMEM 中备用。
1.6 EAE 单个核细胞特异性免疫应答观察 将细胞以1×106ml 接种于24 孔培养板中,培养液中加入MOG35-55(10 μg/ml),培养48 h,留取上清,按照ELISA 试剂盒产品说明书对培养上清液中IL-17、IFN-γ、TNF-α 的含量进行测定。
1.7 统计学方法 采用SPSS11.5 统计学软件对数据进行统计处理。各组数据用±s 表示。各组小鼠不同时间Hcy 平均浓度和体重变化的比较使用重复测量设计多因素方差分析进行统计,症状评分的比较采用非参数分析Mann-Whitney U 进行统计;各组小鼠细胞因子浓度比较使用t 检验进行统计。P<0.05 为数据差异有统计学意义。
2 结果
本研究将实验小鼠分为4 组,每组5 只:以普通育成料喂养的健康小鼠和EAE 小鼠(HC 组和EAE组),添加蛋氨酸辅食的小鼠和EAE 小鼠(HC+Hcy组和EAE+Hcy 组)。
2.1 各组小鼠不同时间点Hcy 平均浓度的比较 如表1 所示,以普通育成料喂养的HC 和EAE 组小鼠的Hcy 平均浓度均分别显著低于添加蛋氨酸辅食的HC+Hcy 和EAE+Hcy 组小鼠(P<0.01),提示添加蛋氨酸辅食可使C57BL/6 小鼠具有HHcy。EAE 制模被动免疫后的1~3 周,EAE 成模组(EAE和EAE+Hcy 组)小鼠血清中Hcy 浓度,分别与同喂养模式下的对照小鼠(HC 和HC+Hcy 组)相比,均无显著统计学差异(P>0.05)(表1,图1)。提示小鼠在EAE 病理状态下,并不会使体内Hcy 水平有明显增加。
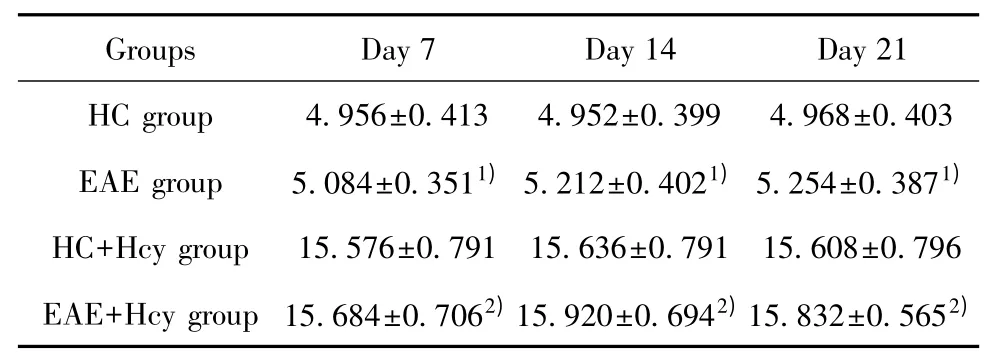
表1 各组小鼠不同时间点Hcy 平均浓度的比较(μmol/L)Tab.1 Mean levels of Hcy in mice from various groups at different time points (μmol/L)

图1 各组小鼠不同时间点Hcy 平均浓度的比较Fig.1 Mean levels of Hcy in mice from various groups at different time points

表2 各EAE 成模小鼠不同时间点症状评分的比较Tab.2 Mean clinical scores of EAE mice from various groups at different time points

表3 各EAE 成模小鼠不同时间点体重(g)的比较Tab.3 Comparison of change of weight (g)of EAE mice from various groups at different time points

图2 各EAE 成模小鼠不同时间点症状评分的比较Fig.2 Mean clinical scores of EAE mice from various groups at different time points
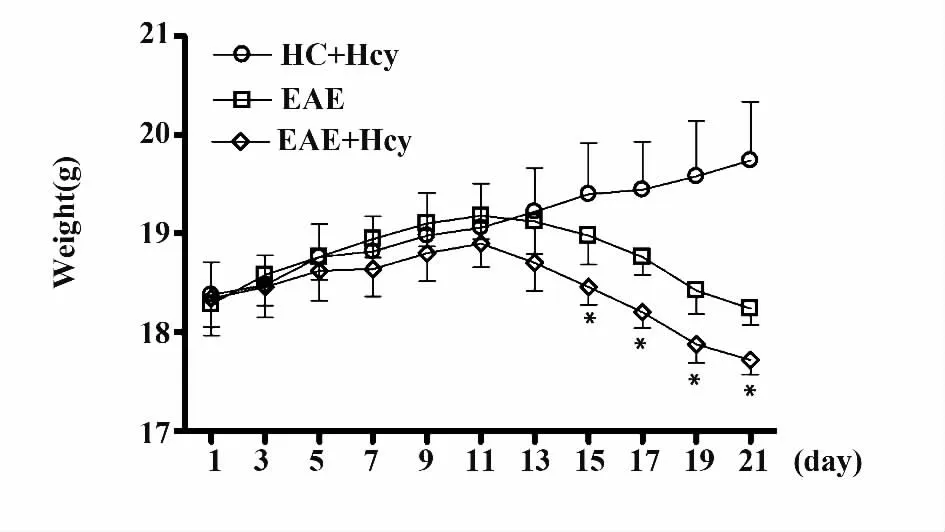
图3 各EAE 成模小鼠不同时间点体重的比较Fig.3 Comparison of change of weights of EAE mice from various groups at different time points
2.2 各EAE 成模小鼠不同时间点症状评分和体重的比较 HC+Hcy 组小鼠在观察期内并未出现明显的运动障碍及体重减轻,说明单纯添加蛋氨酸辅食并不会显著干扰对小鼠症状的评估。各EAE 组小鼠于免疫后第9 天开始出现症状,并在3 周内症状逐渐加重。在免疫制模21 d,EAE+Hcy 组有1 只小鼠症状加重,发生死亡。自免疫制模后第15 天起始,各相应时间点EAE+Hcy 组小鼠症状评分及体重的下降均显著高于EAE 组对照小鼠(P <0.05)(表2 和3,图2 和3)。
小鼠运动障碍等症状评分及体重的变化,是评估EAE 严重程度重要指标。本实验显示EAE+Hcy组小鼠症状显著重于EAE 组,提示HHcy 可显著加重EAE 临床症状表现。
2.3 各EAE 成模小鼠致炎因子水平的比较 于免疫后21 天,取各组EAE 小鼠脾脏单个核细胞,以MOG35-55 肽段刺激诱发特异性免疫反应,所测细胞因子水平显示,EAE+Hcy 组小鼠TNF-α和IFN-γ 水平显著高于EAE 组(P<0.05),而IL-17 水平在两组中无显著统计学差异(P>0.05,图4)。
3 讨论
MS 是反复发作的,以脑、脊髓及视神经等多处受累为主的中枢神经系统脱髓鞘性疾病。尽管MS被认为是免疫相关性疾病,但有部分患者却存在一些生化指标的异常波动,如尿酸、Hcy 等[1-3],而这些指标的异常是否由MS 病理过程所致,是否会影响疾病的发展等,还缺少相关的研究。
本实验结果显示,EAE 组小鼠血浆中Hcy 水平并未显著高于健康对照小鼠。有文献报道,MS 的发病可能与某些病原体感染有关,如肝炎病毒、EB病毒等[5]。病原体感染激发机体免疫防御机制,由于病毒等病原体和中枢组织发生交叉免疫反应,从而使得机体产生相应抗体,造成MS 相关性的中枢织损伤[6]。由于EAE 模型由MOG35-55 肽段直接诱导产生细胞免疫所成,提示EAE 自身病理过程可能并不是产生HHcy 的原因。由此是否可推断MS患者伴有HHcy 可能源于病原体对疾病的诱导阶段,而不是产生于MS 患者体内免疫应答启动后的阶段。这一假设有待于进一步的研究证明。
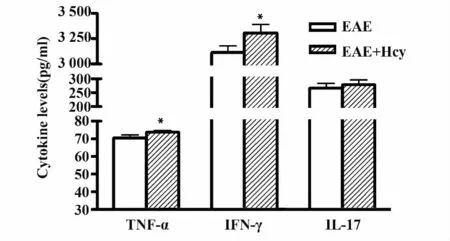
图4 不同EAE 组小鼠TNF-α、IFN-γ、IL-17 因子水平的比较Fig.4 Comparison of levels of TNF-α,IFN-γ,IL-17 of EAE mice from various groups
EAE 具有类似MS 的临床和病理表现,是被广泛用于研究MS 的动物模型。可用以制作EAE 模型的动物有数种,包括C57BL/6 小鼠,而这种小鼠同时也可被用以制作HHcy。我们未查阅到以HHcy小鼠制作EAE 动物模型的报道。通过在饮水中添加4%蛋氨酸,C57BL/6 小鼠体内Hcy 水平在一周左右上升至同龄鼠的2~3 倍。以MOG35-55 肽段主动免疫,小鼠于免疫后9 d 左右出现垂尾、行路不稳等EAE 成模症状,表明采用以MOG35-55 肽段主动免疫和饮水中添加4%蛋氨酸的方式,可以制作具有HHcy 的EAE 小鼠模型。
同国外报道相一致[7,8],我们预实验中发现C57BL/6 小鼠在开始给予蛋氨酸辅食的10 天左右的时间内,其体重增长幅度较正常小鼠慢,但小鼠的日常活动未出现变化,而一般在2 周左右的时间,小鼠体重开始较稳定的增长(数据未列于本文)。本实验显示,HC+Hcy 组、EAE 组和EAE+Hcy 组小鼠在2 周内体重增长幅度未有显著差异,而在免疫15 d 后,HC+Hcy 组小鼠体重继续保持增长,EAE 组和EAE+Hcy 组小鼠体重则出现明显下降,而后者下降的幅度更为显著。结合EAE+Hcy 组小鼠症状评分更重于EAE 组这一结果,说明HHcy 可促进EAE 的发展。以往较多研究表明,Hcy 可损伤血脑屏障中的血管内皮细胞,同时还可以通过对内皮细胞功能影响,使其释放因子,激活或是募集炎性细胞到达局部,进一步加强对血脑屏障的损伤,从而使更多致炎细胞进入中枢[9,10]。因此,HHcy 促进EAE 的发展可能同其对血脑屏障破坏有关,然而,Hcy 是否可直接影响免疫细胞的功能呢?
目前认为MS/EAE 是主要有T 细胞介导的免疫相关性疾病,辅助性T 细胞中的TH1 和TH17 是主要的致病细胞,前者主要分泌IFN-γ、TNF-α 等,后者则主要分泌IL-17 等[11]。通过对EAE 组和EAE+Hcy 组小鼠脾脏单个核细胞细胞因子水平的比较,我们发现Hcy 可以促进EAE 小鼠TNF-α 和IFN-γ 的产生,而对IL-17 无显著影响。因此,Hcy可能主要通过促进TH1 细胞相关致炎因子,而不是TH17 细胞相关致炎因子,而增强T 细胞的致病作用,使MS/EAE 的临床症状加重。此结果也佐证了近年来有关Hcy 可影响机体免疫的报道。有研究表明,Hcy 除可以促进T 细胞的增殖[12],还可通过T淋巴细胞等表面的NMDA 受体,使钙离子流入细胞增多,促进胞内ROS 聚集,激活蛋白C、一氧化氮合成酶以及NADPH 氧化酶等,使IFN-γ 等炎性因子产生增多等[13-15]。
总之,通过对伴或不伴有HHcy 的EAE 小鼠模型的观察,我们没有发现EAE 疾病过程中Hcy 水平的明显升高,但HHcy 可以加重EAE 的临床症状,其机理可能同Hcy 破坏血脑屏障,促进TH1 细胞分泌TNF-α、IFN-γ 等致炎因子有关。目前,Hcy 对机体免疫影响的研究还较为局限,随着对此问题的深入研究,将有助于进一步阐明MS 患者中存在HHcy的原因及其意义。
[1]张 祥,吕传真,乔 健,等.高同型半胱氨酸血症与多发性硬化的关系初探[J].中国临床神经科学,2007,15(5):486-489.
[2]刘 敏,彭 海.高同型半胱氨酸与神经变性性疾病[J].国外医学(卫生学分册),2005,32(5):274-277.
[3]Zoccolella S,Tortorella C,Iaffaldano P,et al.Elevated plasma homocysteine levels in patients with multiple sclerosis are associated with male gender[J].J Neurol,2012,259(10):2105-2110.
[4]Robinson AP,Harp CT,Noronha A,et al.The experimental autoimmune encephalomyelitis (EAE)model of MS:utility for understanding disease pathophysiology and treatment[J].Handb Clin Neurol,2014,122:173-189.
[5]Cusick MF,Libbey JE,Fujinami RS.Multiple sclerosis:autoimmunity and viruses[J].Curr Opin Rheumatol,2013,25 (4):496-501.
[6]Chastain EM,Miller SD.Molecular mimicry as an inducing trigger for CNS autoimmune demyelinating disease[J].Immunol Rev,2012,245(1):227-238.
[7]Velez-Carrasco W,Merkel M,Twiss CO,et al.Dietary methionine effects on plasma homocysteine and HDL metabolism in mice[J].J Nutr Biochem,2008,19(6):362-370.
[8]Zhou J,Werstuck GH,Lhotak S,et al.Hyperhomocysteinemia induced by methionine supplementation does not independently cause atherosclerosis in C57BL/6J mice[J].FASEB J,2008,22(7):2569-2578.
[9]Alkhoury K,Parkin SM,Homer-Vanniasinkam S,et al.Chronic homocysteine exposure upregulates endothelial adhesion molecules and mediates leukocyte:endothelial cell interactions under flow conditions[J].Eur J Vasc Endovasc Surg,2011,41 (3):429-435.
[10]Kamath AF,Chauhan AK,Kisucka J,et al.Elevated levels of homocysteine compromise blood-brain barrier integrity in mice[J].Blood,2006,107(2):591-593.
[11]El-Behi M,Rostami A,Ciric B.Current views on the roles of Th1 and Th17 cells in experimental autoimmune encephalomyelitis[J].J Neuroimmune Pharmacol,2010,5(2):189-197.
[12]Dai J,Wang X.Immunoregulatory effects of homocysteine on cardiovascular diseases[J].Sheng Li Xue Bao,2007,59 (5):585-592.
[13]Boldyrev AA,Bryushkova EA,Vladychenskaya EA.NMDA receptors in immune competent cells[J].Biochemistry (Mosc),2012,77(2):128-134.
[14]Dawson H,Collins G,Pyle R,et al.The immunoregulatory effects of homocysteine and its intermediates on T-lymphocyte function[J].Mech Ageing Dev,2004,125(2):107-110.
[15]Schroecksnadel K,Frick B,Wirleitner B,et al.Moderate hyperhomocysteinemia and immune activation [J].Curr Pharm Biotechnol,2004,5(1):107-118.