基于AFLP分子标记探讨福建近海竹荚鱼群体遗传多样性
2014-07-26张丽艳牛素芳
张丽艳,牛素芳,张 曼,王 军*
(1.厦门大学海洋与地球学院 福建 厦门361102;2.福建海洋研究所 福建 厦门361012)
竹荚鱼(TrachurusjaponicusTemminck et Schlegel)隶属于鲈形目(Perciformes),鲹科(Carangidae),竹荚鱼属(Trachurus),为暖温性中上层洄游性鱼类,主要分布于西北太平洋的中国、日本和朝鲜半岛沿海,是福建沿海的常见经济鱼类[1].
福建沿海竹荚鱼的主要作业渔场为闽中—闽东渔场和闽南—台湾浅滩渔场.卢振彬等[2-3]通过对这两个渔场不同生态类群渔业资源生产量的研究发现,两渔场主要经济底层和近底层鱼类实际年渔获量均连续数年超过其最大可持续开发量,呈过度捕捞状态,资源严重衰退,而中上层鱼类资源已日渐取代底层和近底层鱼类,成为两渔场的重要开发对象.20世纪末,竹荚鱼资源在闽南—台湾浅滩渔场较为稳定,但在闽东渔场已出现衰退现象[4].21世纪初,宋普庆等[5]在对台湾海峡游泳动物调查时,发现该海域游泳动物资源衰退明显,其中就包括竹荚鱼.在这种情况下,急需开展竹荚鱼野生资源现状评估及群体遗传特性研究,以便为科学合理的管理和利用竹荚鱼野生资源提供依据.目前,有学者依据竹荚鱼的形态特征、性成熟和洄游分布状况将东海竹荚鱼划分为不同的群体[6-9],而台湾海峡不同渔场之间的水文特征不同,可能导致竹荚鱼群体在遗传学上产生分化,本研究将从遗传学的角度对其进行判断.
扩增片断长度多态性(AFLP)技术是中性选择的DNA分子遗传标记技术,具有用量少、检测遗传变异灵敏、扩增效率高、多态性强等优点.近年以来该技术已经被广泛应用于海洋鱼类的群体遗传多样性研究[10-13]、仔稚鱼鉴定[14]、对野生和养殖群体的种质资源评估[15]、系统发育关系研究[16]等诸多领域.本研究运用AFLP技术对闽东渔场和闽南渔场的2个竹荚鱼群体进行遗传多样性分析,研究结果将从遗传学上揭示台湾海峡竹荚鱼的群体划分,同时也为台湾海峡竹荚鱼遗传资源现状的准确评价与合理开发利用提供理论指导和技术支持.
1 材料与方法
1.1 材 料
于2009年3—4月,采集福建省宁德霞浦近海和厦门近海2个竹荚鱼群体(闽东群体和闽南群体)样品,样品运回实验室进行形态学鉴定和测量,其中体长分别为168.6~246.3mm、178.2~251.0mm,叉长范围分别为176.4~220.8mm、196.1~246.4mm.闽东、闽南群体各随机挑选30尾,取背部肌肉保存于95%(体积分数)乙醇中.
1.2 基因组DNA提取和AFLP图谱构建
采用酚-三氯甲烷方法提取基因组DNA,将乙醇沉淀后的基因组DNA溶解于100μL蒸馏水中,4℃保存备用.参照Vos等[17]的方法构建AFLP图谱.利用内切酶EcoR I和MseI进行双酶切;然后与EcoR I接头和MseI接头进行接头;预扩增引物的3′末端加1个选择性碱基,其序列分别为EcoR I+A(5′-GACTGCGTACCAATTC+A 3′)和MseI+C (5′-GATGAGTCCTGAGTAA+C 3′);将预扩产物进行10倍稀释用于选择性扩增,选择性扩增引物的3′末端加3个选择性碱基(表1).将PCR扩增产物在6%(质量分数)的变性聚丙烯酰胺凝胶上进行60W恒功率高压电泳.电泳结束后,用10%(质量分数)乙酸固定、银染和显影.选取扩增条带清晰、多态性高的8对引物组合:E1/M5、E1/M1、E5/M3、E2/M2、E5/M5、E1/M2、E1/M4、E2/M3进行AFLP数据统计分析.
1.3 数据统计分析
AFLP为显性标记,对电泳图谱中同一位置上清晰的AFLP条带进行统计,有条带记为1,视为显性表型,无条带记为0,视为隐形表型,得出0和1原始数据矩阵.利用POPGENE 1.31软件统计位点总数、多态位点数和每个引物组合的多态位点比例,计算显性基因型频率、Shannon多样性指数、Nei遗传多样性指数、遗传分化系数(Gst)、遗传相似性指数和遗传距离;利用SPSS 13.0中的t检验对Nei遗传多样性指数和Shannon多样性指数进行差异显著性检验;利用Phyltools 1.32软件计算获得个体间遗传距离矩阵,利用软件MEGA 5.0构建基于个体间遗传距离的NJ聚类树;利用 Arlequin 3.1进行分子生物学方差分析(AMOVA)和位点差异数分析.遗传学参数计算主要参考文献[13].
2 结 果
利用8对选择性引物,在60尾竹荚鱼中共扩增出433条清晰的条带(100~1 000bp,不清晰的条带不纳入统计).其中,多态性条带为286条,多态位点比例为66.05%.每个引物组合产生的扩增条带数范围为40~69条,扩增出的多态性条带范围为24~54条,多态检出率范围为60.00%~78.26%(表2).

表1 选择性扩增引物Tab.1 Selective amplification primers and their sequences used in AFLP analysis
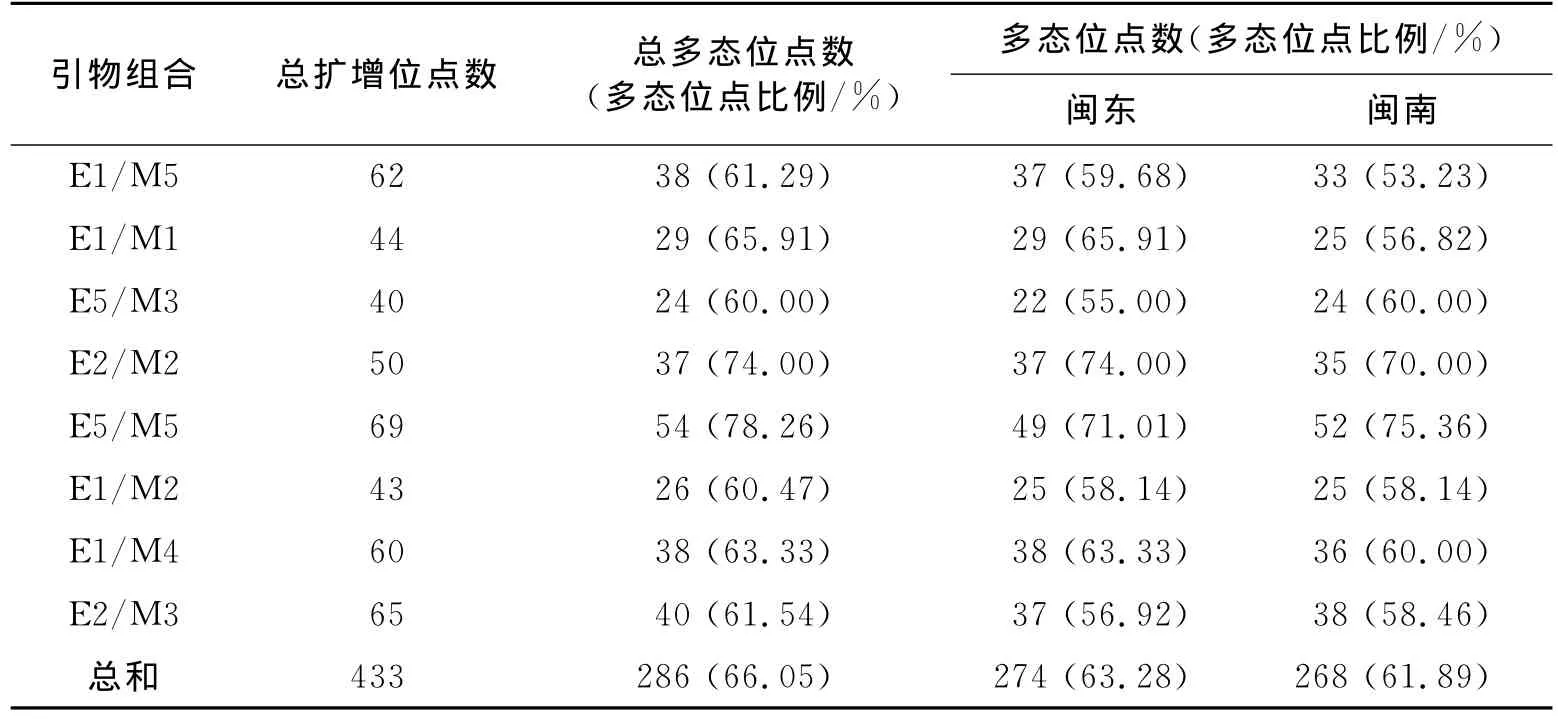
表2 各引物组合的扩增结果Tab.2 Number of bands generated by primer combinations
8对选择性引物在闽东和闽南2个群体的433条条带中,并未发现群体间的特异性条带.闽东和闽南群体平均多态位点比例分别为63.28%和61.89%,Nei遗传多样性指数分别为0.171 8和0.172 2,Shannon多样性指数分别为0.267 3和0.267 3(表2、表3).综合比较所有遗传多样性参数可以发现,闽东和闽南2个竹荚鱼群体的遗传多样性水平基本一致,两者之间的差异并不显著(Nei遗传多样性指数和Shannon多样性指数的p值分别为0.880和0.938).

表3 竹荚鱼2个群体的遗传学参数Tab.3 Parameters of genetic diversity for two populations of T.japonicus
2个群体间扩增位点遗传相似性指数和遗传距离分别为0.984 2和0.015 9;根据Gst、AMOVA 分析估算的竹荚鱼2个群体的遗传变异分别有95.57%、93.99%存在于群体内,4.43%、6.01%存在于群体间(表4);2个群体间Nm高达10.796 9(表3).分析表明,竹荚鱼2个群体间未发现显著的遗传结构,不存在明显遗传分化.
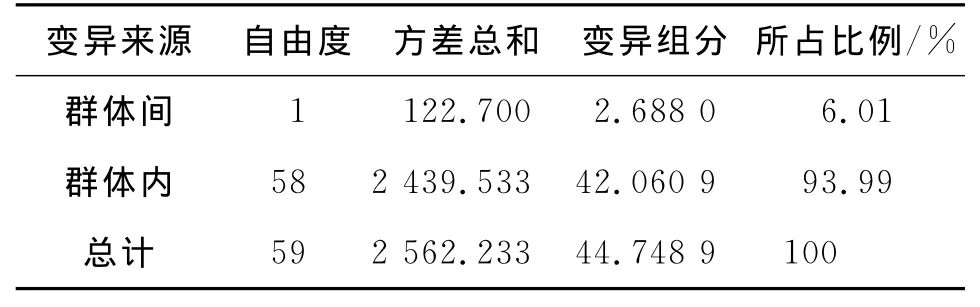
表4 竹荚鱼遗传结构的AMOVA分析Tab.4 Analysis of molecular variance(AMOVA)of genetic structure for T.japonicus
将433条扩增条带的显性基因型频率以10%为单位划分区间,0和1分别设为一个单独的区间,统计显性基因型频率位于各区间内的位点数(图1).结果显示,在1%~9%、80%~89%和关键点1的基因型频率呈现峰值,2个群体的显性基因型频率分布基本一致,说明2个群体的遗传结构相似.利用Arlequin软件统计个体间位点差异数频率分布(mismatch distribution),单个群体和所有个体位点差异数分布见图2.图中2个群体位点差异数分布图都呈单峰型,峰值差异位点数虽有所偏移但相差很小,说明个体间遗传距离频率分布基本相同,2个群体遗传结构非常相近.

图2 竹荚鱼AFLP数据观测位点差异数分布图Fig.2 The observed pairwise differences of the AFLP data of T.japonicas
为进一步分析2个竹荚鱼群体间遗传分化程度,利用MEGA 5.0软件对60尾竹荚鱼个体构建NJ系统树(图3).系统发育树的拓扑结构较简单,未检测到与采样地点相对应的分支,不存在明显的谱系结构,同样说明2个群体间的遗传分化不明显.

图1 扩增位点数在不同显性基因频率区间内的分布Fig.1 Distributions of amplified loci in different frequency intervals

图3 竹荚鱼60个个体的NJ聚类树Fig.3 NJ tree of 60individuals of T.japonicas
3 讨 论
3.1 群体遗传多样性水平
物种的遗传多样性是其进化潜能的保证,是生存、发展和进化的前提,同样也是形成生物多样性的基础.物种遗传多样性愈高,其适应周围环境的能力愈强;反之,则易受到环境变化的影响,尤其是过度捕捞等人为因素造成的物种遗传多样性的降低更应引起重视.本研究利用8对引物对福建沿海竹荚鱼资源的遗传多样性进行了AFLP分析,结果呈现出丰富的多态性和较高的灵敏度,表明AFLP技术适用于竹荚鱼的群体遗传学分析.
比较2个竹荚鱼群体的多态位点比例、Nei遗传多样性指数和Shannon多样性指数,闽东和闽南群体的遗传多样性水平基本一致,两者之间并无差异显著,都具有较高的遗传多样性.比较以往鱼类AFLP研究结果发现,福建近海竹荚鱼的多态位点比例(61.89%~63.28%)明显高于我国沿海多种经济鱼类(表5);与同海域的蓝圆鲹(Decapterusmaruadsi)(58.97%~62.70%)[13]相近.可见,福建近海竹荚鱼群体的多样性仍处于较高水平,具有较高的进化潜力.

表5 我国沿海经济鱼类AFLP多态位点比例比较Tab.5 Comparison of percentage of AFLP polymorphism of economic fishes in China′s coastal waters
福建近海竹荚鱼资源仍保持相当丰富的遗传变异水平的原因是:1)竹荚鱼生境范围较广,使其面临的自然选择压力相对较小,可以积累较多的遗传变异;2)Frankhan[23]认为动物遗传多样性与个体大小呈负相关,个体越小繁殖周期越短则遗传变异越大.竹荚鱼成鱼体长一般为200~250mm[1],性成熟年龄为Ⅰ龄,年龄结构为0~Ⅳ龄[7].具有生命周期短,生长速度快,性成熟早,生殖鱼群中补充群体数量大于剩余群体的特点[6],可影响其有效群体的数量,使遗传多样性偏高;3)第四纪以来的全球性温度大幅度升降导致了物种遗传多样性的丢失,处于物种分布区南北两边缘的群体遗传多样性损失最高[24].竹荚鱼的分布范围从中国南海跨度到日本海域,福建近海处于其分布海域的中部位置,这使得该海域竹荚鱼在冰期气候波动中受到的影响相对较小,保留了较高的遗传多样性.
3.2 群体遗传分化分析
AMOVA分析和NJ聚类树均未检测到相对应的地理分支或者地理群,且Gst值偏小.这些结果都表明福建近海的竹荚鱼群体间遗传分化较小,遗传变异主要存在于群体内,群体间无明显的遗传分化.位点差异数分布和显性基因频率分布图显示,2个群体遗传结构相似,没有形成各自独立的遗传结构.已有研究结果表明,许多海洋鱼类如日本鳀(Engraulisjaponicus)[25]、带鱼(Trichiurushaumela)[26]、银鲳[12]、蓝圆鲹[13]等在东海海域的连续分布区内都不存在显著遗传差异.在更新世冰期,作为西太平洋几个广阔的大陆架之一,东海陆架约有85万hm2的面积因为海平面的下降变为陆地[10].末次冰期后,伴随海平面上升,该海域 的 白 姑 鱼 (Nibeaalbiflora)[11]、梭 鱼 (Chelon haematocheilus)[27]等由其避难所发生重新殖化事件,之后又发生近期扩张重新进入东海大陆架.福建近海竹荚鱼栖息地扩张发生的时间比较晚,群体由于缺乏足够的时间在迁移和漂变之间取得平衡而造成这些物种群体间均无明显遗传分化.这也是福建近海竹荚鱼遗传同质性高的一个原因.Song等[9]利用线粒体控制区基因片段对中日沿海9个群体的竹荚鱼研究发现,竹荚鱼群体可能经历过近期群体扩张事件,群体间无明显遗传分化,与本研究结果相同.
环境动力和扩散特征也通常被认为是决定群体结构的重要因素之一.海洋大环境中不存在明显的有效地理隔离,且洋流对海洋生物卵、幼体和成鱼具有较强的输送作用,这些因素使得群体间分化程度很低,不存在显著的遗传结构[28].竹荚鱼产卵期为11月至翌年4月[6],属浮性卵,受精卵在水温20~22℃时,约50h孵出仔鱼[1].此外,竹荚鱼具有明显的季节洄游,其产卵场和越冬场在东海中南部,而索饵场在东海中北部和黄海部分海域[1].这些生活史特征表明竹荚鱼的卵、幼鱼和成鱼具有较强的扩散能力.而福建近海交汇的黑潮、台湾暖流和台湾海峡北上海流则有利于该海域生物卵和幼体的扩散.在夏季,有部分闽南—台湾浅滩渔场的竹荚鱼幼鱼阶段鱼群到达闽中、闽东沿海[6],成为闽东渔场竹荚鱼的补充群体,这可能就是借助台湾暖流和台湾海峡北上海流完成的.群体间Nm用来表示群体间的基因交流程度,当Nm>4,则表明群体间是一随机交配的群体[29].本研究的2个竹荚鱼群体间基因流明显大于4(10.796 9),表明闽东、闽南群体间基因交流频繁,不存在交配障碍.据此认为,竹荚鱼较强的扩散能力和福建近海的洋流也可能造成福建近海竹荚鱼缺乏系统地理结构.
在渔业管理应用中应持谨慎态度.虽然本研究结果从遗传学角度上表明竹荚鱼仍具有较高的遗传多样性,但过度捕捞可能会造成竹荚鱼的低龄化,在幼鱼被大量的捕捞的情况下,整个竹荚鱼的资源量长时间得不到持续有效的补充,最终可能会导致资源的进一步衰退.
[1]福建鱼类志编写组.福建鱼类志(下卷)[M].福州:福建科学技术出版社,1985.
[2]卢振彬.闽东渔场不同生态类群的鱼类资源生产量[J].中国水产科学,2005,12(6):731-738.
[3]卢振彬,戴泉水,肖方森,等.闽南—台湾浅滩渔场鱼类及其不同生态类群的资源生产量[J].水产学报,2006,30(3):359-366.
[4]卢振彬,戴泉水,朱进福,等.福建近海渔业资源结构及其主要种群生态的变化[J].福建水产,1999,3:1-7.
[5]宋普庆,张静,林龙山,等.台湾海峡游泳动物种类组成及其多样性[J].生物多样性,2012,20(1):32-40.
[6]汪伟洋,张壮丽,叶孙忠,等.闽南、台湾浅滩渔场中上层鱼类资源监测[J].海洋渔业,1997,19(3):113-116.
[7]洪明进.闽南—台湾浅滩渔场竹荚鱼的生殖特性[J].中国水产,1998,9:43.
[8]Xie S,Watanabe Y,Saruwatari T,et al.Growth and morphological development of sagittal otoliths of larval and early juvenileTrachurusjaponicus[J].Fish Biol,2005,66(6):1704-1719.
[9]Song N,Jia N,Yanagimoto T,et al.Genetic differentiation ofTrachurusjaponicusfrom the Northwestern Pacific based on the mitochondrial DNA control region[J].Mitochondrial DNA,2013,24(6):705-712.
[10]Liu J X,Gao T X,Wu S F,et al.Pleistocene isolation in the Northwestern Pacific marginal seas and limited dispersal in a marine fish,Chelonhaematocheilus(Temminck &Schlegel,1845)[J].Mol Ecol,2007,16:275-288.
[11]Han Z Q,Gao T X,Yanagimoto T.Genetic population structure ofNibeaalbiflorain Yellow Sea and East China Sea[J].Fish Sci,2008,74:544-552.
[12]孟彦羽,章龙珍,赵峰.银鲳4个地理种群遗传多样性的初步研究[J].海洋渔业,2009,31(1):48-52.
[13]张丽艳,苏永全,丁少雄,等.福建近海蓝圆鲹种群遗传多样性 的 AFLP 分 析 [J].水 产 学 报,2010,34(5):680-687.
[14]张俊彬,黄良民,陈真然.AFLP技术在笛鲷的仔鱼鉴定及其分类学上的研究[J].海洋学报,2005,27(2):165-171.
[15]王志勇,王艺磊,林利民,等.福建官井洋大黄鱼AFLP指纹多态性的研究[J].中国水产科学,2002,9(3):198-202.
[16]David L,Rajasekaran P,Fang J,et al.Polymorphism in or-namental and common carp strains(CyprinuscarpioL.)as revealed by AFLP analysis and a new set of microsatellite markers[J].Mol Genet Genomics,2001,266(3):353-362.
[17]Vos P,Hogers R,Bleeker M,et al.AFLP:a new technique for DNA fingerprinting [J].Nucleic Acids Res,1995,23(21):4407-4414.
[18]Chen S P,Hu X L,Liu T.AFLP analysis of seven geographical populations ofEpinephelusakaara[J].Acta Sci Natu Univ Suny,2009,48(1):56-61.
[19]韩志强,高天翔,王志勇.黄姑鱼群体遗传多样性的AFLP分析[J].水产学报,2006,30(5):640-646.
[20]马洪雨,陈松林,田永胜.我国引进条斑星鲽群体遗传多样性的 AFLP分析[J].水产学报,2008,32(3):321-326.
[21]韩志强,庄志猛,高天翔.半滑舌鳎DNA的群体遗传变异[J].中国水产科学,2007,14(2):192-200.
[22]张全启,徐晓斐,齐洁.牙鲆野生群体与养殖群体的遗传多样性分析[J].中国海洋大学学报,2004,34(5):816-820.
[23]Frankhan R.Relationship of genetic variation to population size in wildlife [J].Biol Conserv,1996,10(6):1500-1508.
[24]Hewitt G M.Some genetic consequences of ice ages,and their role in divergence and speciation [J].Biol J Linn Soc,1996,58:247-276.
[25]Yu Z N,Kong X Y,Guo T H,et al.Mitochondrial DNA sequence variation of Japanese anchovyEngraulisjaponicusfrom the Yellow Sea and East China Sea[J].Fish Sci,2005,71(2):299-307.
[26]杨天燕,高天翔.黄海和东海带鱼群体同工酶分析[J].海洋水产研究,2007,28(3):44-49.
[27]Palumbi S R.Population genetics,demographic connectivity,and the design of marine reserves[J].Ecol Appl,2003,13(1):S146-S158.
[28]Domingues V S,Faria C,Stefanni S,et al.Genetic divergence in the Atlantic-Mediterranean Montagu′s blenny,Coryphoblenniusgalerita(Linnaeus 1758)revealed by molecular and morphological characters[J].Mol Ecol,2007,16(17):3592-3605.
[29]Hartl D L,Clark A G.Principle of population genetics[M].2rd ed.Sunderland,England:Sinauer Press,1989.
