MdmX在Axin-p53信号通路中的调控机制
2014-07-26叶志云
贺 颖,叶志云
(厦门大学生命科学学院,福建 厦门361102)
鼠双微体基因X(MdmX,亦称 Mdm4)是1996年发现的一个新的p53结合蛋白[1],由于它与另一个p53结合蛋白鼠双微体基因2(Mdm2)在结构上高度相似,因而被命名为MdmX.它与Mdm2在结构上同源,分别由490和491个氨基酸组成[2].2个蛋白都具有相似的功能区:N端p53结合区,介导对p53的转录调控,该区结构在2种蛋白中严格保守[3];中央区锌指结构,由第301~329个氨基酸构成,其功能均未知[4];C端RING结构区,该区是这2个蛋白形成同源或异源二聚体的关键,也是Mdm2作为泛素连接酶的核心,但MdmX的RING结构域却不具备泛素连接酶功能[5].MdmX和Mdm2的蛋白结构主要差异部分在中央酸性区[4];另外,Mdm2具有核定位信号(NLS)及出核信号(NES),而MdmX则没有[2].在生物学功能上,MdmX和Mdm2均为p53信号通路中重要的调控因子,两者的功能各不相同,无法互相替代.敲除 Mdm2的小鼠胚胎因激活p53依赖的细胞凋亡通路而死亡,敲除MdmX的小鼠胚胎则因依赖p53的细胞增殖抑制而死亡,但若同时敲除p53基因,胚胎均能正常发育[6-9].Mdm2和 MdmX 在p53信号通路中的调控关系非常复杂,Mdm2可以介导自身及MdmX的泛素化降解[10],而MdmX与Mdm2的结合又可稳定Mdm2,抑制其降解[11].两者在p53通路中的调节与它们之间的表达水平密切相关,当MdmX与Mdm2在细胞内水平相当时,它们共同抑制p53的活性;而当MdmX表达量较高时,则可稳定p53的表达[12].
体轴发育抑制因子Axin是一个重要的架构蛋白,参与Wnt、JNK、TGF-β及p53等多种信号转导途径的调控[13-17].在p53信号通路中,Axin与p53、HIPK2及Daxx等相互作用形成复合物,诱导p53的转录活化,共同促进细胞的凋亡[18-19].我们曾报道过 Mdm2在 Axinp53通路中不依赖于其泛素连接酶的抑制功能[20].Mdm2可通过竞争结合p53与HIPK2破坏Axin/p53/HIPK2活化复合体的形成,从而抑制p53的转录激活及其诱导的细胞凋亡[20].然而,MdmX是否参与Axin-p53信号通路的调控,其作用机制等仍未知.基于MdmX与Mdm2在结构上的相似性及其在p53信号通路的重要作用,本文对MdmX在Axin-p53信号通路中的作用进行了研究.研究表明:与Mdm2相似,MdmX也能通过竞争Axin与p53的结合,从而抑制Axin对p53的转录激活.这一发现有助于全面了解MdmX的细胞生物学功能,丰富了Axin-p53信号通路的调控机理,并可为肿瘤的临床治疗提供新的线索.
1 材料与方法
1.1 材 料
使用的大部分药品与试剂分别购自美国Sigma公司、上海生工(Sangon)生物工程公司和华美(Sino-America)生物工程公司;限制性内切酶和DNA标准分子质量Marker购自大连宝生(Takara)生物工程公司;碱性磷酸酶(CIP)购自美国Promega公司;Klenow DNA聚合酶、T4DNA 连接酶(T4Ligase)、T4多核苷酸激酶(T4PNK)购自美国Invitrogen公司;用于免疫共沉淀和Western blotting分析的抗HA和DO-1抗体购自美国Santa Cruze公司;抗Axin和GFP的多克隆抗体由本实验室自行免疫新西兰兔后纯化获得;PVDF膜购自Millipore公司.
1.2 表达质粒的构建
常用的表达载体如pBluescriptⅡSK及pCMV5等由本实验室保存;Axin和p53全长表达质粒的构建参照文献[14,16];p53-luc荧光素酶报告基因质粒的构建参照文献[16];pEGFP-N1质粒购自Clontech公司;MdmX全长表达质粒的构建根据美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)核酸数据库中编号为NM_002393的MdmX mRNA 序 列 设 计 引 物 (5′-ATG ACA TCA TTT TCC ACC TCT-3′和5′-TTA TGC TAT AAA AAC CTT AAT-3′),以 HEK 293细胞的总 RNA 逆转录形成的cDNA为模板进行PCR,把MdmX全长PCR产物平端克隆到pBluescriptⅡSK中.测序验证后,用BamH I和XhoI亚克隆到表达载体pCMV5-HA 中,得到 pCMV5-HA-MdmX;MdmXΔp53则是以pCMV5-HA-MdmX为模板,通过点突变PCR的方法获得,所用引物序列为:5′-GAC ATC ATT TTC CAC CCT TAG CAC TTT AGC C-3′和 5′-GGC TAA AGT GAC AAG GGT GGA AAA TGA TGT C-3′.
1.3 细胞的培养与传代
所用的人胚胎肾细胞HEK 293与293T用含有10%(质量分数)小牛血清(FBS)、100IU青霉素和100μg/mL链霉素的DMEM培养基(GIBCO公司)进行培养,培养条件为37℃,5%(体积分数)CO2.细胞传代时,先将培养液吸去,用PBS缓冲液润洗一次,再加入适量含0.25%(质量分数)胰酶的0.02%(质量分数)EDTA溶液,使其覆盖细胞层,待细胞从培养瓶壁上脱落后,加入少量培养液终止胰酶的作用,再用移液管吹打数次使细胞彼此分开,加入适量的培养液将细胞吹打混匀后便可传代培养.
1.4 磷酸钙转染法
转染前24h消化细胞,离心去除胰酶消化液,加入适量的培养液,重悬浮细胞并均匀地平铺在60mm培养皿中,保持细胞密度约为40%~60%.转染前1h更换细胞培养液,小心加入约5mL预热的新鲜培养液,以免使贴壁好的细胞悬浮起来.磷酸钙-DNA沉淀的制备:在1.5mL离心管中加入220μL水,在水中央位置加入混匀好的DNA质粒.将31μL 2mol/L CaCl2小心加入到Eppendorff管底,再沿Eppendorff管壁逐滴加入2×HEPES缓冲液(1.6g NaCl、0.074 g KCl、0.027g Na2HPO4·2H2O、0.2g葡萄糖和1g HEPES依次溶解于90mL双蒸水中,用0.5mol/L NaOH将pH值调为7.05左右,加双蒸水定容至100 mL),在CaCl2与上层溶液形成的界面之间用移液枪吹出几个气泡以搅乱其界面,室温放置20~30min,使磷酸钙-DNA沉淀缓慢形成.用移液枪吹吸一次混匀后逐滴将磷酸钙-DNA沉淀加入细胞培养液中,轻微晃动使磷酸钙-DNA沉淀在细胞上分布均匀.
1.5 免疫共沉淀实验
转染后24~40h可收获细胞.将60mm细胞培养皿中的培养液吸去,加入500μL裂解缓冲液(20 mmol/L Tris-HCl(pH 7.4),150mmol/L NaCl,1 mmol/L EDTA,1mmol/L EGTA,1%(质量分数)Triton,2.5mmol/L 焦磷酸钠,1mmol/Lβ-巯基乙醇,1mmol/L钒酸钠,1μg/mL亮抑酶肽,1mmol/L蛋白酶抑制剂(PMSF),置于4℃裂解5min,用细胞刮将细胞从盘面刮下,收集在1.5mL Eppendorff管中.随后在冰上用超声处理10次,每次1s.超声处理后的细胞裂解液在4℃用13 200r/min离心30min.取50μL上清转移到新管,加入等量2×SDS样品缓冲液作为全细胞裂解液,置沸水煮10min,后放于-80℃备用.剩余上清用于免疫共沉淀分析.取5 μL蛋白A/G琼脂糖珠(Santa Cruz Biotech公司),用适量裂解缓冲液洗3次,每次3 000r/min离心3 min;洗完后,取5μL相应抗体与琼脂糖珠及400μL细胞裂解液上清和400μL裂解缓冲液混合,在4℃层析柜中缓慢颠倒混合3h,使蛋白从细胞裂解液中被特异性抗体免疫沉淀下来.免疫沉淀反应完成后,在4℃以3 000r/min速度离心3min,小心吸去上清,用500μL裂解缓冲液温和清洗琼脂糖珠3次,最后用30 μL裂解缓冲液重悬琼脂糖珠,再加入等量的2×SDS样品缓冲液,沸水煮10min,存于-80℃备用.
1.6 荧光素酶报告基因实验
铺适当密度的细胞于6孔或12孔细胞培养板中,待细胞贴壁生长到培养板孔面积的90%后,转染0.5μg荧光素酶报告基因、适量的质粒DNA,以及0.2μg pEGFP-N1.转染24h后,吸净培养液,向每孔加入200μL 细胞裂解液(0.05mol/L Tris(pH 7.8),1 mmol/L DTT,0.1% (质量分数)Triton-X100),使其覆盖细胞层,放入4℃充分裂解细胞10min.取50μL细胞悬液,与100μL荧光素/ATP混合溶液(ATP溶液:0.125mol/L Tris,25mmol/L MgCl2,2.4mg/mL ATP;荧 光 素 溶 液:0.278mg/mL 荧 光 素,5 mmol/L KH2PO4(pH 7.8))于涡旋混匀器快速混匀后,在荧光检测仪(Promega公司)读取发光值并记录.同时取剩余20μL裂解液上清,通过 Western blotting分析检测绿色荧光蛋白(GFP)表达量作为内标,以矫正系统读数.实验结果为至少5次实验的平均值.
2 结 果
2.1 MdmX能抑制Axin诱导的p53的转录激活
首先,运用荧光素酶报告基因系统检测MdmX对Axin激活p53转录活性的影响.在HEK 293细胞中转入0.5μg的p53-luc报告基因,然后以图1中的各种组合分别转染2μg Axin,3μg HA-MdmX 或将Axin和MdmX共转染,用空载体补平各孔细胞转入的DNA量,保证各蛋白表达水平基本一致,并且在每组细胞中共转染0.2μg的GFP作为内标.图1中的Western blotting结果为细胞中各蛋白的表达情况.可以看到,单转Axin时(第二道),荧光素酶活性增强了9倍左右,说明Axin强烈诱导p53的转录活性.而当MdmX与Axin共转染时(第四道),荧光素酶的活性明显下降,说明MdmX能抑制Axin对p53的激活.
2.2 MdmX与p53的结合域是其抑制Axin激活p53的关键
MdmX是如何抑制Axin对p53的激活成为我们研究的下一个重点.之前的研究发现Mdm2是通过与p53的结合抑制Axin对p53的激活[20],而MdmX具有与Mdm2相似的p53结合域,为了验证MdmX是否也能通过它与p53的结合对Axin激活p53产生影响,构建了MdmX缺失p53结合域的突变体MdmXΔp53.在HEK 293细胞中以图2中各组合方式转染2μg Axin,3μg MdmX及3μg MdmXΔp53,同时共转染0.5μg p53-luc荧光素酶报告基因和0.2 μg的GFP,用空载体补平各组细胞转入的DNA量,保证各蛋白表达水平基本一致.图2中的 Western blotting结果表示细胞中各蛋白的表达情况.可以看到,MdmXΔp53不能抑制Axin对p53的激活,说明MdmX可能通过与p53的结合抑制Axin对p53的转录激活.

图1 MdmX对Axin激活p53的影响Fig.1 Effect of MdmX on Axin-induced p53transcriptional activation

图2 MdmXΔp53对Axin激活p53的影响Fig.2 Effect of MdmXΔp53on Axin-induced p53transcriptional activation
2.3 MdmX竞争Axin与p53的结合
为了检测MdmX能否与Axin竞争结合p53,从而导致对Axin-p53信号通路的抑制,在HEK 293T细胞中转染2μg Axin,再共转入DNA浓度依次递增(0,2,4,8μg)的 HA-MdmX.转染24h后收集并裂解细胞,用耦联p53多克隆抗体的琼脂糖珠免疫沉淀细胞中内源的p53.Western blotting检测免疫沉淀物和全细胞裂解液,用抗p53的单克隆抗体DO-1、抗Axin和抗HA的抗体分别检测p53、Axin和MdmX的表达情况.如图3所示,随着MdmX表达量的增加,与p53共沉淀的Axin逐渐减少,说明MdmX可以减弱Axin与p53的相互作用.

图3 MdmX对Axin与p53相互作用的影响Fig.3 Effect of MdmX on the interaction between Axin and p53
通过上述荧光素酶报告基因实验,可以得知MdmX的p53结合域是其抑制Axin激活p53的关键,可以推测缺失p53结合域的MdmX是无法与Axin竞争p53结合的.在HEK 293T细胞中转染2 μg Axin,然后共转染不同浓度梯度(3和8μg)的HAMdmX或HA MdmXΔp53.转染24h后收集细胞,用耦联p53多克隆抗体的琼脂糖珠免疫沉淀内源p53,观察共沉淀的MdmX及其突变体的变化.如图4所示,MdmXΔp53由于不能与p53结合,不影响Axin与p53的相互作用,进一步验证了MdmX能通过与p53的结合抑制Axin与p53的相互作用.
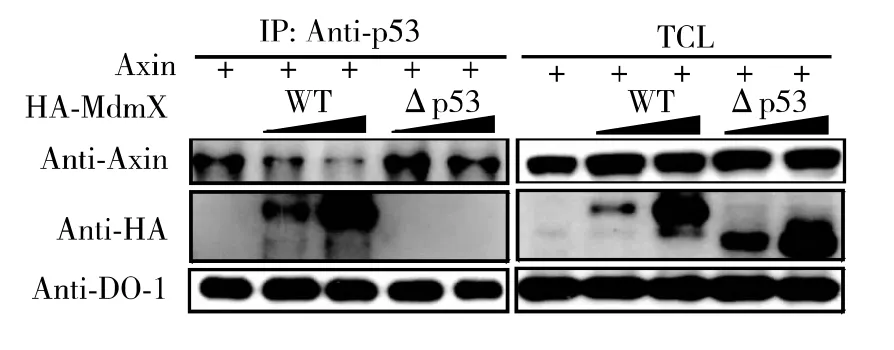
图4 MdmXΔp53对Axin与p53相互作用的影响Fig.4 Effect of MdmXΔp53on the interaction between Axin and p53
3 讨 论
MdmX与Mdm2均为p53信号通路中重要的负调控因子.Mdm2的主要功能为介导p53的泛素化降解,从而影响p53的稳定性,而MdmX则主要抑制p53的转录活性[12].本实验室前期的研究证明Axin/p53活化复合体在p53的转录激活及其诱导的细胞凋亡中起重要作用[20].本文的研究进一步发现 MdmX对Axin-p53信号通路的抑制与 Mdm2相似,都是通过竞争Axin与p53的结合而实现.这有别于以往认为的两者在作用机制上完全不同,提示结构上的相似性在某些基因调控方面还是起到类似的功能.但两者在Axin/p53活化复合体中的功能是否可以相互替代,或者两者需要协同进行作用应是下一步研究的重点.另外,MdmX能否与Axin/p53复合体中其他成员如HIPK2等发生相互作用而影响p53信号通路的调节,在各种DNA损伤刺激下其表达水平的变化对Axin/p53活化复合体有何影响等问题也很值得继续进行深入的研究.此外,MdmX在Axin-p53信号通路中的抑制作用也为某些肿瘤的临床治疗提供了新的线索.在很多有野生型p53表达的肿瘤中,如乳腺癌、胶质母细胞瘤、视网膜母细胞瘤及恶性神经胶质瘤等,发现有MdmX基因的扩增[8],在这些肿瘤细胞中Axin/p53活化复合体的功能会由于大量MdmX的竞争作用而被抑制.已有研究证明,在一定剂量的抗肿瘤药物阿霉素(doxorubicin)作用下,Axin/p53活化复合体会被诱导大量生成,引起细胞凋亡,抑制肿瘤的形成[20].但是其有效作用剂量较大,对正常细胞的损伤也很严重,具有很强的毒副作用.如果能加入MdmX与p53结合的阻断剂,使这些MdmX过表达的肿瘤细胞中Axin/p53活化复合体的作用不被 MdmX所抑制,就有望降低阿霉素的用量,减少治疗时对正常细胞的毒副作用,达到更好的肿瘤治疗效果.
[1]Shvarts A,Steegenga W,Riteco N,et al.MdmX:a novel p53-binding protein with some functional properties of Mdm2[J].EMBO J,1996,15:5349-5357.
[2]Marine J,Dyer M,Jochemsen A.MdmX:from bench to beside[J].J Cell Sci,2006,120(3):371-378.
[3]Wang X,Wang J,Jiang X.MdmX protein is essential for Mdm2protein-mediated p53polyubiquitination[J].J Biol Chem,2011,286(27):23725-23734.
[4]李小龙,高明.p53与 Mdm2及 MdmX的相互作用及研究进展 [J].中国肿瘤临床,2012,39(15):1123-1126.
[5]Tanimura S,Ohtsuka S,Mitsui K,et al.Mdm2interacts with MdmX through their RING finger domains [J].FEBS Lett,1999,447:5-9.
[6]Marine J.Mdm2and MdmX in cancer and development[J].Curr Top Dev Biol,2011,94:45-75.
[7]Parant J,Chavez-Reyes A,Little N,et al.Rescue of embryonic lethality in Mdm4-null mice by loss of Trp53suggests a nonoverlapping pathway with Mdm2to regulate p53 [J].Nat Genet,2001,29(1):92-95.
[8]赵婧,曲艺,母得志.Mdm2和Mdm4对p53调控研究进展 [J].医学研究杂志,2011,40(10):141-143.
[9]Montes R,Wagner D,Lozano G.Rescue of early embryonic lethality in Mdm2-deficient mice by deletion of p53[J].Nature,1995,378(6553):203-206.
[10]Honda R,Yasuda H.Activity of Mdm2,a ubiquitin ligase,toward p53or itself is dependent on the RING finger domain of the ligase[J].Oncogene,2000,19(11):1473-1476.
[11]Stad R,Little N,Xirodimas D,et al.MdmX stabilizes p53and Mdm2via two distinct mechanisms[J].EMBO Rep,2001,2(11):1029-1034.
[12]Marine J,Jochemsen A.MdmX as an essential regulator of p53activity[J].Biochem Biophys Res Commun,2005,331(3):750-760.
[13]Zeng L,Fagotto F,Zhang T,et al.The mouse Fused locus encodes Axin,an inhibitor of the Wnt signaling pathway that regulates embryonic axis formation[J].Cell,1997,90(1):181-192.
[14]Zhang Y,Neo S,Wang X,et al.Axin forms a complex with MEKK1and activates c-Jun NH (2)-terminal kinase/stress-activated protein kinase through domains distinct from Wnt signaling [J].J Biol Chem,1999,274(49):35247-35254.
[15]Liu W,Rui H,Wang J,et al.Axin is a scaffold protein in TGF-beta signaling that promotes degradation of Smad7 by Arkadia[J].EMBO J,2006,25(8):1646-1658.
[16]Rui Y,Xu Z,Lin S,et al.Axin stimulates p53functions by activation of HIPK2kinase through multimeric complex formation[J].EMBO J,2004,23(23):4583-4594.
[17]Luo W,Lin S.Axin:a master scaffold for multiple signaling pathways[J].Neurosignals,2004,13(3):99-113.
[18]Li Q,Lin S,Wang X,et al.Axin determines cell fate by controlling the p53activation threshold after DNA damage[J].Nat Cell Biol,2009,11(9):1128-1134.
[19]Li Q,Wang X,Wu X,et al.Daxx cooperates with the Axin/HIPK2/p53complex to induce cell death[J].Can Res,2007,67:66-74.
[20]He Y,Lian G,Lin S,et al.Mdm2inhibits Axin-induced p53activation independently of its E3ligase activity[J].PLOS One,2013,8(6):e67529.
