小鼠Agouti基因变异及生物信息学分析
2014-07-25何晓丹赵莹赵丽亚肖君华周宇荀李凯
何晓丹,赵莹,赵丽亚,肖君华,周宇荀,李凯
(1.东华大学生物科学与技术研究所,上海 2016203;2.上海实验动物研究中心,上海 201203)
在哺乳动物毛囊细胞中,α-促黑色素细胞激素(α-melanocyte stimulating hormone,α-MSH)与黑色素细胞膜上的黑素皮质素受体1(melanocortin-1 receptor,MC1R)结合,能激活膜上的腺苷酸环化酶系统,引起细胞内环腺苷酸的升高,从而激活酪氨酸酶,催化黑色素细胞从血液中摄取的酪氨酸经高尔基复合体变成多巴及多巴醌,最后合成皮肤黑色素的主要成分—真黑素[1-5]。Agouti基因编码的Agouti信号蛋白(Agouti signaling protein,ASP)对α-促黑色素细胞激素(α-MSH)和黑素皮质素受体MC1R的结合起到拮抗作用,从而使毛囊黑色素细胞合成褐黑素而不是真黑素[6]。
Agouti信号蛋白表达量的高低或者与受体结合能力的改变,会影响毛囊黑色素细胞合成真黑素或褐黑素能力[7-9]。Bultman 等[10]研究表明隐性等位基因a(non-agouti)是由于Agouti基因的第一个内含子中插入了一个11 kb的反转录转座子,使Agouti基因发生了功能丧失性突变。最典型的例子是C57BL/6J小鼠,该品系具有a/a基因型,不能正常表达Agouti信号蛋白,从而使褐黑素水平降低,真黑素升高,其皮毛呈现纯黑色。文献报道,可活黄Avy小鼠胚胎发育早期IAP启动子上CpG岛不同程度的甲基化会影响Agouti信号蛋白的表达,甲基化程度升高,后代小鼠毛发颜色也随之变深;反之,则变浅[11-14]。
本实验室在小鼠染色体工程研究[15]中,采集国内25个不同区域的野生小鼠作为供体,将C57BL/6J作为受体,选定1号染色体,采用连续回交的方法进行染色体替换,形成“特异染色体替换小鼠群体”。在该群体中,每个个体的1号染色体来源不同,其余染色体完全一致,都来源于C57BL/6J品系。利用SNP芯片,对“野生来源小鼠1号染色体替换系”进行全基因组扫描后,发现2号染色体上有一个与小鼠毛色紧密连锁的区段:rs13476817-rs13476889,其中存在一个与野生毛色相关的候选基因Agouti。为此利用生物信息学方法对Agouti基因及其编码产物的理化性质、序列特征、蛋白质结构以及生物学功能进行预测和分析,旨在分子水平理解Agouti基因编码序列的突变对毛色的影响,以期为进一步研究小鼠毛色的遗传规律提供理论依据。
1 材料与方法
1.1 动物饲养与样本采集
在构建野生小鼠1号染色体替换群体的过程中,人工筛选保留毛色深浅差异明显的8个灰色小鼠品系作为实验样本(回交7次后代),其供体分别源自崇明、泰州、嘉兴、南汇、雉城、临沂、枣庄、金山,对应图1中的1-4号和6-9号样本。C3H/He(购自上海实验动物资源中心西普尔-必凯公司)小鼠毛色为灰色,作为参照样本,对应图1中的5号样本。小鼠的饲养繁殖实验在东华大学实验动物设施内[SYXK(沪)2008-0059]进行。
取不同品系和C3H/He的成年小鼠背部皮肤,用清水洗净,烘干,利用电脑测色配色仪Datacolor 650测其K/S,K表示被测物体的吸收系数,S表示散射系数。根据Kubelka-Munk染色深度方程计算固体试样中的有色物质浓度,K/S值越大,有色物质浓度越高,即固体试样表面颜色越深。
1.2 DNA提取及芯片分析
DNA提取采用Axygen基因组DNA抽提试剂盒,操作步骤依说明书进行。以0.8%琼脂糖凝胶电泳和NanoDrop 2000c超微量分光光度计(Thermo Fisher Scientific,美国)确定DNA质量和浓度。SNP芯片采用 Mouse MD linkage(Illumina,美国),由晶能生物技术(上海)有限公司完成。
1.3 RNA提取与逆转录PCR
Trizol法抽提5日龄的小鼠皮肤组织样本总RNA,具体操作按照说明书进行。提取的总RNA用DEPC处理水充分溶解,1%琼脂糖凝胶电泳检测其完整性,-80℃保存备用。
用Thermo Scientific RevertAid First Strand cDNA Synthesis Kit进行逆转录合成cDNA,操作参照说明书进行。PCR反应体系(25 μL):10×PCR buffer 2.5 μL,dNTPs(2.5 mmol/L)2.5 μL,上下游引物(2 μmol/L)各 1.25 μL,Taq 酶 1.5 U 和 cDNA 模板30 ng,DEPC处理水补足。PCR反应程序:95℃预变性2 min;95℃变性30 s,61℃退火90 s,72℃延伸1 min,40个循环;72℃延伸10 min后冷却至4℃保存。扩增产物经1.5%琼脂糖凝胶电泳检测后,送上海生工生物工程有限公司进行测序。
1.4 数据分析
对全基因组SNP芯片扫描数据进行单倍型分析,卡方检验单倍型与理论值的差异。采用Chromas软件分析测序序列,并用DNAMAN软件将测序所得序列与NCBI上的其他哺乳动物序列进行相似性比较。由 PROVEAN[16](http://provean.jcvi.org/index.php)预测氨基酸替换对蛋白质生物功能的影响。使用 PDBsum Generate(http://www.ebi.ac.uk/thorntonsrv/databases/pdbsum/Generate.html)进行蛋白质二级结构预测和比对,以及Swiss-Model(http://swissmodel.expasy.org/)和Swiss-PdbView软件分别预测蛋白质的三级结构以及其与受体的结合情况。
2 结果
2.1 小鼠毛色表型差异
根据直接观察,8个品系小鼠间存在明显色差(图1A),利用电脑测色配色仪检测这几个品系和C3H/He小鼠毛色(图1B),C3H/He小鼠的K/S值为13.44,8个品系的K/S值分别居于其两侧。按C3H/He小鼠的K/S值为界划分,可将这8种品系的小鼠划分为浅灰和深灰两种类型。

图1 不同品系灰色小鼠皮毛(A)与色深(B)Fig.1 Different skin fur(A)and shades(B)of different gray mice
2.2 全基因组扫描与候选基因定位
对N7代小鼠进行SNP array芯片全扫,共扫描1449个位点。扫描结果显示(表1),在野生小鼠连续回交七代后,部分染色体上仍存在少量的杂合子。比较黑色小鼠和灰色小鼠的杂合度与理论值的差异,发现2号染色体(P<0.01)明显偏离理论值,达极显著差异;而其他染色体上的P值皆大于0.2,表明与理论值相接近,差异无显著性。
对其进行单倍型分析,结果如图2所示,将毛色相关基因定位到2号染色体上的rs13476817和rs13476889之间。上述两个 SNP遗传距离在60.37cM和97.89cM之间,候选区段内只有Agouti基因与小鼠毛色相关,因此选定该基因为候选基因。
2.3 测序及氨基酸对比结果
2.3.1 候选基因的cDNA序列多态性
候选基因cDNA测序结果表明Agouti基因开放读码框(ORF)长396 bp,编码的Agouti信号蛋白具有131个氨基酸(图3A)。与NCBI参考序列比对,确定C3H/He小鼠的Agouti基因序列无任何变化,因此定义为野生型。
8个品系加上C3H/He小鼠的多序列比对结果显示,浅灰鼠或深灰鼠在其编码框的第37 bp处都具有A→G突变;浅灰鼠在108 bp和110 bp处发生G→A突变,以及在309 bp处发生A→G突变;深灰鼠在286 bp处发生C→G突变。在这5个发生突变的位点中,其中有4个位点发生碱基转换,1个位点发生碱基颠换。根据比对结果,将浅灰鼠发生的突变类型定义为Ⅰ类突变型,有三个碱基转换;深灰鼠发生的突变类型定义为Ⅱ类突变型,有一个碱基转换和一个碱基颠换。

表1 全基因组扫描结果Tab.1 The results of genome-wide scan

图2 单倍型分析结果Fig.2 The results of haplotype analysis
2.3.2 氨基酸序列多态性
氨基酸序列比对结果表明(图3B),两类突变型在第108位和309位的碱基被替换后所编码的氨基酸保持不变,产生同义突变;第37位的突变发生在信号肽上,导致丝氨酸突变为甘氨酸。Ⅰ类突变型第110位的突变发生在功能区的N端,导致精氨酸突变为谷氨酰胺。Ⅱ类突变型第286位的突变发生在富含半胱氨酸的C末端,导致精氨酸突变为甘氨酸。分别将这三处突变进一步分析。
利用Signal P 4.1 Server软件分析Ⅰ类突变型和Ⅱ类突变型的Agouti信号蛋白,表明信号肽上的突变没有影响蛋白质的功能,其信号肽的长度、剪切位点仍与野生型的一致。
为增加检测的灵敏度,利用PROVEAN预测单一氨基酸替换对Agouti信号蛋白质功能区的影响,设定阈值为-1.3,其准确度(balanced acurracy)达到76.1%。此时发现Ⅰ类突变型功能区的R37Q的得分为-0.103,大于-1.3,说明该突变对Agouti信号蛋白的功能无明显影响;而Ⅱ类突变型C末端的R96G的得分为-1.344,小于-1.3,则该突变可能影响Agouti信号蛋白的功能。
2.3.3 序列保守性
哺乳动物间Agouti信号蛋白的多序列比对结果显示(如图4),Agouti信号蛋白在不同物种间相似性较高,小鼠和人类、牛、马、兔、羊等的相似性分别为79%、77%、77%、81%、76%。在不同物种间,第13位和第37位的氨基酸则都存在不同程度的多态性。该分析还表明,C末端的半胱氨酸富含区具有高度的保守性,其中第101位(即小鼠Agouti基因氨基酸序列的第96位)的氨基酸均为精氨酸(R),在不同物种间极为保守,因此Ⅱ类突变型C末端的R96G有可能影响蛋白质性质与功能。
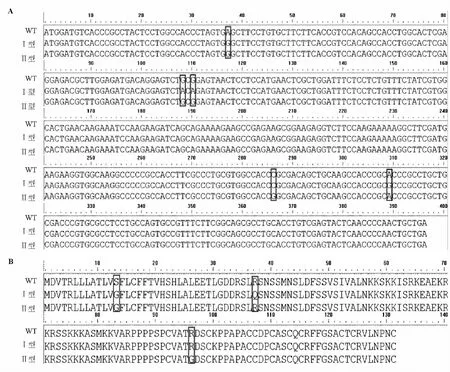
图3 Agouti基因cDNA序列多态性(A)和氨基酸(B)序列多态性Fig.3 The polymorphisms of Agouti cDNA sequence(A)and amino acid sequence(B)
2.4 ASP信号蛋白结构预测
2.4.1 氨基酸改变对蛋白质二级结构的影响
分别对野生型、Ⅰ类突变型和Ⅱ类突变型的Agouti信号蛋白进行二级结构预测,如图5A所示。结果表明Ⅰ类突变型和野生型的二级结构一致,Ⅱ类突变型的Agouti信号蛋白二级结构的C末端比野生型多了一个γ转角和一个二硫键,但少了一个β转角,该β转角的缺失导致Ⅱ类突变体上其余的β转角相较于野生型都发生了不同程度的变化(图5B),这些突变可能会改变Agouti信号蛋白的三级结构。
2.4.2 预测Agouti信号蛋白的三级结构与受体的结合
预测Agouti信号蛋白的三级结构时发现,相较于野生型,Ⅰ类突变型未发生任何变化,Ⅱ类突变型Agouti信号蛋白的C末端缺失一个β折叠(如图6所示箭头),导致Agouti信号蛋白的正确折叠受到影响,这一结果符合Agouti信号蛋白的C末端(92-131AA)高度保守[17]的特性。
在模拟Agouti信号蛋白与黑素皮质素受体MC1R的结合(图7)时发现,Ⅱ类突变型的空间结构由紧密型变为疏散型。从三维结构模拟图中可以看出,野生型Agouti信号蛋白与受体MC1R结合的残基为116位精氨酸(Arg)、117位苯丙氨酸(Phe)和118位的苯丙氨酸(Phe),配体与受体结合紧密。但是突变后的Agouti信号蛋白与受体结合的残基仅剩117位的苯丙氨酸(Phe),与受体的结合明显松散。
3 讨论
本研究在深灰色与浅灰色小鼠这两组小鼠中,共发现5个SNPs,产生3个氨基酸突变,其中两个无明显影响,第三个突变改变了Agouti信号蛋白的正确折叠,进而影响了Agouti信号蛋白的结构与功能。

图4 12种哺乳动物Agouti基因在氨基酸组成上的比较分析Fig.4 Comparative analysis of amino acid composition of Agouti gene in twelve mammals
从物种间的保守性角度来分析,Agouti基因在C末端非常保守,尤其是92~131氨基酸,而本研究的C末端R96G恰好位于该区域,该位点在物种间相似性程度达100%,推测该区域内的突变会导致生物学功能的改变。
Willard等[18]用酶对Agouti信号蛋白进行消化后发现,C末端(保留81~131氨基酸残基的蛋白片段)仍具有完整的Agouti信号蛋白生物活性;研究Agouti基因的突变发现,Agouti信号蛋白(ASP)的N端糖基化位点和主要富含半胱氨酸区的C末端对保留ASP完整的生物学功能十分重要,而富含赖氨酸/精氨酸残基的中间区的基因突变似乎不影响ASP的生物学功能[19-20]。本研究证实,Ⅰ类突变型Agouti编码区的突变没有发生在N端连接的糖基化位点和C末端,对蛋白质的结构和功能没有任何影响。Ⅱ类突变型的Agouti编码区的突变不仅发生在Agouti信号蛋白的C末端,而且还发生在KxxxxKxxR这个重要的模序[21]中。
根据文献报道,Agouti信号蛋白C末端第83位Val→Ala的突变会降低抑制 α-MSH结合到受体MC1R的能力[23]。这与本研究发现Agouti信号蛋白C末端R96G会降低ASP与MC1R结合效价的结果相一致。进一步利用生物信息学分析时发现,该突变使Ⅱ类突变型Agouti信号蛋白在突变位点比野生型缺少了一个β折叠,导致其构象不如野生型紧密;同时其与受体MC1R的结合位点仅剩117位的苯丙氨酸,而不是残基三联体(Arg-Phe-Phe,RFF)[21-22],导致与受体的结合能力有所下降。利用电脑测色配色仪对不同品系间存在毛色差异的小鼠进行毛色检测(图1),发现Ⅱ类突变型小鼠的毛色相较于野生型和Ⅰ类突变型小鼠偏向于较深的灰色。

图5 Agouti信号蛋白二级结构预测Fig.5 Prediction of the secondary structure of Agouti signaling protein
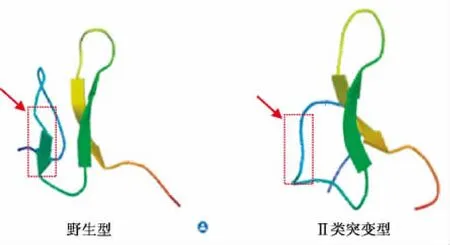
图6 Agouti信号蛋白的三级结构预测Fig.6 Prediction of the tertiary structure of Agouti signaling protein

图7 Agouti信号蛋白与受体MC1R的结合Fig.7 Agouti signaling protein binding to MC1R
综上所述,本研究在候选基因Agouti编码区发现的突变(R96G)为重要错义突变,生物信息学预测该突变降低了Agouti信号蛋白抑制α-MSH结合到受体MC1R的能力,使毛囊黑色素细胞主要合成真黑素而不是褐黑素,导致真黑素/褐黑素的比例升高,影响毛色的表型。
[1]Klungland H,Våge DI,Gomez-Raya L,et al.The role of melanocyte-stimulating hormone(MSH)receptor in bovine coat color determination[J].Mamm Genome,1995,6(9):636-639.
[2]Kondo T,Hearing VJ.Update on the regulation of mammalian melanocyte function and skin pigmentation[J].Expert Rev Dermatol,2011,6(1):97-108.
[3]Videira IF,Moura DF,Magina S.Mechanisms regulating melanogenesis[J].An Bras Dermatol,2013,88(1):76-83.
[4]Chluba-de Tapia J,Bagutti C,Cotti R,et al.Induction of constitutive melanogenesis in amelanotic mouse melanoma cells by transfection of the human melanocortin-1 receptor gene [J].J Cell Sci,1996,109:2023-2030.
[5]Kingsley EP,Manceau M,Wiley CD,et al.Melanism in peromyscus is caused by independent mutations in Agouti[J].PLoS ONE.2009,4(7):e6435.
[6]Swope VB,Jameson JA,McFarland KL,et al.Defining MC1R regulation in human melanocytes by its agonist α-melanocortin and antagonists agouti signaling protein and β-defensin 3 [J].J Invest Dermatol,2012,132(9):2255-2262.
[7]Sakai C,Ollmann M,Kobayashi T,et al.Modulation of murine melanocyte function in vitro by agouti signal protein [J].EMBO J,1997,16(12):3544-3552.
[8]Suzuki H.Evolutionary and phylogeographic views on Mc1r and Asip variation in mammals [J].Genes Genet Syst,2013,88(3):155-164.
[9]杨云青,高丹玫,郭宗圣.Agouti和Agouti相关蛋白的一些生物学内涵[J].动物学杂志,2008,43(5):144-152.
[10]Bultman SJ,Klebig ML,Michaud EJ,et al.Molecular analysis of reverse mutations from nonagouti(a)to black-and-tan(at)and white-bellied agouti(Aw)reveals alternative forms of agouti transcripts[J].Genes Dev,1994,8(4):481-490.
[11]Waterland RA,Jirtle RL.Transposable elements:targets for early nutritional effects on epigenetic gene regulation[J].Mol Cell Biol,2003,23(15):5293-5300.
[12]Dolinoy DC,Weidman JR,Waterland RA,et al.Maternal genistein alters coat color and protectsAvymouse offspring from obesity by modifying the fetal epigenome[J].Environ Health Perspect,2006,114(4):567-572.
[13]Dolinoy DC,Huang D,Jirtle RL.Maternal nutrient supplementation counteracts bisphenol A-induced DNA hypomethylation in early development[J].Proc Natl Acad Sci U S A,2007,104(32):13056-13061.
[14]Rosenfeld CS,Sieli PT,Warzak DA,et al.Maternal exposure to bisphenol A and genistein has minimal effect onAvy/aoffspring coat color but favors birth of agouti over nonagouti mice [J].Proc Natl Acad Sci U S A,2013,110(2):537-542.
[15]晁天柱,陈国强,赵莹等.用于“野生小家鼠来源一号染色体替换系”构建的PCR-LDR分型系统[J].中国实验动物学报,2011,19(5):372-376.
[16]Choi Y,Sims GE,Murphy S,et al.Predicting the functional effect of amino acid substitutions and indels[J].PLoS ONE,2012,7(10):e46688.
[17]Miltenberger RJ,Mynatt RL,Bruce BD,et al.An agouti mutation lacking the basic domain induces yellow pigmentation but not obesity in transgenic mice[J].Proc Natl Acad Sci U S A,1999,96(15):8579-8584.
[18]Willard DH,Bodnar W,Harris C,et al.Agouti structure and function:characterization of a potent alpha-melanocyte stimulating hormone receptor antagonist[J].Biochemistry,1995,34(38):12341-12346.
[19]Eberle AN,Bódi J,Orosz G,et al.Antagonist and agonist activities of the mouse agouti protein fragment(91-131)at the melanocortin-1 receptor[J].J Recept Signal Transduct Res,2001,21(1):25-45.
[20]Perry WL,Nakamura T,Swing DA,et al.Coupled site-directed mutagenesis/transgenesis identifies important functional domains of the mouse agouti protein[J].Genetics,1996,144(1):255-264.
[21]Virador VM,Santis C,Furumura M,et al.Bioactive motifs of agouti signal protein [J].Exp Cell Res,2000,259(1):54-63.
[22]Patel MP,Cribb Fabersunne CS,Yang YK,et al.Loop-swapped chimeras of the agouti-related protein and the agouti signaling protein identify contacts required for melanocortin 1 receptor selectivity and antagonism [J].J Mol Biol,2010,404(1):45-55.
[23]Kiefer LL,Ittoop OR,Bunce K,et al.Mutations in the carboxyl terminus of the agouti protein decrease agouti inhibition of ligand binding to the melanocortin receptors[J].Biochemistry,1997,36(8):2084-2090.
